

2. 南京医科大学江苏省现代病原生物学重点实验室, 江苏 南京 211166
2. Jiangsu Key Lab of Pathogen Biology, Nanjing Medical University, Nanjing 211166, China
血吸虫病是在全球广泛流行, 且严重危害人类健康和生活的感染性寄生虫疾病之一。已经明确血吸虫感染可以导致虫卵沉积肝脏, 形成虫卵肉芽肿, 并继发纤维化, 是其最严重的病理变化[1]。迄今的研究已经公认, CD4+T应答介导了血吸虫肝脏病理的形成发展, 其中, 有关Th1/Th2应答介导血吸虫肝脏病理的研究是最明确和最多的[2-3]。近年来, 研究报道Th17和Treg应答也参与调控血吸虫病肝脏肉芽肿的发生发展[4-5]。血吸虫可溶性虫卵抗原(soluble egg antigen, SEA)可以引起机体的Th17应答, 其产生的IL-17A能募集中性粒细胞到虫卵周围, 促进肉芽肿的形成发展, 而Treg细胞也在肉芽肿的形成发展中发挥负向调控作用, 但目前具体机制不清楚。研究发现, Th17/Treg平衡在肝损伤病程发展中发挥重要调节作用。因此, 从调控Th17/Treg应答平衡入手, 寻找有效的治疗药物, 可以成为防治血吸虫肝脏肉芽肿的合理切入点。
白藜芦醇是一种存在于虎杖、花生等多种植物中, 具有多样生物学效应的天然活性成分[6-7], 其具有的免疫调节功能, 已经被证明可治疗或改善多种免疫性疾病。本课题组前期研究发现, 白藜芦醇可以调控Th1/Th2应答, 抑制血吸虫病的肝脏纤维化, 但是白藜芦醇是否也可以通过调控Th17/Treg应答, 影响血吸虫病肝脏肉芽肿, 目前还未有研究[8]。文献报道, 白藜芦醇可以上调Treg应答治疗溃疡性肠炎, 同时, 其还可以通过抑制中性粒细胞趋化, 发挥抗炎效应[9-10]。这些都提示白藜芦醇可能通过调控Th17/Treg应答, 抑制血吸虫病肝脏肉芽肿。本研究拟采用白藜芦醇灌胃日本血吸虫感染小鼠, 探讨白藜芦醇对Th17/Treg平衡及相应肝脏肉芽肿的影响, 为白藜芦醇治疗血吸虫病提供更多的理论依据。
1 材料与方法 1.1 实验动物与阳性钉螺清洁级6~9周龄♀C57BL/6小鼠60只, 购自南京大学模式动物研究所[SCXK(苏)2015-0001]。日本血吸虫感染性钉螺, 购自江苏省血吸虫病防治研究所。
1.2 试剂白藜芦醇(纯度为98%以上, 批号:KA080CA14), 购自上海源叶生物技术有限公司; 吡喹酮, 购自南京制药厂有限公司(批号:20091202);流式抗体仓鼠抗小鼠CD3e-APC、大鼠抗小鼠IL-17-PE、大鼠抗小鼠CD4-FITC、Treg检测试剂盒, 均购自eBioscience公司; 破膜固定剂试剂盒(Fix/Perm Cell Permeabilization Kit)购自BD公司; 小鼠Foxp3、IL-17A、CXCL1、CXCL2的引物, 购自上海英骏生物技术有限公司; 逆转录试剂盒, 购自Fermantas公司; SYBR Green PCR Master Mix, 购自Roche公司。
1.3 仪器FACS Calibur流式细胞仪(BD公司); CO2培养箱(Thermo Forma公司); 7 500型实时定量PCR仪(美国Applied Biosystems公司); 低温离心机(德国Eppendorf公司); 超净工作台(苏州佳宝净化工程设备有限公司); 倒置显微镜与照像系统(日本Nikon公司)。
1.4 感染模型的建立与分组C57BL/6小鼠45只, 每只小鼠经腹部皮肤感染日本血吸虫尾蚴(12±2)条。自感染3周后, 血吸虫感染小鼠随机分为3组:感染组、白藜芦醇组(从感染第6周连续3周灌胃给予白藜芦醇20 mg·kg-1·d-1)、吡喹酮组(从感染后第3、6周, 分别灌胃给予吡喹酮500 mg·kg-1·d-1×3 d), 每组15只。另取正常健康小鼠15只作为对照组, 白藜芦醇和吡喹酮的剂量参照已发表文献[8]。
1.5 病理学检查在血吸虫感染第9周, 摘取各组小鼠的肝脏左叶, 多聚甲醛固定, 进行石蜡包埋, 切片, 苏木精-伊红(hematoxylin-eosin staining, HE)染色, 于低倍镜(×200)下选取单个虫卵肉芽肿, 采用Axiovision software计算肉芽肿面积, 每只小鼠取50~100个单个虫卵肉芽肿面积的均值为有效值。根据HE染色下的中性粒细胞特征, 计数单个虫卵肉芽肿中的中性粒细胞数目, 每只小鼠取50个单个虫卵肉芽肿进行中性粒细胞计数。
1.6 小鼠成虫及肝脏虫卵计数在感染第9周处死各组小鼠, 采用生理盐水心脏灌注法结合玻片挤压法, 从门静脉收集虫体, 计算成虫数目。取一小块肝脏, 称取重量(M)后, 放入5% KOH中, 37 ℃孵育过夜。待肝脏全部消化后, 用5 mL PBS重悬, 1 500 r·min-1、4 ℃离心10 min, 弃上清。再用1 mL PBS缓冲液重悬虫卵, 取10 μL虫卵悬液放到载玻片上, 盖上盖玻片, 在显微镜下计数, 每只小鼠计数至少4次, 取多次计数的平均值(N)。采用公式计算得出每克肝脏虫卵数:每克肝脏虫卵数=N×200/M。
1.7 体外SEA刺激和分组取6~9周龄♀C57BL/6小鼠的脾脏, 研磨制备成单细胞悬液, 用完全RPMI 1640培养基, 将细胞浓度调至2×109·L-1, 接种于96孔培养板, 分为4组:PBS处理组(只加入PBS)、SEA处理组(加入终浓度为20 mg·L-1的SEA)、白藜芦醇处理组(终浓度为20 mg·L-1 SEA+终浓度20 mg·L-1白藜芦醇)、吡喹酮处理组(终浓度为20 mg·L-1 SEA+终浓度100 mg·L-1吡喹酮), 共培养72 h后收集细胞。
1.8 流式细胞术检测脾淋巴组织中Th17和Treg细胞比例在感染第9周, 制取小鼠脾脏单细胞悬液, 浓度调至1×109·L-1。取1 mL细胞悬液, 加入浓度为1 mg·L-1佛波酯(phorbol-12-myristate-13-acetate, PMA)、50 mg·L-1离子霉素及0.7 mL·L-1莫能菌素(Golgistop), 培养6 h。重悬细胞于100 μL PBS。加入CD3e-APC(0.2 g·L-1)和CD4-FITC(0.5 g·L-1)抗体, 4 ℃避光孵育20 min。PBS清洗1遍, 加入Fixation/ Permeabilization Solution 1 mL, 4 ℃避光孵育40 min。离心去上清, 加入100 μL Perm/Wash buffer重悬细胞, 加入抗体IL-17-PE(0.2 g·L-1), 4 ℃避光孵育30 min。洗2遍, 加入质量浓度为10 g·L-1的多聚甲醛500 μL, 用流式细胞仪检测。对Treg细胞, 加入0.6 μL CD4-FITC(0.5 g·L-1)和0.6 μL CD25-APC(0.2 g·L-1)抗体, 4 ℃避光孵育30 min。重悬细胞于100 μL Flow cytometry staining buffer中, 加入Fixation/Permeabilization工作液1 mL, 于4 ℃避光孵育2 h。洗2遍, 重悬细胞于100 μL Permeabilization buffer中, 加2μL Fc受体阻断剂, 4 ℃避光孵育15 min。加入2.5 μL Foxp3-PE, 4 ℃避光孵育30 min后, 洗2遍, 加入质量浓度为10 g·L-1的多聚甲醛500 μL, 流式细胞仪检测。
1.9 实时定量RT-PCR检测肝组织中IL-17A、Foxp3、CXCL1、CXCL2的mRNA水平摘取感染9周的每组小鼠肝组织50 mg, TRIzol提取总RNA, 按M-MLV转录cDNA。IL-17A、Foxp3、CXCL1、CXCL2的反应体系都为SYBR Green PCR Master Mix 10 μL, 反转录cDNA 5 μL, 上游引物1 μL, 下游引物1 μL, ddH2O 3 μL, 总体积20 μL。实时荧光定量PCR的反应条件为:95 ℃ 10 min, 40个循环:60 ℃ 60 s, 95 ℃ 15 s, 熔解曲线60~90 ℃保证扩增为单一产物。以Ct值进行结果分析, 采用相对量法与内参β-actin进行比较。2-ΔCT法计算, ΔCt=Ctgene-Ctcontrol。
1.10 统计学分析数据结果用SPSS 15.0软件进行统计分析, 并用GraphPad Prism 7.0软件制作统计图。多组间差异比较采用F检验。
2 结果 2.1 不同治疗组小鼠的肝脏肉芽肿病理日本血吸虫感染后第9周, 光镜下可见健康对照组小鼠的肝脏正常, 未见任何病理变化; 感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠肝脏中均可见明显的虫卵肉芽肿。计算单个虫卵肉芽肿面积发现, 白藜芦醇和吡喹酮治疗组单个虫卵肉芽肿面积明显小于感染组(P < 0.01), 且白藜芦醇治疗组单个虫卵肉芽肿面积小于吡喹酮治疗组(P < 0.05)(Fig 1A、1B)。统计比较组成单个虫卵肉芽肿的各类细胞发现, 白藜芦醇治疗组肉芽肿中的中性粒细胞数量明显少于感染组和吡喹酮治疗组(P < 0.01, Fig 1C)。提示白藜芦醇能明显抑制血吸虫肝脏肉芽肿反应。
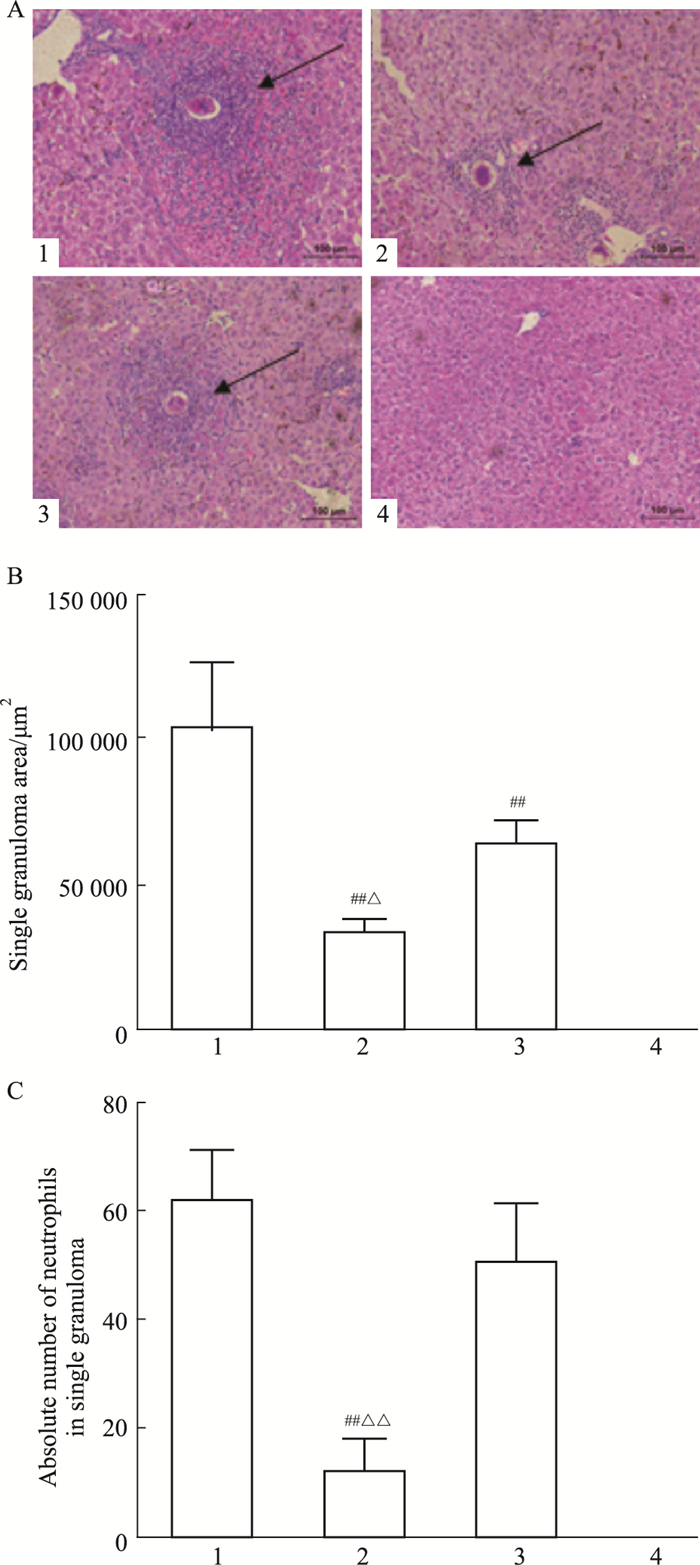
|
| Fig 1 The hepatic granuloma in different groups(x±s, n=15) 1:infected; 2:resveratrol; 3:praziquantel; 4:control.A:Single granuloma in liver; B:Areas of single granuloma; C:Number of neutrophils in single granuloma.##P < 0.01 vs infected group; △P < 0.05, △△P < 0.01 vs praziquantel group. |
为了明确白藜芦醇是否通过影响成虫发育或者产卵情况, 从而抑制肝脏肉芽肿反应, 本研究检测血吸虫感染9周后, 不同治疗组的成虫荷和卵荷。如Fig 2所示, 感染组、白藜芦醇治疗组、吡喹酮治疗组均见由尾蚴发育而来的成虫, 且感染组、白藜芦醇治疗组的成虫荷均明显多于吡喹酮治疗组(P < 0.05)。在感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠肝脏中, 均见虫卵沉积。比较肝脏中的虫卵发现, 感染组、白藜芦醇治疗组的卵荷明显多于吡喹酮治疗组(P < 0.01)。不论是成虫荷还是卵荷, 感染组和白藜芦醇治疗组之间差异均无显著性(P>0.05)。

|
| Fig 2 Number of adult worms and eggs in different groups(x±s, n=15) 1:infected; 2:resveratrol; 3:praziquantel; 4:control.A:Number of adult worms; B:Number of eggs per gram in liver.△P < 0.05, △△P < 0.01 vs praziquantel group. |
如Fig 3所示, 血吸虫感染9周后, 与对照组相比, 感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠脾脏淋巴细胞中Th17细胞(CD3+CD4+IL-17+)占总T细胞(CD3+)的比例都明显增高(P < 0.05), Treg细胞(CD4+CD25+Foxp3+)占CD4+细胞的比例也明显增高(P < 0.05)。但是白藜芦醇和吡喹酮治疗组的Th17细胞比例明显低于感染组(P < 0.05), 而白藜芦醇治疗组和吡喹酮治疗组之间Th17细胞比例差异无显著性(P>0.05)。同时, 白藜芦醇治疗组的Treg细胞比例明显高于感染组和吡喹酮治疗组(P < 0.05), 而感染组与吡喹酮治疗组相比没有统计学差异(P>0.05)。
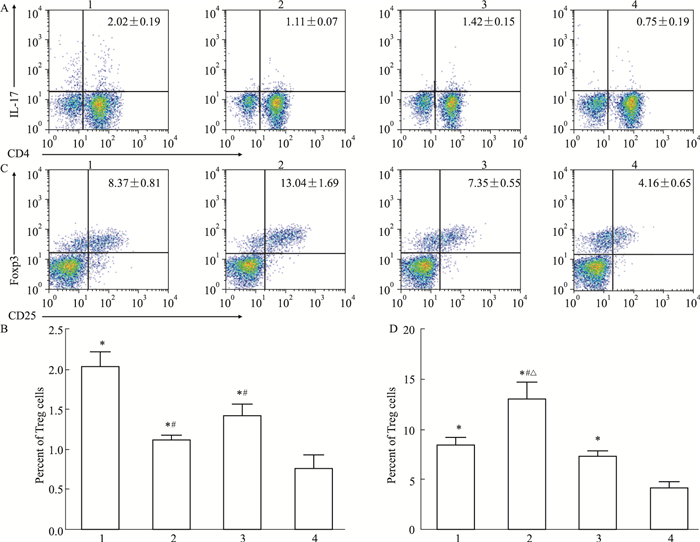
|
| Fig 3 Proportions of Th17, Treg cells in different groups (x±s, n=15) 1:infected; 2:resveratrol; 3:praziquantel; 4:PBS.A:Flow cytometry of Th17 cells; B:Percentage of Th17 cells; C:Flow cytometry of Treg cells; D:Percentage of Treg cells.*P < 0.05 vs control group; #P < 0.05 vs infected group; △P < 0.05 vs praziquantel group. |
如Tab 1所示, 血吸虫感染9周后, 与健康对照组比较, 感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠的肝脏中IL-17A、Foxp3、CXCL1、CXCL2 mRNA表达均明显增高(P < 0.01), 且感染组和吡喹酮治疗组小鼠肝脏IL-17A、CXCL1、CXCL2的mRNA表达水平均明显高于白藜芦醇治疗组(P < 0.05), 而白藜芦醇治疗组Foxp3 mRNA水平明显高于感染组和吡喹酮治疗组(P < 0.01)。感染组和吡喹酮治疗组IL-17A、Foxp3、CXCL1、CXCL2的表达差异无统计学意义(P>0.05)。
| Group | IL-17A | CXCL1 | CXCL2 | FOXP3 |
| Control | 0.986±0.082 | 1.024±0.014 | 0.968±0.476 | 0.978±0.475 |
| Infected | 4.517±0.845** | 7.713±0.997** | 10.933±1.556** | 16.787±2.112** |
| Resveratrol | 1.713±0.545**#△ | 3.167±0.345**#△ | 5.326±0.633**#△ | 47.673±10.950**##△△ |
| Praziquantel | 3.777±0.451** | 6.235±0.572** | 11.967±2.097** | 16.267±3.110** |
| **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs infected group; △P < 0.05, △△P < 0.01 vs praziquantel group | ||||
进一步采用体外实验验证, 如Fig 4所示, 与PBS处理组比较, SEA处理组、白藜芦醇处理组、吡喹酮处理组Th17和Treg细胞的比例均明显增高(P < 0.05)。但是, 白藜芦醇处理组Th17细胞比例明显低于SEA处理组和吡喹酮处理组(P < 0.05), 而SEA处理组和吡喹酮处理组Th17细胞比例差异无显著性(P>0.05)。同时, 白藜芦醇处理组Treg细胞比例明显高于SEA处理组和吡喹酮处理组(P < 0.05), 而SEA处理组和吡喹酮处理组Treg细胞比例差异无显著性(P>0.05)。
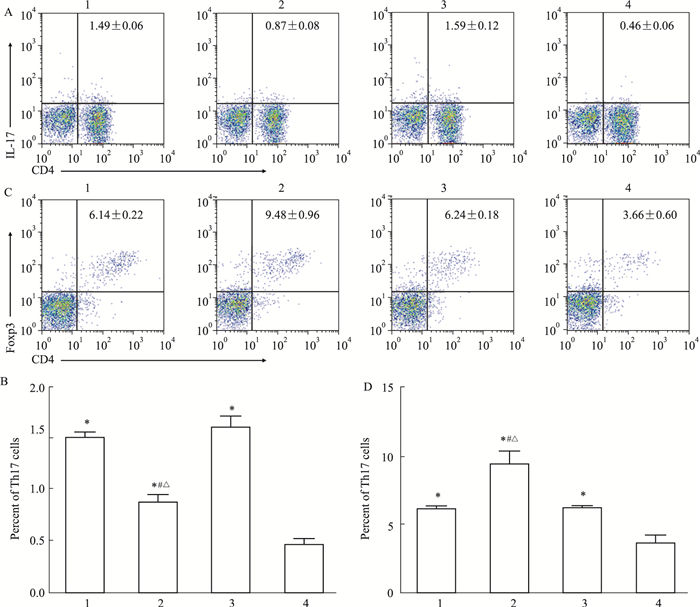
|
| Fig 4 Proportions of Th17, Treg cells in different treated groups in vitro (x±s, n=6) 1:infected; 2:resveratrol; 3:praziquantel; 4:PBS.A:Flow cytometry of Th17 cells; B:Percentage of Th17 cells; C:Flow cytometry of Treg cells; D:Percentage of Treg cells.*P < 0.05 vs PBS group; #P < 0.05 vs SEA group; △P < 0.05 vs praziquantel group. |
目前, 血吸虫病仍然在全球78个国家和地区广泛流行, 严重影响人类健康与生活。血吸虫感染宿主后成虫产卵, 虫卵分泌的SEA激活肝脏巨噬细胞, 经过巨噬细胞加工处理, 并呈递给辅助性T淋巴细胞(Th1、Th2、Th17、Treg), 诱导产生多种细胞因子及趋化因子等, 从而募集大量巨噬细胞、中性粒细胞、淋巴细胞、浆细胞、嗜酸粒细胞等, 聚集到虫卵周围形成炎性肉芽肿, 并继发纤维化, 导致严重的临床症状, 甚至死亡。其中, Th2细胞促进嗜酸性粒细胞的增殖、分化、募集至虫卵周围, 促进肉芽肿形成发展; Th17细胞通过产生IL-17、CXCL1、CXCL2等, 募集中性粒细胞至虫卵周围形成肉芽肿[2, 4]。而Th1和Treg细胞则发挥抑制肉芽肿反应的作用, 具体机制尚不清楚。因此, 寻找调控Th应答的药物成为防治血吸虫病肝脏病理的重要策略。
本课题组已经证明, 在血吸虫感染过程中, 白藜芦醇可以通过调控Th1/Th2应答, 发挥抑制肝纤维化的作用。这表明白藜芦醇在血吸虫感染中也具有免疫调节的功能。有文献报道, 白藜芦醇可通过下调Th17、上调Treg细胞应答, 减轻溃疡性结肠炎[9]。此外, 白藜芦醇还具有抑制趋化中性粒细胞的作用[10]。在血吸虫感染过程中, 白藜芦醇能否通过调控Th17/Treg应答, 发挥抗肉芽肿反应的作用?如果是, 是否通过抑制中性粒细胞趋化形成虫卵肉芽肿实现?本研究发现, 经白藜芦醇治疗后, 感染小鼠的肝脏肉芽肿反应明显减轻, 组成肉芽肿的中性粒细胞数量明显减少, 提示白藜芦醇具有治疗血吸虫病肝脏肉芽肿的作用。这可能成为本课题组前期证明白藜芦醇具有抗血吸虫病肝纤维化的原因之一。探寻白藜芦醇抗肝脏肉芽肿反应的机制发现, 白藜芦醇并不能减少血吸虫感染后的成虫数目和产卵数量, 提示白藜芦醇并不是与吡喹酮一样具有杀虫的作用, 且对虫卵没有影响, 因此, 杀虫不是白藜芦醇抑制肝脏肉芽肿反应的原因。
本研究发现, 经白藜芦醇治疗的血吸虫感染小鼠中, 组成肉芽肿的中性粒细胞明显减少, 结合文献报道, Th17应答通过产生IL-17A、CXCL1、CXCL2等, 趋化中性粒细胞形成肉芽肿的作用, 检测发现白藜芦醇治疗组Th17细胞比例明显下调, 肝脏中IL-17A、CXCL1、CXCL2表达也明显下降, 这些都与组成肉芽肿的中性粒细胞减少相一致。充分表明白藜芦醇通过抑制Th17应答, 减少中性粒细胞趋化形成肉芽肿。此外, 大量研究表明, Th17/Treg细胞之间存在复杂的相关性, 两者在功能和分化过程中相互拮抗[11]。当炎症发生时, 可导致两者失衡, 引起一系列的免疫病理[12]。而在血吸虫感染中, Th17和Treg应答恰对肝脏病理发挥相反的作用。本研究也发现, 白藜芦醇治疗的血吸虫感染小鼠Treg细胞比例上调, 肝脏中Foxp3表达水平增高, 这与减轻的肉芽肿反应相一致。上述的研究充分表明, 白藜芦醇可通过调控Th17/Treg应答, 抑制血吸虫病肝脏肉芽肿。
在血吸虫感染的过程中, SEA刺激巨噬细胞分泌的IL-10和TGF-β可诱导Treg产生[13]。此外, 巨噬细胞来源的IL-6、TGF-β、IL-21可诱导Th17的分化, 其产生的IL-23维持Th17的产生[14]。而研究发现, 在不同疾病中, 白藜芦醇可以通过直接调控巨噬细胞IL-6、IL-10、TGF-β等促炎或抑炎因子的表达, 发挥治疗作用[15]。提示白藜芦醇可能通过直接调控巨噬细胞分泌因子的表达, 介导Th17/Treg免疫应答的分化与功能, 成为白藜芦醇调控Th17/Treg应答, 抑制血吸虫病肝脏肉芽肿的具体机制, 值得进一步探寻。在本研究中, 还发现吡喹酮也能够抑制血吸虫肝脏肉芽肿反应, 体内研究发现, 吡喹酮能明显抑制Th17应答, 提示吡喹酮除了通过杀虫和直接对肝脏作用发挥抗纤维化作用, 也可能通过调控免疫应答如Th17, 发挥抗肝脏肉芽肿的作用, 但是, 在体外SEA刺激实验中, Th17应答并未发现与体内一样的现象, 分析吡喹酮可能是影响了血吸虫其他的抗原介导的Th17应答, 抑制肝脏肉芽肿的发生、发展。
综上所述, 白藜芦醇不仅可以通过调控Th1/Th2细胞应答, 抑制血吸虫病肝纤维化程度, 同时还可以下调Th17应答, 抑制中性粒细胞趋化, 上调Treg应答, 进而抑制血吸虫病肝脏肉芽肿反应。但具体的调控机制还未得到合理解释, 有待进一步探寻。本研究为白藜芦醇防治血吸虫病和其他免疫相关疾病提供实验依据。
| [1] |
Pearce E J, MacDonald A S. The immunobiology of schistosomiasis[J]. Nat Rev Immunol, 2002, 2(7): 499-511. doi:10.1038/nri843 |
| [2] |
Kaplan M H, Whitfield J R, Boros D L, et al. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response[J]. J Immunol, 1998, 160(7): 1850-6. |
| [3] |
Stadecker M J, Asahi H, Finger E. The immunobiology of Th1 polarization in high-pathology schistosomiasis[J]. Immunol Rev, 2004, 201(1): 168-79. |
| [4] |
Chen D, Luo X, Xie H, et al. Characteristics of IL-17 induction by Schistosoma japonicum infection in C57BL/6 mouse liver[J]. Immunology, 2013, 139(4): 523-32. doi:10.1111/imm.2013.139.issue-4 |
| [5] |
Turner J D, Jenkins G R, Hogg K G, et al. CD4+CD25+ regulatory cells contribute to the regulation of colonic Th2 granulomatous pathology caused by schistosome infection[J]. PLoS Negl Trop Dis, 2011, 5(8): e1269. doi:10.1371/journal.pntd.0001269 |
| [6] |
王坦, 张艳群, 曾永联, 等. 白藜芦醇抑制人肝癌SMMC-7721细胞增殖并降低mTOR蛋白磷酸化水平[J]. 中国药理学通报, 2017, 33(9): 1309-14. Wang T, Zhang Y Q, Zeng Y L, et al. Effect of resveratrol on proliferation of liver cancer SMMC-7721 cells and lowering levels of mTOR protein phosphorylation[J]. Chin Pharmacol Bull, 2017, 33(9): 1309-14. doi:10.3969/j.issn.1001-1978.2017.09.023 |
| [7] |
陈淳, 林建伟, 李国平, 等. 白藜芦醇调控大鼠急性肺栓塞后肺动脉高压及MCP-1表达的机制研究[J]. 中国药理学通报, 2017, 33(10): 1436-41. Chen C, Lin J W, Li G P, et al. Resveratrol down-regulates acute pulmonary thromboembolism-induced pulmonary artery hypertension and monocyte chemoattractant protein-1 in rats[J]. Chin Pharmacol Bull, 2017, 33(10): 1436-41. doi:10.3969/j.issn.1001-1978.2017.10.021 |
| [8] |
张伟伟, 朱继峰, 王任, 等. 白藜芦醇调控Th1和Th2应答抑制小鼠日本血吸虫病肝脏纤维化的研究[J]. 中国药理学通报, 2016, 32(8): 1091-7. Zhang W W, Zhu J F, Wang R, et al. The study on resveratrol inhibited hepatic fibrosis in mice with schistosomiasis japonica by modulating Th1 and Th2 responses[J]. Chin Pharmacol Bull, 2016, 32(8): 1091-7. doi:10.3969/j.issn.1001-1978.2016.08.012 |
| [9] |
Yao J, Wei C, Wang J Y, et al. Effect of resveratrol on Treg/Th17 signaling and ulcerative colitis treatment in mice[J]. World J Gastroenterol, 2015, 21(21): 5672-81. |
| [10] |
钟淼, 郭颖, 邓建云, 等. 异丹叶大黄素与白藜芦醇对兔外周血中性粒细胞功能的影响[J]. 药学学报, 1998, 33(11): 13-6. Zhong M, Guo Y, Deng J Y, et al. Effects of isorhapotigenin and resveratrol on function of peripheral blood polymorphonuclear leukocytes from rabbits[J]. Acta Pharm Sin, 1998, 33(11): 13-6. |
| [11] |
Zhou L, Lopes J E, Chong M M, et al. TGF-beta-induced Foxp3 inhibits Th17 cell differentiation by antagonizing RORgamma t function[J]. Nature, 2008, 453(7192): 236-40. doi:10.1038/nature06878 |
| [12] |
Yasumi Y, Takikawa Y, Endo R, et al. Interleukin-17 as anew marker of severity of acute hepatic injury[J]. Hepatol Res, 2007, 37(4): 248-54. doi:10.1111/hep.2007.37.issue-4 |
| [13] |
Cong Y, Konrad A, Iqbal N, et al. Generation of antigen-specific, Foxp3-expressing CD4+ regulatory T cells by inhibition of APC proteosome function[J]. J Immunol, 2005, 174(4): 2787-95. |
| [14] |
Shi G, Lovaas J D, Tan C, et al. Cell-cell interaction with APC, not IL-23, is required for naive CD4 cells to acquire pathogenicity during Th17 lineage commitment[J]. J Immunol, 2012, 189(3): 1220-7. doi:10.4049/jimmunol.1103033 |
| [15] |
Imler T J Jr, Petro T M. Decreased severity of experimental autoimmune encephalomyelitis during resveratrol administration is associated with increased IL-17+IL-10+ T cells, CD4(-) IFN-gamma+ cells, and decreased macrophage IL-6 expression[J]. Int Immunopharmacol, 2009, 9(1): 134-43. doi:10.1016/j.intimp.2008.10.015 |

