

肝再生是肝脏在化学损伤或者手术切除部分肝脏后,残留肝细胞通过细胞增殖由原来的基本不生长状态转变为快速生长状态,以恢复在功能和解剖学上损失的组织[1]。目前,人类面对的最主要致命疾病之一就是肝硬化和重型肝炎等肝病,在我国肝脏疾病发病率越来越高,肝脏疾病或损伤迁延不愈最终会发展成为肝硬化,甚至肝癌。从全球来看,在终末期肝病发病率方面,我国是最高的国家,每年新增患者在600万例以上[2]。严重的肝损伤往往需要进行肝脏移植,而这往往会加重患者的经济负担。如果能通过药物等手段使肝损伤后的肝脏得以修复,或者能促进肝部分切除术和肝脏移植后的肝脏再生,都是非常有意义的。因此,深入了解肝再生过程中的特点、规律和机制,并在此基础上进行适当干预,是目前一个非常重要的课题。本文就肝再生的影响因素、过程和机制、核因子E2相关因子2 (NF-E2-related factor 2, Nrf2)在肝再生中的作用以及影响肝再生的药物进行综述。
1 肝再生肝脏本身具有非常强的再生功能,肝部分切除后,剩余肝脏的肝细胞在分裂与增殖方面都特别活跃,短期内便可使肝脏恢复到原来的尺寸。以进行了肝切除的大鼠为例,切除其肝的90%之后,仅两个星期的时间,肝脏的重量就可以恢复到原来的水平,但是在这以后结构的恢复需要很长的时间,只有待新的肝小叶结构成形,原有功能才会恢复[3]。除了肝切除术后会出现肝再生,药源性肝损伤后也会出现肝脏再生,如大量长期使用对乙酰氨基酚(acetaminophen, APAP)后,肝脏会在成纤维细胞生长因子19的促进下再生[4]。
肝再生分为3个主要过程[5]:(1)启动阶段:肝再生启动阶段是指原来处于静止状态的肝细胞重新进入细胞周期。在此阶段中,涉及到的细胞因子主要包括肿瘤坏死因子α (tumor necrosis factor α,TNF-α)和白细胞介素6 (interleukin 6,IL-6)。机体切除肝脏之后,在1 h之内机体的TNF-α含量明显升高,因为TNF-α在肝再生的早期阶段和对应的受体结合之后,会产生一种特殊的细胞内信号,激活转录因子的启动。IL-6在急性反应后,与受体一起激活酪氨酸激酶,随后信号传导蛋白和转录激活物(signal transducers and activators of transcription 3, STAT3)被激活,表达增加,同时激活其他转录因子的表达,然后在生长因子的促进下,肝再生过程被启动。(2)增殖阶段:肝再生增殖阶段主要指肝细胞在促有丝分裂原的作用下,进行细胞分裂和增殖的过程。此阶段是整个肝脏再生的重要阶段,涉及到的最重要的细胞因子主要为表皮生长因子(epidermal growth factor, EGF)和肝细胞生长因子(hepatocyte growth factor, HGF)。(3)终止阶段:当细胞增殖完成后, 肝脏在组织学上的结构得以恢复,肝再生便进入终止阶段。参与此阶段的主要是卵圆细胞,它在肝脏细胞增殖过程中数目发生明显变化,推测它可能促进肝细胞的再生,促进了肝脏的修复。
2 Keap1-Nrf2-ARE信号通路Kelch样环氧氯丙烷相关蛋白-1(Keap1)是细胞氧化应激反应中的调控因子,为含有624个氨基酸的多肽,是Nrf2在细胞质中的结合蛋白。Nrf2是含有6个高度保守的结构域Neh的氧化应激转录因子,是抗氧化反应元件(antioxident response element, ARE)在靶基因的启动子[6]。通常情况下,Nrf2存在于细胞质中并与Keapl结合,起到将Nrf2固定在胞质中的作用,同时Keapl与泛素化连接酶结合,对Nrf2的泛素化与降解产生促进作用。在接触了一些外界刺激后,如经过活性氧(reactive oxygen species, ROS)、活性氮、脂质醛和15-脱氧-D-内源性前列腺素的刺激,Keap1和Nrf2会分离开来。一旦Nrf2进入细胞核,在Maf蛋白的作用下,Nrf2同ARE结合,启动下游基因的转录与表达,如抗氧化蛋白、Ⅱ相解毒酶、蛋白酶体Π分子伴侣等,从而发挥抵御内外界的有害刺激的作用[7],见Fig 1。
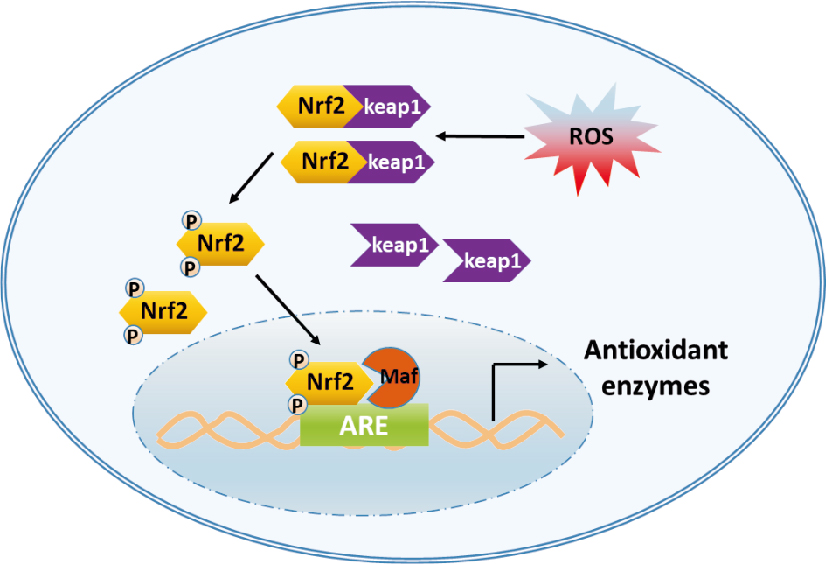
|
| Fig 1 Keap1-Nrf2-ARE signaling pathway |
在生理状态下,Nrf2参与调节氧化还原平衡、细胞的增殖、凋亡过程、炎症过程、物质代谢、蛋白质的折叠等。众所周知,Nrf2是机体氧化还原反应的主要调节器,它可以对多种抗氧化基因的表达产生促进作用,如谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、醌氧化还原酶1[NAD(P)H: quinone oxidoreductase 1, NQO1]、血红素加氧酶1(heme oxygenase-1, HO-1)、谷氨酸半胱氨酸连接酶催化亚基(glutamate cysteine ligase catalytic, GCLC)、谷氨酸半胱氨酸连接酶(glutamate cysteine ligase modifier subunit, GCLM)等[8]。Nrf2能降低药物对不同器官的毒性,如药物对脑、肺、皮肤、肝脏、肾脏的毒性,同时对某些疾病具有改善作用,Mao等[9]在实验中发现,小鼠由于缺乏Nrf2导致神经缺损和神经细胞凋亡、创伤性脑损伤、运动功能障碍和脊髓损伤。此外,Keap-Nrf2-ARE信号通路还与衰老、细胞损伤、生育等多方面关系密切。
3 Keap1-Nrf2-ARE信号通路与肝再生Nrf2-ARE信号通路通过多个环节对抗肝脏的氧化损伤,如调节肝脏的代谢、解毒和促进肝细胞增殖。大量研究发现,Nrf2通过调节肝细胞增殖而促进肝的再生。Zou等[10]通过实验结果得出Nrf2在肝再生中类似于一个细胞周期调节器,这个观点在肝脏部分切除手术中的小鼠上得以证实,他们发现Nrf2的缺乏不影响进入细胞周期的肝细胞数目,只是使细胞有丝分裂受到抑制。作者还证明在肝再生中,Nrf2通过细胞周期素A2(Cyclin A2)和Wee1/Cdc2/Cyclin Bl途径,来调节肝细胞的增殖。另一方面,胡敏[11]也进行了有关Keap1-Nrf2在肝再生中调控氧化还原循环和对肝细胞周期影响的研究,该研究将Keap1+/+和Keap1+/-小鼠,以及Nrf2+/+与Nrf2-/-小鼠切除其2/3肝脏,术后在不同时间点对细胞周期蛋白、肝细胞增殖、肝氧化还原状态以及有丝分裂信号分子的功能进行了评价。结果显示,Keap1基因敲除能够延迟增殖的肝细胞进入S期,扰乱有丝分裂的节律性,但对肝细胞整体的再生过程影响不大,而Nrf2基因敲除延缓了小鼠的肝再生过程。
APAP是引起药物性肝损伤的主要原因之一。研究人员通过给小鼠注射APAP 400 mg·kg-1后发现,在12 h内小鼠出现严重的肝毒性,而肝脏功能的恢复却要在24 h之后。注射APAP后,Nrf2的表达量和在细胞核中的积累量都有增加,24 h后,Nrf2下游基因NQO1、GCLM和HO-1的表达也增加。此外,给予APAP注射后,p53及其下游基因p21表达快速增加,48 h后,细胞周期依赖性激酶4 (cyclin dependent kinase 4, CDK4)、细胞周期素D1(Cyclin D1)、肝再生增强因子、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的水平均明显提高,提示启动组织修复与肝细胞增殖。此研究说明,在APAP发生损伤之后,Keap1-Nrf2-ARE通路调控肝再生是一个动态的调节过程[12]。同样,Dayoub等[13]也证实了Nrf2通过诱导肝再生增强因子(augmenter of liver regeneration, ALR),促进肝脏再生。但也有研究报道称,Nrf2延迟了肝细胞的增殖,并诱导肝细胞在肝再生中的凋亡[14]。
此外,还有一些关于Nrf2在肝再生、肝脏疾病和各种外界因素引起的肝损伤中作用的报道。Shin等[15]分析了Nrf2在病毒性、药物性和化学性肝炎或者是一些肝脏疾病,如酒精性脂肪肝、非酒精性脂肪肝、肝纤维化、肝硬化、肝癌中的作用,发现Nrf2的缺失会使小鼠对各种应激的抵抗性降低,而Nrf2的诱导剂可以用于致癌物质的预防,说明Nrf2在肝脏病理生理学中具有举足轻重的作用。Wakabayashi等[16]通过对Keap1-或Nrf2-阻断后小鼠的分析,发现Keap1-Nrf2-ARE信号通路和Notch1信号通路有关,而Notch1是一种细胞增殖调节剂,在调节肝再生方面发挥重要作用。Buitrago-Molina等[17]报道称,在p21缺陷的小鼠中,肝脏的再生和肝癌的发生被削弱,而且肝脏的损伤程度和p21的活性强度决定Nrf2对肝再生的影响。Beyer等[18]分析了Nrf2在细胞氧化还原稳态中的调节作用,在Nrf2缺失的情况下,进行了部分切除手术的肝脏的肝再生被延迟,这表明Nrf2可以激活急性或慢性疾病后肝脏的再生和修复。肝再生过程的分子机制以及Keap1-Nrf2-ARE信号通路对肝再生的调节机制见Fig 2。

|
| Fig 2 Regulation of Keap1-Nrf2-ARE signaling pathway in liver regeneration |
肝脏再生是一个很复杂的细胞增殖的过程,在实际的肝脏再生过程中,多种细胞因子和信号通路参与到肝脏再生的调控中。Keap1-Nrf2-ARE信号通路在肝再生中具有重要的调控作用,参与肝再生的各个环节,因此,研究作用于此信号通路的药物,对肝脏损伤或者手术切除后的肝修复和再生具有重要价值。
目前,相关药物的研究主要集中在天然药物活性成分。如Fan等[12]研究发现,Wuzhi片(由五味子醇提物制得)能够阻止APAP引起的肝损伤,Wuzhi片通过抑制CYP450的活性,抑制APAP的代谢活化,激活Nrf2通路,诱导解毒和抗氧化作用,并通过调节和细胞增殖相关基因p53、p21、cyclin D1、CDK4、PCNA和肝再生增强因子(augmenter of liver regeneration, ALR)的表达,促进APAP引起的肝损伤后的肝再生。Marini′c等[19]利用小鼠1/3肝切除模型,考察了橄榄油中的多酚物质对肝切除术后的抗氧化作用的影响,发现橄榄油多酚在肝再生过程中可以引起氧化还原调节酶、巯基蛋白和Nrf2基因信号的变化,以及对相关mRNA的调控来促进肝再生。Ramirez-Farias等[20]发现,部分肝脏切除手术后,乙醇会使鼠体内的脂质过氧化水平变化,使肝再生受到抑制,但使用维生素E会降低乙醇造成的脂质过氧化水平,有利于肝再生。川芎嗪可促进中年肝部分切除大鼠超氧化物歧化酶(superoxide dismutase, SOD)的表达,减少丙二醛(malondialdehyde, MDA)的产生,从而提高抗氧化能力,降低氧化损伤,促进PCNA的表达[21]。此外,很多天然药物活性成分具有明显的抗氧化作用,如花青素、木犀草素、人参皂苷、甘草素、黄芩素等,这些药物成分都可以通过调控Keap1-Nrf2-ARE信号通路[22],进而在抗氧化损伤方面发挥一定的作用,有可能成为促进肝再生的潜在药物。
除上述天然药物活性成分外,还有少数合成药物也可以通过抗氧化促进肝再生,如双环醇为人工合成的抗病毒性肝炎的新药。姚晓敏[23]研究发现,双环醇可抑制肝脏部分切除大鼠肝脏和微粒体中MDA的含量,还能恢复肝脏SOD活性,阻止肝脏谷胱甘肽(glutathione, GSH)耗竭,通过抗氧化损伤来减轻ROS对肝细胞增殖的抑制作用,从而促进肝细胞增殖。Shimada等[24]研究发现,硫氢化钠可通过直接和间接的抗氧化活性,改善肝脏缺血/再灌注损伤,经硫氢化钠处理后,PCNA阳性细胞的比率明显增高。该研究显示,硫氢化钠能增加Nrf2的核移位,上调HO-1的表达,并通过PDK-1/Akt/mTOR/P70S6K信号通路,抑制细胞凋亡,促进肝细胞的再生。
5 结论及展望肝脏是机体的一个重要的代谢器官,具有潜在再生能力,当受到病理性的损伤或部分切除后,便会启动再生程序。肝脏损伤或被部分切除后,Keap1-Nrf2-ARE信号通路通过影响肝细胞的细胞周期和有丝分裂等方式,促进肝脏的再生。肝再生的状况决定性地影响肝脏组织解剖学上的重建和肝功能的修复,所以对于肝脏被部分切除、肝移植的患者或者严重的肝损伤来说,通过药物干预以促进肝脏的修复和再生就显得尤为重要。由于Keap1-Nrf2-ARE信号通路对肝再生的关键性,那么能够激活此信号通路的药物,就有可能成为促进肝再生的潜在新药,这可以为促肝再生药物机制的研究和以后的新药研发提供思路。通过上述文献综述可以看出,这方面的药物研究多集中于天然产物,但为数不多,说明相关的药物研究有待加强。
| [1] |
Higgins G M, Anderson R M. Experimental pathology of the liver, 1. Restoration of the liver of the white rat following partial surgical removal[J]. Arcthol Pathol, 1931, 12(26): 186-202. |
| [2] |
尤楠, 刘卫辉, 窦科峰. 胎肝干细胞治疗终末期肝病的研究进展[J]. 中华消化外科杂志, 2012, 11(2): 189-92. You N, Liu W H, Dou K F. Research progress of fetal liver stem cells in the treatment of end-stage liver disease[J]. Chin J Dig Surg, 2012, 11(2): 189-92. doi:10.3760/cma.j.issn.1673-9752.2012.02.028 |
| [3] |
Zimmermann A. Liver regeneration: the emergence of new pathways[J]. Med Sei Monil, 2002, 8(3): RA53-63. |
| [4] |
Alvarez-Sola G, Uriarte I, Latasa M U, et al. Engineered fibroblast growth factor 19 protects from acetaminophen-induced liver injury and stimulates aged liver regeneration in mice[J]. Cell Death Dis, 2017, 8(10): e3083. doi:10.1038/cddis.2017.480 |
| [5] |
颜世超, 丁隆, 崔可欣, 等. 肝切除术后肝再生调控机制的研究进展[J]. 现代养生, 2017, 15(6): 241-4. Yan S C, Ding L, Cui K X, et al. Research progress in regulation mechanism of liver regeneration after hepatectomy[J]. Health care Today, 2017, 15(6): 241-4. doi:10.3969/j.issn.1671-0223.2017.06.223 |
| [6] |
Motohashi H, Yamamoto M. Nrf2-Keap1 defines a physiologically important stress response mechanism[J]. Trends Mol Med, 2004, 10(11): 549-57. doi:10.1016/j.molmed.2004.09.003 |
| [7] |
Osburn W O, Kensler T W. Nrf2 signaling: an adaptive response pathway for protection against environmental toxic insults[J]. Mutat Res, 2008, 659(1-2): 31-9. doi:10.1016/j.mrrev.2007.11.006 |
| [8] |
Cullinan S B, Diehl J A. PERK-dependent activation of Nrf2 contributes to redox homeostasis and cell survival following endoplasmic reticulum stress[J]. J Biol Chem, 2004, 279(19): 20108-17. doi:10.1074/jbc.M314219200 |
| [9] |
Mao L, Wang H D, Wang X L, et al. Disruption of Nrf2 exacerbated the damage after spinal cord injury in mice[J]. J Trauma Acute Care Surg, 2012, 72(1): 189-98. |
| [10] |
Zou Y, Hu M, Lee J, et al. Nrf2 is essential for timely M phase entry of replicating hepatocytes during liver regeneration[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(4): G262-8. doi:10.1152/ajpgi.00332.2014 |
| [11] |
胡敏. Keap1/Nrf2信号通路对再生肝细胞周期的调控[D].合肥: 安徽医科大学, 2014. Hu M. The Keap1/Nrf2 signal pathway: regulation of hepatocyte cell cycle during liver regeneration[D]. Hefei: Anhui Medical University, 2014. |
| [12] |
Fan X, Jiang Y, Wang Y, et al. Wuzhi tablet (Schisandra Sphenanthera extract) protects against acetaminophen-induced hepatotoxicity by inhibition of CYP-mediated bioactivation and regulation of NRF2-ARE and p53/p21 pathways[J]. Drug Metab Dispos, 2014, 42(12): 1982-90. doi:10.1124/dmd.114.059535 |
| [13] |
Dayoub R, Vogel A, Schuett J, et al. Nrf2 activates augmenter of liver regeneration (ALR) via antioxidant response element and links oxidative stress to liver regeneration[J]. Mol Med, 2013, 19: 237-44. |
| [14] |
Köhler U A, Kurinna S, Schwitter D, et al. Activated Nrf2 impairs liver regeneration in mice by activation of genes involved in cell-cycle control and apoptosis[J]. Hepatology, 2014, 60(2): 670-8. doi:10.1002/hep.v60.2 |
| [15] |
Shin S M, Yang J H, Ki S H. Role of the Nrf2-ARE pathway in liver diseases[J]. Oxid Med Cell Longev, 2013, 2013: 763257. |
| [16] |
Wakabayashi N, Shin S, Slocum S L, et al. Regulation of notch1 signaling by Nrf2: implications for tissue regeneration[J]. Sci Signal, 2010, 3(130): ra52. |
| [17] |
Buitrago-Molina L E, Marhenke S, Longerich T, et al. The degree of liver injury determines the role of p21 in liver regeneration and hepatocarcinogenesis in mice[J]. Hepatology, 2013, 58(3): 1143-52. doi:10.1002/hep.v58.3 |
| [18] |
Beyer T A, Xu W, Teupser D, et al. Impaired liver regeneration in Nrf2 knockout mice: role of ROS-mediated insulin/IGF-1 resistance[J]. EMBO J, 2008, 27(1): 212-23. doi:10.1038/sj.emboj.7601950 |
| [19] |
Marinić J, Broznić D, Milin Č. Preexposure to olive oil polyphenols extract increases oxidative load and improves liver mass restoration after hepatectomy in mice via stress-sensitive genes[J]. Oxid Med Cell Longev, 2016, 2016: 9191407. |
| [20] |
Ramírez-Farías C, Madrigal-Santillán E, Gutiérrez-Salinas J, et al. Protective effect of some vitamins against the toxic action of ethanol on liver regeneration induced by partial hepatectomy in rats[J]. World J Gastroenterol, 2008, 14(6): 899-907. doi:10.3748/wjg.14.899 |
| [21] |
吴昊.川芎嗪促进大鼠部分肝切除后再生修复机制的初步研究[D].西安: 第四军医大学, 2012. Wu H. Study of the facilitative effect of tetramethylpyrazine on liver repairing regeneration of rats after partially hepatectomy[D]. Xi'an: the Fourth Military Medical University, 2012. |
| [22] |
张靖, 谭亲友. Nrf2-ARE信号通路功能与临床疾病及相关药物的研究新进展[J]. 中国医院药学杂志, 2016, 36(15): 1331-6. Zhang J, Tian Q Y. Study advances in functions of Nrf2-ARE pathway, clinical diseases and related drugs[J]. Chin J Hosp Pharm, 2016, 36(15): 1331-6. |
| [23] |
姚晓敏.双环醇对大鼠肝脏缺血/再灌注损伤和肝脏再生的保护作用及机制研究[D].北京: 中国协和医科大学, 2009. Yao X M. Effects and related mechanisms of bicyclol on liver injury induced by hepatic warm ischemia / reperfusion and on liver regeneration in rats[D]. Beijing: Chinese Academy of Medical Sciences Peking Union Medical College, 2009. |
| [24] |
Shimada S, Fukai M, Wakayama K, et al. Hydrogen sulfide augments survival signals in warm ischemia and reperfusion of the mouse liver[J]. Surg Today, 2015, 45(7): 892-903. doi:10.1007/s00595-014-1064-4 |
