

γ氨基丁酸(γ-aminobutyric acid,GABA)是哺乳动物中枢神经系统中主要的抑制性神经递质,主要通过作用于不同类型的特异性细胞膜受体,发挥生理功能[1]。GABAB受体是代谢型GABA受体,属于具有7次跨膜螺旋结构域的G蛋白偶联受体(G protein-coupled receptors,GPCRs)超家族,其结合配体后,通过激活受体下游特异性异源三聚体G蛋白,实现信号传导。GABAB受体参与调控了多种重要生理和病理过程,是多种疾病的潜在治疗靶标。近年来,GPCRs变构调节剂在高度选择性配体研究领域,以及潜在治疗性试剂开发领域都表现出很好的应用前景。本文就GABAB受体相关变构调节剂的研究进展及其应用情况进行综述。
1 GABAB受体GABAB受体属于C族GPCRs超家族,是由GABAB1亚基和GABAB2亚基组成的一种强制性异源二聚体,其中GABAB1亚基负责配体结合,GABAB2亚基则参与下游G蛋白的偶联。同C族其他GPCRs类似,每个GABAB受体亚基都由3个不同结构域组成(Fig 1):一个被称为捕蝇夹结构域(venus flytrap domain,VFT)的N端细胞外结构域,一个7次螺旋跨膜结构域(heptahelical domain,HD)和一个细胞质内侧尾部结构区域(C-tail domain)。受体细胞外区域始终是以异源二聚体构型存在,其中GABAB1亚基VFT(GB1-VFT)负责配体结合,GABAB2亚基VFT(GB2-VFT)不结合任何配体分子,但其存在可以增强GB1-VFT同配体的亲和力,并提高GABAB受体同G蛋白的偶联效率。GABAB2亚基HD(GB2-HD)主要负责识别和激活下游的特异性异源三聚体Gi/Go蛋白。GABAB受体C末端可以跟多种蛋白相互作用,参与调控多种不同的信号通路和功能[2]。
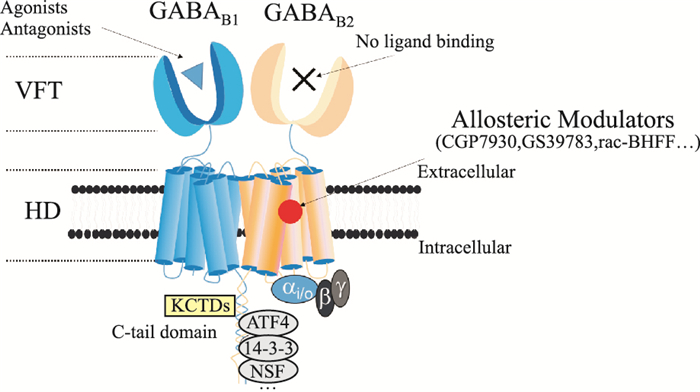
|
| Fig 1 Schematic of GABAB receptor Functional GABAB receptor is an obligatory heterodimer consisting of GABAB1 subunit and GABAB2 subunit. Each subunit contains an extracellular domain called Venus flytrap domain (VFT), a heptahelical domain (HD) and a cytoplasmic C terminal domain (C-tail domain). VFT of GABAB1 subunit (GB1-VFT) binds to the orthosteric ligands and HD of GABAB2 subunit (GB2-HD) is responsible for downstream G protein coupling and interactions with allosteric modulators. The C-tail domain can interact with many proteins, involving in the regulation of various signaling pathways and functions. |
GABAB受体配体分子主要可以分为正位配体和变构调节剂两大类:正位配体结合于GABAB受体GB1-VFT结构域中的正位位点,通过关闭或者打开GB1-VFT,来激活或者抑制GABAB受体相关活性,它们(如激动剂和竞争性拮抗剂等)通常是天然配体GABA的衍生物;变构调节剂的作用位点在拓补结构上不同于正位配体的结合位点,位于GB2-HD结构域中,它们可以诱导GABAB受体的构象和结构发生变化,进而影响正位激动剂的效能和功效,对受体的相关功能起到变构调控作用[3]。
GABAB受体在哺乳动物体内的表达和分布十分广泛,其功能紊乱与许多脑部疾病和行为疾病相关,如焦虑症、抑郁、情绪障碍、癫痫、疼痛、药物成瘾等,是相关疾病治疗的重要靶标[4-5]。目前,针对该受体研发上市的唯一药物是巴氯芬(baclofen),它是GABAB受体的正位激动剂,临床上对肌肉痉挛、酒精依赖、胃食管反流病、癫痫、偏头痛、疼痛等多种疾病表现出功效,但在生理使用过程中,巴氯芬会引起一些诸如镇静、肌肉松弛、体温降低、药物耐受等副作用[6]。随着研究的深入,GABAB受体变构调节剂逐步得到研究者的重视,它们既可以协同改善正位配体引起的GABAB受体相关活性,又表现出更好的受体选择特异性。GABAB受体变构调节剂可以为药物开发和疾病治疗提供新的可能。
2 GABAB受体变构调节剂及其应用GABAB受体的活性可以通过变构调节剂来调节,根据这些变构调节剂化合物对受体活性调控表现出来的不同特性,通常可以把它们分为两大类:正向变构调节剂(positive allosteric modulator,PAM)和负向变构调节剂(negative allosteric modulator,NAM)。PAM可以增加正位配体(如GABA和巴氯芬)激活受体后所引起的相关效应;与之相反,NAM则会降低正位配体诱导产生的效果。
2.1 PAM目前,针对GABAB受体开发得到的特异性变构调节剂主要为PAM化合物,它们在体外功能实验中特异性地增强正位激动剂激活GABAB受体后所产生的相关信号和效应,同时,在多种动物实验模型中表现出相关改善和治疗效果。
2.1.1 ADX71441/ADX71943ADX71441和ADX71943是Addex制药公司推出的新型口服GABAB受体特异性PAM化合物,其中ADX71441表现出良好的大脑渗透性,可以很好地穿过血脑屏障,ADX71943仅显示出外周组织中的相关活性特点。体外药理学活性检测实验表明,它们可以特异性地识别GABAB受体,并增强正位激动剂诱导产生的受体效应,如ADX71943将GABA的LC50浓度效应值提高到1.81倍;在[35S]GTPγS同GABAB受体的结合实验中,ADX71943将巴氯芬在LC50浓度条件下产生的效应值增强了2.6倍多。在啮齿类动物(如小鼠、大鼠、豚鼠)体内实验中,ADX71441/ADX71943对包括酒精依赖、疼痛、焦虑、肌肉痉挛在内的多种疾病症状表现出治疗效果,如ADX71441可以有效减轻实验动物自发反应性酒精自身给药行为,并降低它们后续酒精寻觅行为的复发等;ADX71943对实验过程产生的内脏疼痛、急性疼痛和炎症介导产生的外周组织持续性疼痛表现出较好的镇痛效果[6-9]。从2010年开始,Addex制药公司开始尝试在临床试验中将ADX71943用于骨关节炎疼痛和慢性伤害性疼痛的相关治疗,以开展该药物治疗这类疾病的测试工作。
2.1.2 CGP7930通过药物筛选发现得到的CGP7930及其类似物CGP13501,是针对GABAB受体合成的第一种PAM化合物。体外功能性实验研究表明,CGP7930可以特异性增强正位配体(如GABA)对脑细胞膜组分中的天然GABAB受体,以及外源重组表达系统中GABAB受体所引起的激活效应。如在通过尸体解剖得到的人类额叶皮质制备的细胞膜组分当中,10-4 mol·L-1 CGP7930将GABA激活引起的[35S]GTPγS结合实验的效力增强了4倍,并使相关最大响应值增加了82.5%。在HEK293细胞膜组分中,10-10 mol·L-1和10-9 mol·L-1 CGP7930分别将GABA的EC50浓度数值减少了70%和90%。此外,CGP7930还表现出一定的激动剂效应,单独使用较高浓度的CGP7930可以直接激活HEK293细胞中表达的GABAB受体。在体内动物实验中,CGP7930对实验动物出现的酒精依赖、焦虑、抑郁、镇静/催眠、精神病行为等表现出相关影响,如CGP7930可以抑制酒精成瘾大鼠对酒精的自身给药行为,减少实验大鼠经由氯胺酮诱导的精神病相关行为等[10-12]。
2.1.3 GS39783GS39783于2003年被研究者合成,其具有很好的正向变构调节效应,在相关功能性实验检测中,化合物GS39783有效提高了GABA在[35S]GTPγS结合实验中的效率和功效,如在3×10-5 mol·L-1 GS39783存在时,GABA的EC50浓度数值被降低了近88%,而最大效应值也增加了1.17倍。随后,以GS39783为基础,研究者又进一步优化得到了一系列新型GS39783类似化合物,如毒性较低的NVP-BHF177等。动物实验结果显示,GS39783对实验大鼠的镇静/催眠、焦虑、精神病、药物依赖等都有影响,如GS39783可以减少实验大鼠对尼古丁的自身给药行为等[13-14]。
2.1.4 rac-BHFFrac-BHFF是GABAB受体的又一种典型PAM,其由Roche公司开发。在功能实验中,rac-BHFF既可以增加GABA激活受体后引起的[35S]GTPγS同实验所用细胞膜组分相互结合的效率和功效,又可以增加海马切片中巴氯芬所引起的电生理反应的效力和功效。同CGP7930类似,rac-BHFF自身也表现出一定的内在激动剂效应。啮齿类动物实验结果显示,rac-BHFF在神经性疼痛、惊厥、酒精依赖/药物成瘾、镇静/催眠、焦虑、精神病等多个方面表现出疗效,如rac-BHFF可以增强巴氯芬在神经疼痛小鼠中产生的镇痛作用等[15-18]。
2.1.5 其他PAM化合物CMPPE是GABAB受体的另一种新型PAM,它可以增强GABA激活受体后引起的[35S]GTPγS同实验所用人源重组细胞系和大鼠大脑皮层细胞的细胞膜组分的结合。COR627和COR628是研究者鉴定得到的两种新的噻吩衍生物,它们可以增强GABA和巴氯芬激活受体后引起的[35S]GTPγS同大鼠大脑皮层细胞膜组织的结合。在啮齿动物模型中,它们都可以增强巴氯芬诱导产生的镇静/催眠作用[17, 19]。
2.2 NAM目前为止,针对GABAB受体的特异性PAM化合物研究取得了一系列进展,但可以对GABAB受体相关功能进行特异性负向调控的NAM化合物研究非常有限。最近,本实验室首次成功合成得到GABAB受体的特异性NAM(CLH304a):该化合物由CGP7930衍生而来,它既可以有效抑制正位激动剂(如GABA)的相关效应,又可以特异性抑制CGP7930所引起的下游信号;同时,特异性配体结合实验表明,该化合物结合位点作用区域同样位于GABAB受体GB2-HD结构域中。此外,CLH304a不仅可以抑制由GABAB受体激动剂所引起的受体激活效应,还可以降低GABAB受体的本底活性,显示出反向激动剂的类似性质[20-21]。
3 GABAB受体变构调节剂应用前景和优势目前,针对GABAB受体进行配体开发的研究工作大部分集中于该受体的正位配体(激动剂或拮抗剂),如目前唯一上市销售的特异性激动剂药物巴氯芬。这类配体分子结合在GABAB受体的正位结合位点,这些位点在同种类型的GPCRs不同成员之间具有非常高的保守性,它们结构上的相似性使得GABAB受体正位配体容易出现“交叉反应”,导致出现不必要的药物副作用。此外,激动剂诱导产生的受体失敏等生理学过程也导致此类药物容易出现药效短、耐受性差等问题[22]。同正位配体相比,体外功能实验表明,GABAB受体变构调节剂具有更好的受体选择特异性,还可以表现出不同于激动剂的独立功能[3, 23],并且通过特定药物设计,还可以实现化合物有效通透血脑屏障或仅作用于外周系统的不同分布特性等[9]。动物实验也显示,GABAB受体变构调节剂可以在保持巴氯芬效应的同时,减少不必要的副作用,表现出更好的耐药性[16]。此外,GABAB受体的某些致病基因突变会导致受体出现较高的组成性活性[24],具有反向激动剂效应的NAM化合物CLH304a可以作为降低这类组成性活性的候选化合物之一。
4 小结GABAB受体是多种疾病的潜在治疗靶标,而GABAB受体的变构调节是受体直接激活过程的一种非常好的补充协同方式。同正位结合位点相比,GABAB受体变构调节剂的结合位点序列特征并不保守,针对这些非保守位点进行筛选得到的化合物分子相对于传统方法得到的配体分子具有更好的选择性,同时也为后续筛选更加特异性的变构调节剂分子提供了优化的可能。在多种动物模型中,GABAB受体不同PAMs表现出对不同疾病的改善和治疗效果。此外,这些化合物并没有引起与正位配体类药物(如巴氯芬)类似的头晕、恶心、肌肉无力、精神错乱等副作用,且相对于正位激动剂存在的药物有效作用时间短、实验动物对药物产生快速耐受、有效治疗窗窄等问题,也不容易产生药物耐受性。GABAB受体变构调节剂的这些活性特征使其成为比受体正位激动剂更好的潜在药物候选者。未来需要进一步通过临床试验,对GABAB受体变构调节剂在药物成瘾、慢性疼痛、焦虑、癫痫等疾病治疗中的应用进行检验。同时,对GABAB受体和变构调节剂相互作用精细机制及其功能多样性分子基础的深入研究,可以为设计新型PAM化合物提供帮助,并为临床治疗提供新的途径与思路。
| [1] | 唐映红, 王一奇, 周惠芬, 等. 微透析法研究麻黄汤对大鼠脑海马区氨基酸类神经递质释放的影响[J]. 中国药理学通报, 2017, 33(3): 426-32. Tang Y H, Wang Y Q, Zhou H F, et al. Effects of Mahuang decoction on hippocampal amino acid neural transmitter release in rats evaluated by microdialysis[J]. Chin Pharmacol Bull, 2017, 33(3): 426-32. doi:10.3969/j.issn.1001-1978.2017.03.025 |
| [2] | Geng Y, Bush M, Mosyak L, et al. Structural mechanism of ligand activation in human GABA(B) receptor[J]. Nature, 2013, 504(7479): 254-9. doi:10.1038/nature12725 |
| [3] | Lecat-Guillet N, Monnier C, Rovira X, et al. FRET-based sensors unravel activation and allosteric modulation of the GABAB receptor[J]. Cell Chem Biol, 2017, 24(3): 360-70. doi:10.1016/j.chembiol.2017.02.011 |
| [4] | 苏漫, 朱清, 李俊旭. 镇痛药物作用靶点的研究现状[J]. 中国药理学通报, 2018, 34(2): 161-5. Su M, Zhu Q, Li J X. Research progress on targets for analgesics[J]. Chin Pharmacol Bull, 2018, 34(2): 161-5. doi:10.3969/j.issn.1001-1978.2018.02.004 |
| [5] | 李晓娜, 汪晓筠, 朱艳媚, 等. 盐酸川芎嗪通过干预GABAR和FOXP2的表达保护低压低氧大鼠学习记忆[J]. 中国药理学通报, 2017, 33(9): 1285-90. Li X N, Wang X J, Zhu Y M. Tetramethylpyrazine protects learning memory of hypoxic hypoxia rats through interfering expression of GABA receptor and FOXP2[J]. Chin Pharmacol Bull, 2017, 33(9): 1285-90. doi:10.3969/j.issn.1001-1978.2017.09.019 |
| [6] | Kalinichev M, Girard F, Haddouk H, et al. The drug candidate, ADX71441, is a novel, potent and selective positive allosteric modulator of the GABAB receptor with a potential for treatment of anxiety, pain and spasticity[J]. Neuropharmacology, 2017, 114: 34-47. doi:10.1016/j.neuropharm.2016.11.016 |
| [7] | Kannampalli P, Poli S M, Bolea C, et al. Analgesic effect of ADX71441, a positive allosteric modulator (PAM) of GABAB receptor in a rat model of bladder pain[J]. Neuropharmacology, 2017, 126: 1-11. doi:10.1016/j.neuropharm.2017.08.023 |
| [8] | Augier E, Dulman R S, Damadzic R, et al. The GABAB positive allosteric modulator ADX71441 attenuates alcohol self-administration and relapse to alcohol seeking in rats[J]. Neuropsychopharmacology, 2017, 42(9): 1789-99. doi:10.1038/npp.2017.53 |
| [9] | Kalinichev M, Donovan-Rodriguez T, Girard F, et al. ADX71943 and ADX71441, novel positive allosteric modulators of the GABAB receptor with distinct central/peripheral profiles, show efficacy in the monosodium iodoacetate model of chronic osteoarthritis pain in the rat[J]. Eur J Pharmacol, 2017, 795: 43-9. doi:10.1016/j.ejphar.2016.11.056 |
| [10] | Ma J, Stan L L. Effects of GABA-B receptor positive modulator on ketamine-induced psychosis-relevant behaviors and hippocampal electrical activity in freely moving rats[J]. Psychopharmacology (Berl), 2017, 234(20): 3129-42. doi:10.1007/s00213-017-4705-7 |
| [11] | Maccioni P, Lorrai I, Contini A, et al. Microinjection of baclofen and CGP7930 into the ventral tegmental area suppresses alcohol self-administration in alcohol-preferring rats[J]. Neuropharmacology, 2017 Oct 16. pii: S0028-3908(17)30479-3. doi: 10.1016/j.neuropharm.2017.10.012.[Epub ahead of print]. |
| [12] | Xia S, He C, Zhu Y, et al. GABABR-induced EGFR transactivation promotes migration of human prostate cancer cells[J]. Mol Pharmacol, 2017, 92(3): 265-77. doi:10.1124/mol.116.107854 |
| [13] | Sturchler E, Li X, de Lourdes L M, et al. GABAB receptor allosteric modulators exhibit pathway-dependent and species-selective activity[J]. Pharmacol Res Perspect, 2017, 5(2): e288. |
| [14] | Li X, Risbrough V B, Cates-Gatto C, et al. Comparison of the effects of the GABAB receptor positive modulator BHF177 and the GABAB receptor agonist baclofen on anxiety-like behavior, learning, and memory in mice[J]. Neuropharmacology, 2013, 70: 156-67. doi:10.1016/j.neuropharm.2013.01.018 |
| [15] | Frau R, Bini V, Pillolla G, et al. Positive allosteric modulation of GABAB receptors ameliorates sensorimotor gating in rodent models.[J]. CNS Neurosci Ther, 2014, 20(7): 679-84. doi:10.1111/cns.2014.20.issue-7 |
| [16] | Maccioni P, Vargiolu D, Thomas A W, et al. Inhibition of alcohol self-administration by positive allosteric modulators of the GABAB receptor in rats: lack of tolerance and potentiation of baclofen[J]. Psychopharmacology (Berl), 2015, 232(10): 1831-41. doi:10.1007/s00213-014-3815-8 |
| [17] | Brown J W, Moeller A, Schmidt M, et al. Anticonvulsant effects of structurally diverse GABA(B) positive allosteric modulators in the DBA/2J audiogenic seizure test: comparison to baclofen and utility as a pharmacodynamic screening model[J]. Neuropharmacology, 2016, 101: 358-69. doi:10.1016/j.neuropharm.2015.10.009 |
| [18] | Zemoura K, Ralvenius W T, Malherbe P, et al. The positive allosteric GABAB receptor modulator rac-BHFF enhances baclofen-mediated analgesia in neuropathic mice[J]. Neuropharmacology, 2016, 108: 172-8. doi:10.1016/j.neuropharm.2016.04.028 |
| [19] | Mugnaini C, Pedani V, Casu A, et al. Synthesis and pharmacological characterization of 2-(acylamino)thiophene derivatives as metabolically stable, orally effective, positive allosteric modulators of the GABAB receptor[J]. J Med Chem, 2013, 56(9): 3620-35. doi:10.1021/jm400144w |
| [20] | Chen L H, Sun B, Zhang Y, et al. Discovery of a negative allosteric modulator of GABAB receptors[J]. ACS Med Chem Lett, 2014, 5(7): 742-7. doi:10.1021/ml500162z |
| [21] | Sun B, Chen L, Liu L, et al. A negative allosteric modulator modulates GABAB-receptor signalling through GB2 subunits[J]. Biochem J, 2016, 473(6): 779-87. doi:10.1042/BJ20150979 |
| [22] | Li M, Milligan C J, Wang H, et al. KCTD12 modulation of GABA(B) receptor function[J]. Pharmacol Res Perspect, 2017, 5(4): e319. |
| [23] | Zhang W, Xu C, Tu H, et al. GABAB receptor upregulates fragile X mental retardation protein expression in neurons[J]. Sci Rep, 2015, 5: 10468. doi:10.1038/srep10468 |
| [24] | Vuillaume M L, Jeanne M, Xue L, et al. A novel mutation in the transmembrane 6 domain of GABBR2 leads to a Rett-like phenotype[J]. Ann Neurol, 2018, 83(2): 437-9. doi:10.1002/ana.25155 |

