


心肌纤维化(myocardial fibrosis, MF)主要表现为心脏间质成纤维细胞过度增殖以及细胞外基质(extracellular matrix, ECM)过度沉积,以胶原成分比例失调,且排列紊乱为主要特征的疾病。MF可导致心脏收缩和舒张功能障碍[1]。许多报道显示,心脏纤维化是不同病理情况下心功能不全发生的重要原因[2-4],最终导致心脏衰竭致心脏功能丧失[5]。研究表明,ECM合成或降解失衡是导致MF的重要环节,而基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)和基质金属蛋白酶(matrix metalloproteinases,MMPs)相互作用是调节ECM动态平衡的关键[6]。淫羊藿次苷Ⅱ(icarisid Ⅱ,ICS Ⅱ)是从中药淫羊藿中提取的一种多羟基黄酮类单体,是淫羊藿中的主要成分之一,具有抗炎、抗骨质疏松、抗氧化、改善心肌细胞凋亡等多种生物学和药理学作用[7-8]。本研究旨在观察Ics Ⅱ是否具有抗自发性大鼠MF的作用,以及该效应是否与其影响MMP-2、MMP-9、TIMP-1的表达有关。
1 材料与方法 1.1 实验动物与分组以13周龄的♂自发性高血压大鼠(spontaneously hypertensive rat, SHR)大鼠20只作为研究对象,以同龄♂WKY大鼠5只为阴性对照组,体质量280~320 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001,SPF级。将SHR大鼠随机分为ICS Ⅱ低剂量组(4 mg·kg-1, ICS Ⅱ-L)、中剂量组(8 mg·kg-1, ICS Ⅱ-M)、高剂量组(16 mg·kg-1, ICS Ⅱ-H)和模型组(SHR组)。ICS Ⅱ-L、ICS Ⅱ-M、ICS Ⅱ-H组持续灌胃12周,WKY组、SHR组分别给予等体积双蒸水。ICS Ⅱ溶解于双蒸水中,每次大鼠灌胃给药前,超声10 min,制成混悬液。
1.2 药品、试剂与仪器ICS Ⅱ,纯度≥98%,购于南京泽朗医药有限公司; Masson三色染色试剂盒购于北京索莱宝科技有限公司; GAPDH、MMP-2、MMP-9、TIMP-1引物购自生工生物工程有限公司; 逆转录试剂盒购自TaKaRa生物工程公司; RNA荧光混合物购自美国Bio-Rad公司; MMP-2兔抗大鼠抗体购自生工生物工程有限公司; GAPDH、MMP-9、TIMP-1、Collagen Ⅰ、Collagen Ⅲ兔抗大鼠抗体、山羊抗兔IgG、山羊抗小鼠IgG,均购自武汉三鹰生物技术有限公司; ECL发光剂购于七海生物有限公司。5417R离心机、RNA逆转录仪(德国Eppendorf公司); Mini Trans-Blot转移系统、Mini-PROTEAN3电泳仪、CCD成像系统、real time RT-PCR扩增仪(美国Bio-Rad公司); 光学显微镜及照相系统(日本Olympus公司)。
1.3 大鼠尾部血压的测量采用Kent Scientific CODA鼠尾无创血压计测量清醒、安静状态下大鼠尾部动脉收缩压。
1.4 大鼠左心质量指数的计算给药至26周后,2%戊巴比妥(2 mg·kg-1)腹腔注射麻醉,取出各组大鼠心脏组织,分离左心室,计算左心质量指数。左心质量指数=左心重量(g) /大鼠体重(g)×100。
1.5 大鼠心脏组织病理学检查取大鼠左心室组织,浸入4%中性甲醛溶液中固定48 h后,石蜡包埋、切片,Masson染色,光学显微镜下观察心肌胶原含量变化。
1.6 Real time PCR法检测左心室组织中MMP-2、MMP-9、TIMP-1 mRNA的表达水平参照Gen-Bank基因库中关于大鼠MMP-2、MMP-9、TIMP-1 mRNA序列设计引物,引物序列见Tab 1。取各组心脏组织100 mg,置于1 mL TRIzol中提取总RNA并纯化。目的基因表达用相对定量法,以PCR扩增过程中荧光信号强度达到阈值所需要的循环数(cycle threshold,Ct值)为统计参数,Ct值的平均值=(Ctl+Ct2)/2(重复管); dCt=Ct值的平均值-中间值(相同检测基因的不同样品Ct值的平均值中居中的值); 基因的转录水平=2-dCt; 相对定量=目的基因的表达/内参基因的表达×100,将WKY组的mRNA表达设为100。
| Gene | GenBank accession No. | Forward primer (5′→3′) | Reverse primer (5′→3′) |
| MMP-2 | NM_031054.2 | AGCTCCCGGAAAAGATTGAT | TCCAGTTAAAGGCAGCGTCT |
| MMP-9 | NM_031055.1 | CCACCGAGCTATCCACTCAT | GTCCGGTTTCAGCATGTTT |
| TIMP-1 | NM_053819.1 | TCCCCAGAAATCATCGAGAC | TCAGATTATGCCAGGGAACC |
| GAPDH | NM_017008. 4 | AGACAGCCGCATCTTCTTGT | CTTGCCGTGGGTAGAGTCAT |
取大鼠心脏组织约200 mg,剪碎后,放入1 mL RIPA裂解液中,加入蛋白磷酸酶抑制剂10 μL及PMSF 10 μL,混匀,冰上匀浆后静置,离心,取上清液,BCA法测定待测样品的总蛋白浓度。SDS-聚丙烯酰胺凝胶电泳后,转至PVDF膜,TBST洗膜,5%蛋白封闭液室温封闭2 h后,TBST洗膜。一抗GAPDH (1 :5 000)、MMP-2 (1 :500)、MMP-9 (1 :500)、TIMP-1 (1 :500)、Collagen Ⅰ (1 :1 000)、Collagen Ⅲ (1 :1 000) 4℃摇床孵育过夜; TBST洗膜,HRP标记山羊抗兔IgG (1 :5 000)、山羊抗小鼠IgG (1 :5 000)常温摇床孵育1 h,洗膜后用ECL化学发光剂显色,采用CCD成像系统获取图像。
1.8 统计学分析实验数据采用SPSS 18.0软件进行处理,组间差异比较采用One-Way ANOVA分析,方差齐用LSD法,方差不齐用Dunnett’s T3法,所有数据采用x±s表示。
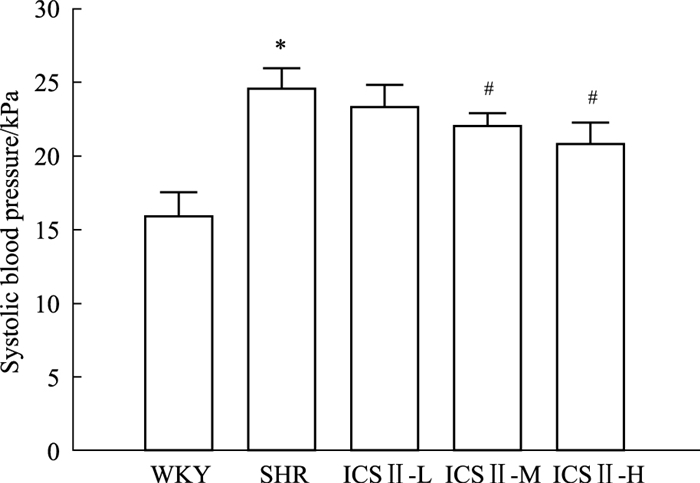
2 结果 2.1 ICS Ⅱ对SHR大鼠收缩压的影响与WKY组相比,26周龄SHR组大鼠收缩压明显上升(P < 0.05),是WKY组的1.54倍; 与SHR组相比,给予ICS Ⅱ-M、ICS Ⅱ-H后收缩压分别下降了10.32%、15.30%(P < 0.05),见Fig 1。
|
| Fig 1 Effect of ICS Ⅱ on systolic blood pressure in SHRs(x±s, n=4) *P < 0.05 vs WKY; #P < 0.05 vs SHR |
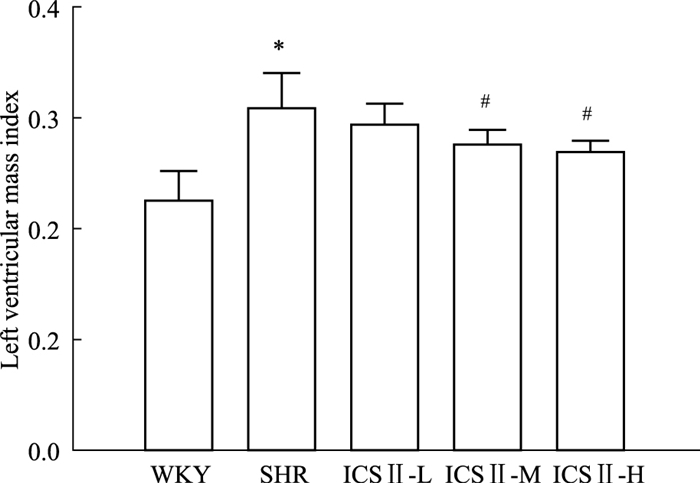
如Fig 2所示,与WKY组相比,SHR组大鼠左心质量指数明显增加(P < 0.05);给予ICS Ⅱ-M、ICS Ⅱ-H可降低左心质量指数,且差异有统计学意义(P < 0.05)。
|
| Fig 2 Effects of ICS Ⅱ on left ventricular index in SHRs(x±s, n=4) *P < 0.05 vs WKY; #P < 0.05 vs SHR |
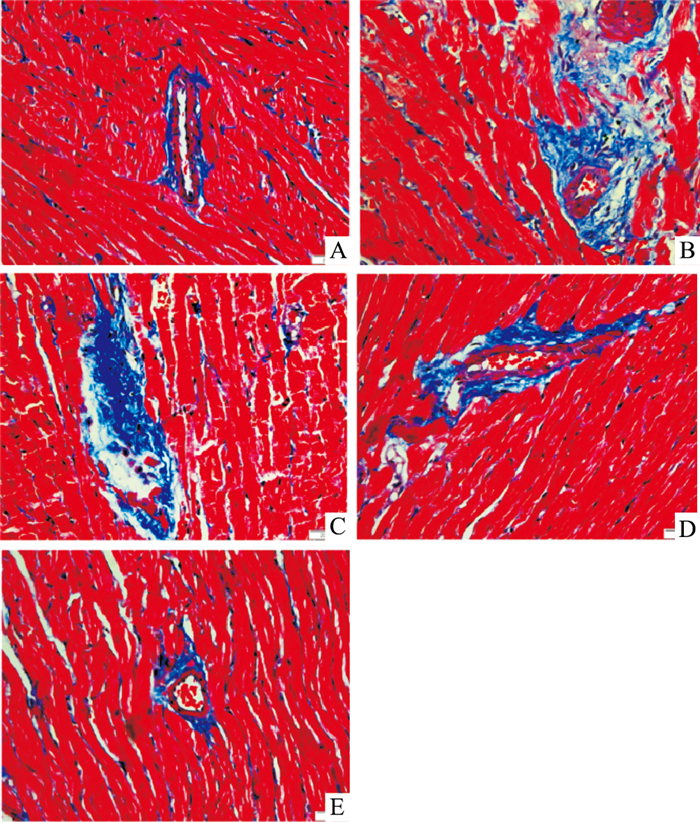
Fig 3的Mas-son染色结果显示,胶原纤维呈蓝色,心肌细胞呈红色。WKY组心肌肌束间有较少胶原沉积。与WKY组相比,SHR组心肌肌束间隙不同程度增大,心肌细胞间质可见明显纤维化改变,伴有严重的胶原沉积。与SHR组相比,ICS Ⅱ-M、ICS Ⅱ-H组心肌细胞纤维化程度明显减轻。说明ICS Ⅱ对SHR心肌纤维化及其胶原沉积有一定的改善作用。
|
| Fig 3 Left ventricular collagen deposition in SHRs(×400) A: WKY; B: SHR; C: ICS Ⅱ-L; D: ICS Ⅱ-M; E: ICS Ⅱ-H. |
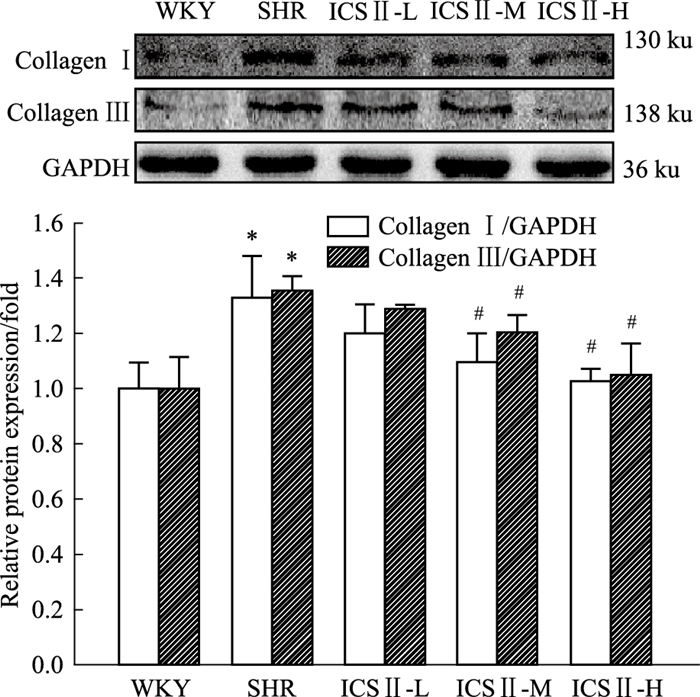
Fig 4的Western blot检测结果发现,与WKY组相比,SHR组大鼠左心室中Collagen Ⅰ、Collagen Ⅲ蛋白表达水平明显升高(P<0.05);与SHR组相比,ICS Ⅱ-M、ICS Ⅱ-H组SHR大鼠左心室中Collagen Ⅰ、Collagen Ⅲ蛋白表达水平明显下降(P<0.05)。
|
| Fig 4 Effect of ICS Ⅱ administration on protein expression of Collagen Ⅰ, Collagen Ⅲ in left ventricle of SHRs(x±s, n=4) *P < 0.05 vs WKY; #P < 0.05 vs SHR |
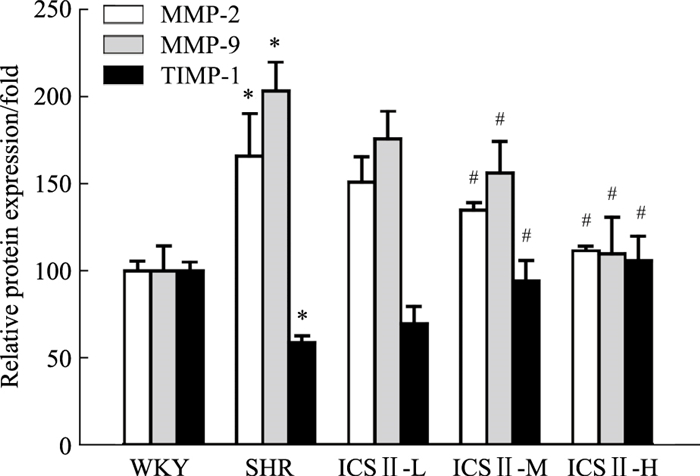
如Fig 5所示,与WKY组比较,模型组SHR大鼠左心室MMP-2、MMP-9 mRNA的表达水平均明显增加(P<0.05),TIMP-1 mRNA的表达水平明显下降(P<0.05);与SHR组比较,ICS Ⅱ-M、ICS Ⅱ-H组SHR大鼠左心室MMP-2、MMP-9 mRNA的表达明显下降,TIMP-1 mRNA的表达明显增加(P<0.05)。
|
| Fig 5 Effects of ICS Ⅱ on mRNA expression of MMP-2, MMP-9, TIMP-1 in left ventricle of SHRs(x±s, n=4) *P < 0.05 vs WKY; #P < 0.05 vs SHR |
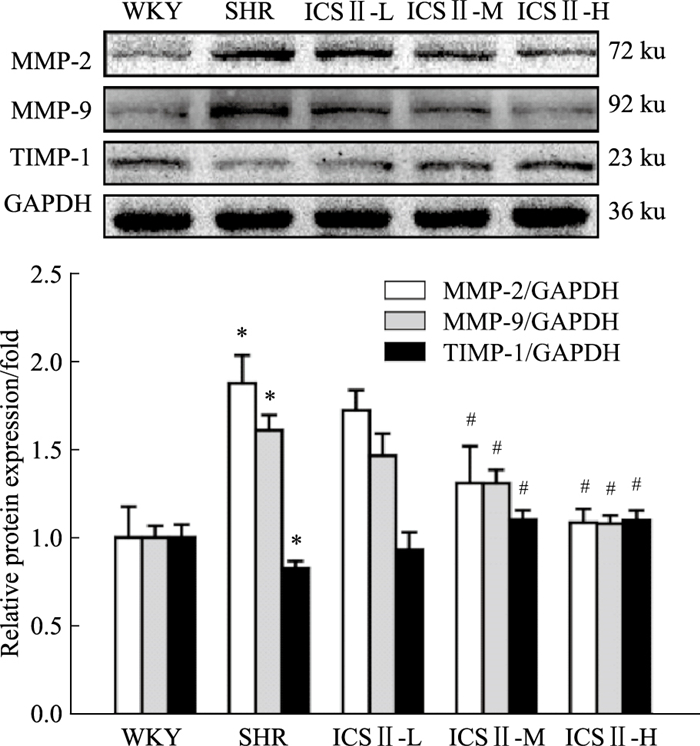
Fig 6的Western blot检测结果发现,与WKY组相比,SHR组大鼠左心室中MMP-2、MMP-9蛋白表达水平明显升高(P<0.05),TIMP-1的蛋白表达水平明显下降(P<0.05);与SHR组相比,ICS Ⅱ-M、ICS Ⅱ-H组SHR大鼠左心室中MMP-2、MMP-9蛋白表达水平明显下降,TIMP-1的蛋白表达水平明显升高(P<0.05)。
|
| Fig 6 Effect of ICS Ⅱ administration on protein expression of MMP-2, MMP-9, TIMP-1 in left ventricle of SHRs(x±s, n=4) *P < 0.05 vs WKY; #P < 0.05 vs SHR |
SHR大鼠是一种与人类慢性高血压接近的动物模型。有研究发现,SHR大鼠在20周龄时心肌纤维增多,心肌间质内可见大量胶原聚集,心肌胶原面积的比例明显增高[9]。本研究中,14周龄♂SHR大鼠喂养至26周龄,SHR组收缩压、左心质量指数明显升高,病理学Masson染色结果显示,SHR组心肌肌束间隙不同程度增大,心肌细胞间质和血管周围可见明显纤维化改变,并伴有严重的胶原沉积,表明26周龄的SHR已发生明显的MF,这与本课题组前期研究一致[10]。给予ICS Ⅱ-M、ICS Ⅱ-H后,SHR组收缩压、左心质量指数下降,MF程度明显改善。
Ⅰ型和Ⅲ型胶原纤维蛋白是心脏ECM的主要成分[11],MMPs是降解ECM成分的主要酶系,在心血管系统的重构过程中,通过影响ECM的降解,在高血压血管病变的发生、发展中起重要作用[12]。MMPs跟据作用底物的不同分为5大类,而明胶酶MMP-2和MMP-9与心血管疾病密切相关[13-14]。在心肌组织中,MMP-2和MMP-9已经被证明是ECM的主要调节因子,它们对变性的纤维胶原蛋白具有底物亲和力[15]。研究表明,心肌梗死后,MMPs特别是MMP-2上调,引起MMPs和TIMPs在心脏组织中的比例失衡,导致心脏ECM的降解,心肌组织厚度减小(心室壁变薄),最终导致心功能的恶化[15-16]。本研究结果显示,与WKY组相比,SHR组大鼠左心室MMP-9、MMP-2、Collagen Ⅰ、Collagen Ⅲ表达明显增加,TIMP-1的表达明显降低,MMP-9/TIMP-1比值增大,导致MMPs/TIMPs失衡,促进MF的发展; 与SHR组相比,ICS Ⅱ-M、ICS Ⅱ-H组SHR大鼠左心室中MMP-9、MMP-2、Collagen Ⅰ、Collagen Ⅲ表达明显下调,TIMP-1的表达明显上调,MMP-9/TIMP-1比值降低。表明给予ICS Ⅱ干预后,SHR心肌MMPs/TIMPs的失调得到明显改善,提示ICS Ⅱ可能通过抑制MMP-9、MMP-2的表达,促进TIMP-1表达,改善MMPs/TIMPs的失调,调控胶原的合成与降解,减轻SHR大鼠的MF。
综上,ICS Ⅱ具有抗SHR大鼠MF的作用,其机制可能与降低血压,上调MMP-9、MMP-2,下调TIMP-1的表达,改善MMPs/TIMPs的失调有关。
| [1] | Kong P, Christia P, Frangogiannis N G. The pathogenesis of cardiac fibrosis[J]. Cell Mol Life Sci, 2014, 71(4): 549-74. doi:10.1007/s00018-013-1349-6 |
| [2] | Koitabashi N, Arai M, Kogure S, et al. Increased connective tissue growth factor relative to brain natriuretic peptide as a determinant of myocardial fibrosis[J]. Hypertension, 2007, 49(5): 1120-7. doi:10.1161/HYPERTENSIONAHA.106.077537 |
| [3] | Matsui Y, Sadoshima J. Rapid upregulation of CTGF in cardiac myocytes by hypertrophic stimuli: implication for cardiac fibrosis and hypertrophy[J]. J Mol Cell Cardiol, 2004, 37(2): 477-81. doi:10.1016/j.yjmcc.2004.05.012 |
| [4] | Ohnishi H, Oka T, Kusachi S, et al. Increased expression of connective tissue growth factor in the infarct zone of experimentally induced myocardial infarction in rats[J]. J Mol Cell Cardiol, 1998, 30(11): 2411-22. doi:10.1006/jmcc.1998.0799 |
| [5] | Angelini A, Li Z, Mericskay M, et al. Regulation of connective tissue growth factor and cardiac fibrosis by an SRF/microRNA-133a axis[J]. PLoS One, 2015, 10(10): e0139858. doi:10.1371/journal.pone.0139858 |
| [6] | Ryan T D, Rothstein E C, Aban I, et al. Left ventricular eccentric remodeling and matrix loss are mediated by bradykinin and precede cardiomyocyte elongation in rats with volume overload[J]. J Am Coll Cardiol, 2007, 49(7): 811-21. doi:10.1016/j.jacc.2006.06.083 |
| [7] | Khan M, Maryam A, Qazi J I, et al. Targeting apoptosis and multiple signaling pathways with icariside Ⅱ in cancer cells[J]. Int J Biol Sci, 2015, 11(9): 1100-12. doi:10.7150/ijbs.11595 |
| [8] | 吴雨婷, 付舒, 岳云, 等. 淫羊藿次苷Ⅱ改善自发性高血压大鼠左心室心肌细胞凋亡[J]. 中国药理学通报, 2017, 33(12): 1744-9. Wu Y T, Fu S, Yue Y, et al. IcarisideⅡimproves left ventricular cardiomyocyte apoptosis in spontaneously hypertensive rats[J]. Chin Pharmacol Bull, 2017, 33(12): 1744-9. doi:10.3969/j.issn.1001-1978.2017.12.023 |
| [9] | Shao S, Cai W, Sheng J, et al. Role of SDF-1 and Wnt signaling pathway in the myocardial fibrosis of hypertensive rats[J]. Am J Transl Res, 2015, 7(8): 1345-56. |
| [10] | 王颖婉, 李叶丽, 王俊逸, 等. PPARα、PPARγ的上调参与淫羊藿苷对自发性高血压大鼠心室重构的调节[J]. 中国药理学通报, 2015, 31(8): 1117-20. Wang Y W, Li Y L, Wang J Y, et al. Upregulation of PPARα and PPARγ in the regulation of ventricular remodeling in spontaneously hypertensive rats[J]. Chin Pharmacol Bull, 2015, 31(8): 1117-20. doi:10.3969/j.issn.1001-1978.2015.08.018 |
| [11] | Fan D, Takawale A, Lee J, et al. Cardiac fibroblasts, fibrosis and extracellular matrix remodeling in heart disease[J]. Fibrogenesis Tissue Repair, 2012, 5(1): 15. doi:10.1186/1755-1536-5-15 |
| [12] | Castro M M, Tanus-Santos J E, Gerlach R F. Matrix metalloproteinases: targets for doxycycline to prevent the vascular alterations of hypertension[J]. Pharmacol Res, 2011, 64(6): 567-72. doi:10.1016/j.phrs.2011.04.002 |
| [13] | Hu J, Steen P E V D, Sang Q X A, et al. Matrix metalloproteinase inhibitors as therapy for inflammatory and vascular diseases[J]. Nat Rev Drug Discov, 2007, 6(6): 480-98. doi:10.1038/nrd2308 |
| [14] | Polyakova V, Loeffler I, Hein S, et al. Fibrosis in endstage human heart failure: severe changes in collagen metabolism and MMP/TIMP profiles[J]. Int J Cardiol, 2011, 151(1): 18-33. doi:10.1016/j.ijcard.2010.04.053 |
| [15] | Spinale F G. Myocardial matrix remodeling and the matrix metalloproteinases: influence on cardiac form and function[J]. Physiol Rev, 2007, 87(4): 1285-342. doi:10.1152/physrev.00012.2007 |
| [16] | Decoux A, Lindsey M L, Villarreal F, et al. Myocardial matrix metalloproteinase-2: inside out and upside down[J]. J Mol Cell Cardiol, 2014, 77: 64-72. doi:10.1016/j.yjmcc.2014.09.016 |

