

由于血脑屏障(blood brain barrier, BBB)的存在,过去一直认为大脑是免疫豁免区域,不存在免疫细胞[1]。后来的研究证实,在感染、自身免疫性神经系统疾病、中枢神经系统(central nervous system, CNS)退行性疾病等疾病中,BBB通透性会发生改变,不能限制具有免疫效应的淋巴细胞通过,且淋巴细胞介导的免疫反应是CNS炎症和病变的主要原因[2-3]。因此,对浸润到CNS中的淋巴细胞表型和功能的全面分析对于阐明这些疾病的发病机制和新药开发具有重要意义。目前,国内研究中分析这群细胞的方法主要是通过免疫组织化学染色或荧光染色的方法,观察其分布和数量[4],但由于受到染色方法和检测手段的限制,这种方法不能同时分析淋巴细胞的多个指标,具有很大的局限性。
流式细胞术(flow cytometry,FCM)是一种先进的细胞定量分析技术,它可以高速分析上万个细胞,并能同时从1个细胞中测得多个参数,与传统的荧光显微镜检查相比,具有参数多、速度快、精度高、准确性好等优点。因此,利用FCM分析CNS中的淋巴细胞无疑是当前较全面、高效的方法。近两年,在国内的研究中,这种方法开始被研究者采用,但在处理组织样本的过程中,多数采用简单的机械研磨或酶消化的方法来获得单个细胞[5-6],而由于CNS中细胞种类繁多,且淋巴细胞所占比例又较低,使得这两种方法获得的细胞纯度、活性和产量均较低,不利于进行流式细胞分析。因此,本研究在参照国外相关文献的基础上[7-8],利用正常C57BL/6小鼠、实验性变态反应性脑脊髓炎(experimental allergic encephala-omyelitis,EAE)和阿尔茨海默病(Alzheimer’s disease, AD)模型小鼠,通过Percoll密度梯度离心法提取了小鼠脑组织和脊髓中单个核细胞,并利用FCM进行了细胞表型的分析。旨在总结和建立一种方便、高效的从脑组织和脊髓组织中获取单个核细胞的方法,为CNS中单个核细胞(包括神经元、神经胶质细胞、浸润的淋巴细胞等)功能的研究提供重要分析手段。
1 材料与方法 1.1 AD模型小鼠APP/PS1小鼠,C57BL/6J-TgN(APP/PS1)品系,合格证号:SCXK(京)2014-0011,♂,22~24周,体质量(30±2)g,10只,购于至善(北京)健康医学研究院有限公司,饲养于山东省科学院分析测试中心动物房。动物饲养完全遵照山东省分析测试中心实验动物管理委员会条例。动物房湿度为50%~55%,温度为(23±2)℃,12 h明暗交替采光,饲喂无菌普通鼠粮,自由饮水。本研究动物实验通过山东省分析测试中心医学伦理委员会审查和监督。
1.2 MOG 35~55诱导C57BL/6小鼠EAE模型 1.2.1 实验动物8~10周龄♀C57BL/6小鼠,合格证号:SCXK(京)2012-0001,体质量(20±2)g,10只,购于北京维通利华实验动物技术有限公司。利用MOG 35~55多肽(Mimotopes Peptides公司)、弗氏完全佐剂(complete Freund’s adjuvant, CFA)(Chondrex公司,Cat#7001)和百日咳毒素(pertussis toxin,PT)(List Biological Laboratories公司,Cat #180)诱导EAE模型。
1.2.2 C57BL/6小鼠EAE模型的建立EAE模型的建立参照已报道的方法[9]。简述如下:MOG 35~55多肽用PBS稀释后,与CFA按等体积混合,多次涡旋成油包水的乳剂,于小鼠两侧腹股沟上方皮下分别注射0.1 mL MOG 35~55乳剂,包含100 μL MOG 35~55(200 μg)+100 μL CFA(含0.4 mg结核分枝杆菌株H37RA),在免疫的当天和48 h后,每只小鼠腹腔注射200 ng的PT。正常组注射等体积的PBS。
1.2.3 C57BL/6小鼠EAE病情评分临床神经功能评分及发病率的计算方法为:采用盲法,每天在同一时间按Benson评分标准,对EAE严重性进行临床评估。Benson评分标准,0分:无任何临床症状;1分:尾部张力消失,可见轻度步态笨拙;2分:双后肢无力,被动翻身后可以恢复;3分:双后肢瘫痪,被动翻身后不能恢复,但给予刺激后可以挪动;4分:双后肢瘫痪,前肢瘫痪或肌力减弱伴尿便失禁;5分:濒死状态或死亡。症状介于两者标准之间者以±0.5计。
1.2.4 病理检查取免疫后18 d的小鼠,用1%戊巴比妥钠腹腔注射麻醉小鼠,快速打开胸腔,左心室主动脉插管,先后以预冷生理盐水和4%多聚甲醛溶液冲洗血液,并进行心脏灌流,取出脊髓的腰骶段,置于4%多聚甲醛固定液中。常规脱水、透明、浸蜡、包埋、切片后,进行烤片和脱蜡、水化、苏木精、伊红染色,二甲苯透明后,中性树胶封片。
1.3 Percoll密度梯度离心法分离小鼠脑组织中单核细胞 1.3.1 试剂与仪器Percoll分离液(GE Healthcare公司,Cat #17-0891-09);RPMI 1640培养基(Gibco公司,Cat #21875091);1×HBSS(Solarbio公司,Cat #H1025,不含Ca2+和Mg2+);10×PBS(无Ca2+和Mg2+,0.5 mmol·L-1 EDTA);0.4%台盼蓝染液(Sigma公司, Cat #T6146,溶解在PBS液中);70 μm细胞过滤网(Biologix公司,Cat #15-1070)。X1R高性能通用台式离心机(Thermo Scientific公司);FIM-100G制冰机(Focusun公司);FACS Aria Ⅱ流式细胞仪(美国BD公司)。
1.3.2 Percoll分离液的配制(1) 先将未稀释的Percoll分离液原液与10×PBS按9 :1配制为实验用100% Percoll分离液,之后实验中Percoll分离液均以此为母液配制,1只小鼠需准备5.5 mL。(2)70% Percoll分离液的配制:用100% Percoll分离液与1×HBSS或RPMI 1640培养基按7 :3的比例配制,1只小鼠需要3 mL。
1.3.3 获取脑组织中单个核细胞(1) 用1%戊巴比妥钠将小鼠麻醉后,用预冷1×HBSS进行心脏灌注至肝脏颜色变白,取出脑组织和脊髓,立即放入冷的RPMI 1640培养基中,清洗去表面杂质。(2)将70 μm孔径细胞筛网放入6孔细胞培养板中(置于冰盒中),用1 mL注射器针芯将筛网中的组织研磨至无组织块(研磨工具如Fig 1A所示),研磨中不断加入RPMI 1640培养基稀释匀浆。(3)最后将研磨后的匀浆液全部转移到15 mL离心管中,2 000 r·min-1、4℃离心10 min。(4)弃上清,用7 mL RPMI 1640培养基(室温)重悬细胞后,加入3 mL 100% Percoll分离液(室温),混匀,即为30% Percoll分离液。(5)取1支新的15 mL离心管,加入3 mL 70% Percoll分离液(室温),用吸管将(4)中的30% Percoll分离液缓缓加入到70% Percoll分离液上面,2 000 r·min-1,加速度设置为3,减速度设置为2,22℃离心30 min。(6)离心后,可在30%和70% Percoll分离液之间看见白色细胞层(Fig 1B),即为单个核细胞。用吸管小心将白色细胞层(约2~3 mL)取出至新的离心管中,加入10 mL 1×HBSS(含2%胎牛血清),2 000 r·min-1、4℃离心10 min,清洗细胞3次。(7)用台盼蓝拒染法测定细胞存活率。末次离心后,弃上清,加入含有10%胎牛血清的RPMI 1640,重悬细胞。取1滴细胞悬液与1滴0.4%台盼蓝染液混合,于血球计数板上计数4个大方格内的细胞总数,进一步计算分离的细胞总数。(8)细胞存活率检测:死的细胞可被染成蓝色,活细胞不着色。计数200个细胞,计算出活细胞百分率。
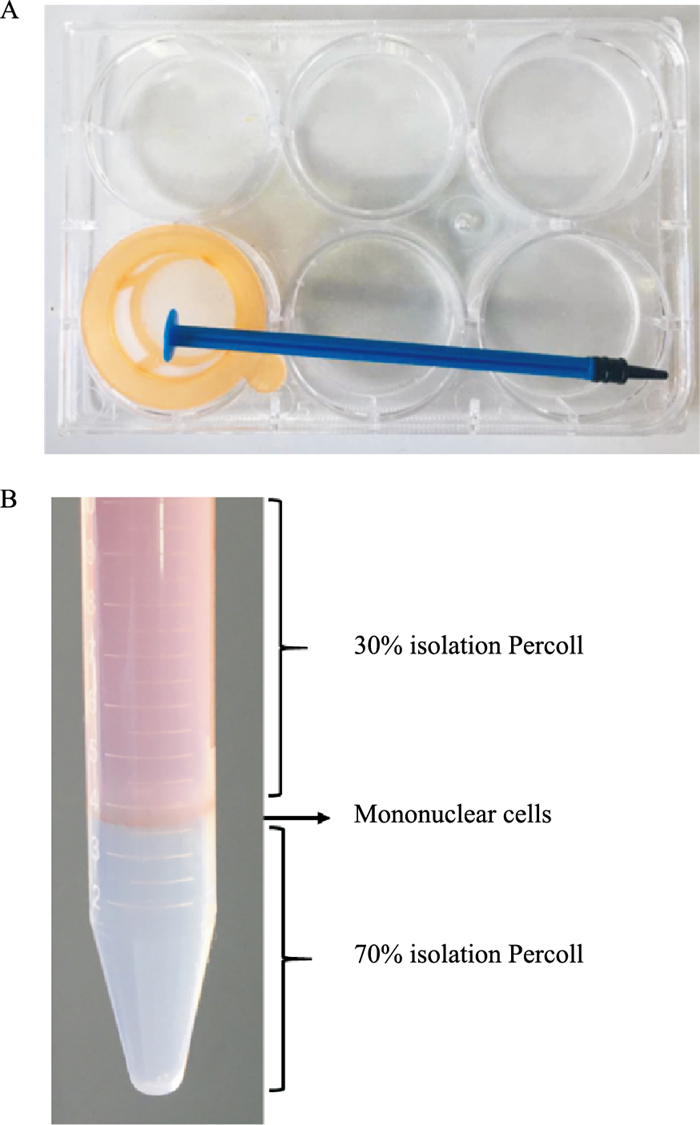
|
| Fig 1 Display of important steps for isolation process A: The tool for grinding the tissue, including cell culture 6-well plate, 70 μm cell strainer and tube core of 1 mL injector; B: Brain and spinal cord cell suspensions were separated over discontinuous 70%~30% percoll gradients. After spinning the gradients, the 70%~30% interphase should have a defined white halo. |
用FACS缓冲液(含有1% FCS、5 mmol·L-1 EDTA、0.1% NaN3的PBS溶液)配制表面抗体染色液,包括抗CD45-APCCy7、抗CD44-FITC、抗CD25-BV650、抗CD4-PECy7和抗CD8-BV605等抗体。将细胞重悬于染色液中,孵育染色30 min。加入FACS buffer清洗细胞后,用破膜液(BD Pharmingen固定/破膜试剂盒)处理细胞20 min,再用抗IL-17-BV786、抗IFNγ-PECF594和抗Foxp3-AF647等抗体,对细胞进行胞内染色30 min。FACS buffer清洗细胞后,利用流式细胞仪分析,用FlowJo v10软件对数据进行进一步分析。
1.5 统计学分析数据统计学分析利用SPSS 19.0软件,结果以x±s表示。独立实验组间均值差异进行独立样本双侧T-检验。
2 结果 2.1 C57BL/6小鼠构建EAE模型的鉴定 2.1.1 EAE病情变化与正常组小鼠相比,EAE组小鼠免疫后出现精神萎靡、食欲减退、皮毛不光滑、体重下降(Fig 2A、2B)。EAE组大部分以尾部张力下降为首发症状,继而出现尾部麻痹、后肢无力、后肢瘫痪等症状。EAE组全部发病,发病率达100%,平均发病时间为(11.00±1.58)d,d 20左右发病达高峰,此期间评分为(2.35±0.18)分,症状最严重,小鼠出现双后肢瘫痪伴前肢瘫痪(Fig 2C)。因此,神经功能评分结果表明EAE模型构建成功。
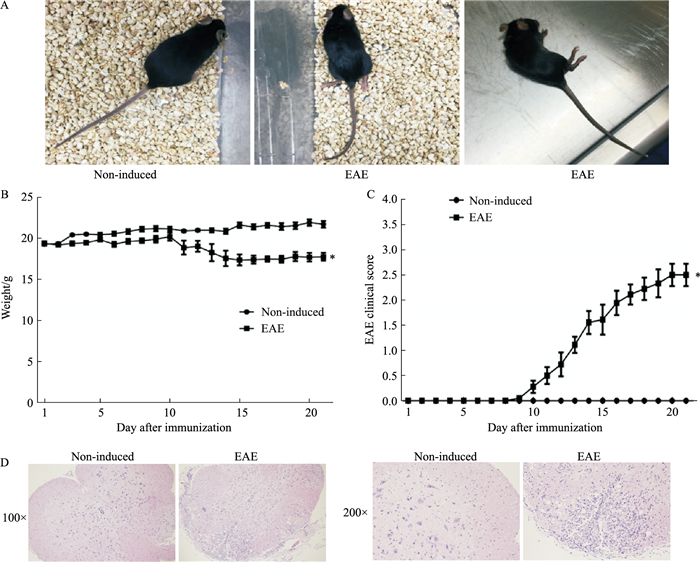
|
| Fig 2 Establishment of EAE mouse model A:Morphological comparison between non-induced and EAE mice; B: Body weight was recorded daily during the course of EAE (n=10); C: Clinical scores were recorded daily after EAE induction (n=10); D: HE spinal cord histopathology collected 18 d after immunization. *P < 0.05 vs non-induced group. |
取EAE发病高峰期小鼠的脊髓制作石蜡切片,进行HE染色。在光镜下可见,发病的EAE小鼠的白质内神经膜排列不规则,局部硬膜下白质发生液化性坏死,坏死处结构疏松,出现大片空泡区,该区可见大量淋巴细胞浸润(Fig 2D)。正常组小鼠神经组织病理检查未见明显的病理改变。
2.2 FCM分析分离的单个核细胞 2.2.1 获取细胞数目和存活率分析密度梯度离心后,在70%和30% Percoll分离液的界面处可以见到白色的细胞层,即分离的单个核细胞。整个分离过程需要1.5 h左右,1只正常C57BL/6小鼠的脊髓和脑组织共可以获得3×105~5×105个细胞,而疾病模型小鼠获得细胞的数目决定于其CNS被炎性细胞浸润的程度。利用台盼蓝染色分析细胞存活率在90%以上。
2.2.2 FCM分析将获取的单个核细胞进行抗体孵育染色后,进行FCM分析。如Fig 3A所示,根据细胞大小,我们首先将淋巴细胞群圈出,而后根据CD45的表达水平,圈出3个不同的细胞群(Fig 3B),包括CD45阴性(CD45neg)、CD45低表达(CD45lo)和CD45高表达(CD45hi)细胞群。CD45neg细胞群主要由神经元、星形胶质细胞、其它的神经胶质细胞等组成,CD45lo细胞群主要包括小胶质细胞,CD45hi细胞群主要包括浸润的淋巴细胞。通过统计学分析可以看出(Fig 4),在有神经炎症反应的EAE和AD模型小鼠中,淋巴细胞群和CD45hi细胞群的比例要明显高于正常C57BL/6小鼠(P < 0.01)。
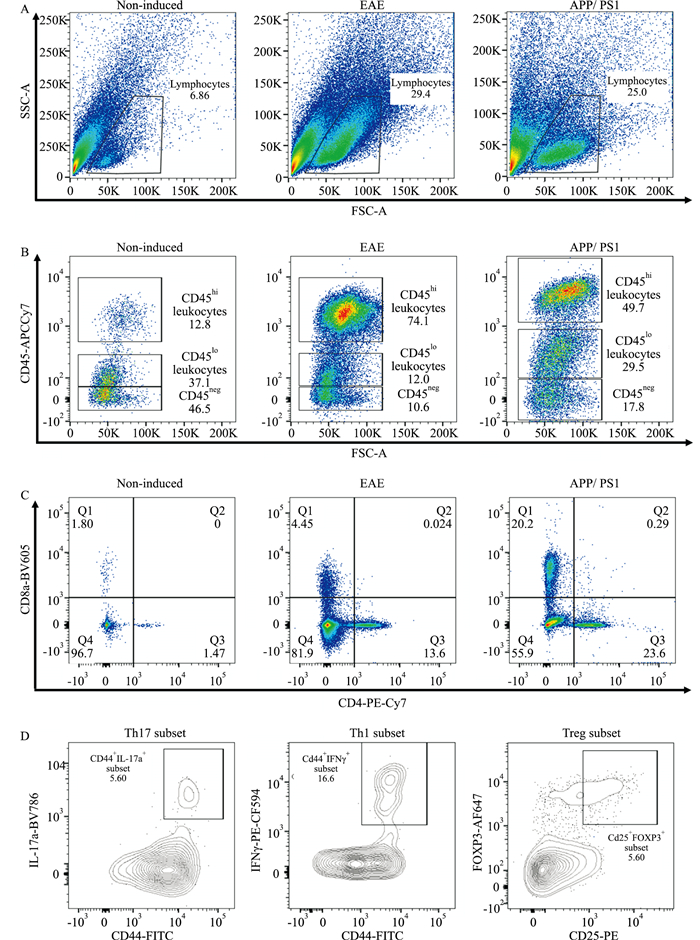
|
| Fig 3 Flow cytometric analysis of mononuclear cells, from brain and spinal cord of non-induced, EAE (at peak disease) and APP/PS1 mice A: The total lymphocyte population was gated from the raw data to exclude any debris typically lying along the Y axis. It was imperative to only select the true leukocyte population in order to obtain clean plots; B: CD45 intensity was measured in the Y-axis, where three distinct populations were visualized, including CD45hi leukocytes, CD45lo leukocytes and CD45neg cells; C: CD4+CD8- and CD4-CD8+ T cells were analyzed by gating on the CD45hi population; D: After intracellular cytokine staining, Th17 (CD44+IL17a+ cell), Th1 (CD44+IFNγ+cell) and Treg (CD25+FoxP3+ cell) cells could be identified by flow cytometry. |
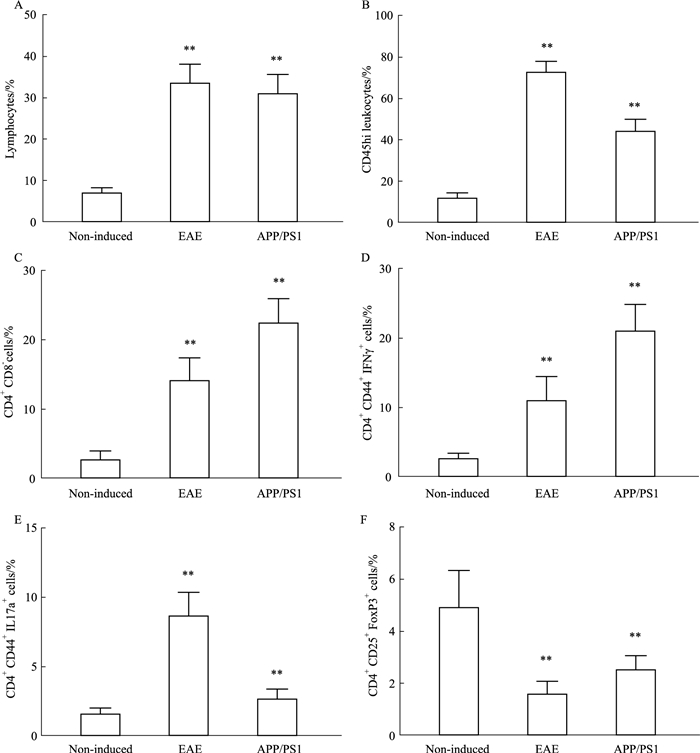
|
| Fig 4 Percentage numbers of lymphocytes (A), CD45hi leukocytes (B), CD4+CD8- cells (C), Th1 (CD4+CD44+IFNγ+)cells(D), Th17(CD4+CD44+IL17a+) cells (E) and Treg (CD4+CD25+FoxP3+) cells (F) in mononuclear cells, from brain and spinal cord of non-induced, EAE(at peak disease) and APP/PS1 mice(x±s, n=10) **P < 0.01 vs non-induced group |
通过对T细胞表面和胞内特异性蛋白参数的流式分析,可获得更多的T淋巴细胞亚群的信息。如Fig 3C所示,利用抗CD4和抗CD8抗体进行细胞表面孵育染色后,淋巴细胞群可以分出CD4+CD8-和CD4-CD8+ T细胞群;而利用抗IFNγ、抗IL-17a和抗Foxp3抗体进行胞内孵育染色后,我们也可以进一步分析CD4+CD8- T细胞群中1型辅助性T细胞(T helper cell 1, Th1)、17型辅助性T细胞(T helper cell 17, Th17)和调节性T细胞(regulatory T cells, Treg)细胞亚群的比例(Fig 3D),从而较全面和深入地分析淋巴细胞在疾病发展中的作用。根据统计学分析结果可以看出(Fig 4),在EAE和APP/PS1小鼠的CNS中,CD4+CD8- T细胞的比例要明显高于正常的C57BL/6小鼠(P < 0.01);进一步分析CD4+ CD8- T细胞亚群发现,Th1和Th17细胞在EAE和APP/PS1小鼠的CNS中的比例明显高于正常的C57BL/6小鼠(P < 0.01),但Treg细胞的比例却明显低于正常的C57BL/6小鼠(P < 0.01)。
3 讨论在CNS疾病中,BBB的损伤使得外周淋巴细胞大量浸润到CNS中产生免疫反应,参与疾病的发展。然而,尽管这些免疫反应作为许多神经功能障碍的关键机制,但它如何影响CNS的功能还有诸多未解之谜。因此,对于CNS中淋巴细胞的分析是阐明疾病发病机制和开拓治疗手段的重要途径。
淋巴细胞是相当复杂的不均一体,其不断在体内更新,在同一时间可以存在不同发育阶段或功能的亚群[10]。因此,若想实现对其功能的全面解读,必须选用合适的分析手段。目前,对于外周血和淋巴组织等组织中的淋巴细胞,FCM是普遍采用的分析方法[11]。FCM不仅可以检测细胞大小、内部颗粒的形状,还可以检测细胞表面和细胞内抗原、细胞内DNA和RNA含量等,在短时间内检测分析大量细胞,并自动化收集、储存和处理数据,进行多参数定量分析。随着多色FCM的发展,现代的高端流式细胞仪普遍已经达到10色以上,更高端的甚至达到了50色。因此,利用FCM对CNS中的淋巴细胞进行高通量多参数的分析是当前最全面、高效的方法。FCM对细胞的分析检测必须基于单细胞的基础上,因此,若想利用FCM分析CNS中的淋巴细胞,首先要从组织中获取有活性的单个细胞。
从组织中获取有活性的单个细胞的方法有多种,包括机械研磨法和酶消化法等。机械研磨法常常造成大量的细胞损伤;而酶消化法在操作过程中,对于酶的选择、消化程度和均一性较难掌握,容易产生细胞团块和细胞损伤,改变细胞表面蛋白的特性。CNS中细胞种类繁多,且淋巴细胞所占比例又较低,因此,这两种方法获得细胞的产量、纯度和活性均较低。淋巴细胞属于单个核细胞,其体积、形态和密度与其它细胞不同,本研究即根据不同细胞间密度的差别,采用Percoll非连续性密度梯度离心法,从脑和脊髓组织中分离出单个核细胞,为FCM分析提供高活性、高纯度的细胞样本。在处理组织的过程中,我们采用1 mL注射器针芯在筛网中悬空研磨组织,减少了细胞的损伤,较好地避免了细胞成团现象,且操作简单、快速,成本低,使用通常的实验设备即可完成。通过台盼蓝染色和FCM对细胞活性进行评价的结果表明,此方法提取的细胞存活率高,且分离过程不影响细胞活性,不改变其胞内和胞外的标记蛋白。
本研究中,我们分别提取了正常的C57BL/6小鼠、EAE和AD模型小鼠CNS中的单个核细胞,并通过FCM分析了其中淋巴细胞及其亚群的比例。统计学分析结果表明,在EAE和AD模型小鼠的CNS中,淋巴细胞群和CD45hi细胞群比例明显高于正常的C57BL/6小鼠,表明在这两种疾病状态下,大量的淋巴细胞透过损伤的BBB浸入CNS中,参与其中的免疫反应。而CD4+CD8- T细胞群比例的上升,表明此群细胞与CNS免疫反应的关系密切,进一步分析发现,其中介导炎症反应的Th1和Th17细胞亚群比例明显增高,印证了免疫炎症反应在EAE和AD病程中的重要作用;而具有免疫抑制作用的Treg细胞亚群比例的下降,可能是这些疾病中炎症反应升高的原因。同时,在APP/PS1小鼠的细胞亚群分析中我们也发现,与Th17细胞相比,Th1细胞比例的变化更明显,推测Th1细胞在AD的发病进程中可能发挥更重要的作用。本研究结果表明,在疾病状态下大量的淋巴细胞可以浸润到CNS,参与发病进程,而不同淋巴细胞亚群在此过程中起着不同的作用。因此,根据FCM的分析结果,我们可以清晰地判断各个亚群与疾病的关系,为进一步探讨神经系统疾病的发病机制和治疗策略提供重要基础。
Percoll密度梯度离心已被多次成功地用于动物细胞及其细胞器的分离[12-13]。Percoll是一种经聚乙烯吡喀烷酮处理的硅胶颗粒,分离液渗透性低、不穿透细胞、密度高、无毒害,是目前较理想的介质。为了获得较高活性的细胞,在提取CNS单个核细胞的过程中,我们要注意以下几点:(1)在脑和脊髓组织离体后1 h内,应尽快进行研磨,以免产生中心组织坏死及细胞自溶。研磨动作注意要轻柔,筛网保持悬空,避免在皿底上直接研磨而造成大批细胞死亡;在密度梯度离心前后,要保证组织和细胞一直处于低温的环境。(2)配制试剂时,先用9份Percoll分离液与1份PBS混合达到生理性渗透压,然后再稀释到所需浓度。(3)Percoll分离液需要在室温条件下使用,在实验时提前将其平衡至室温,并保证离心温度控制为(20±2)℃。(4)要轻轻地将30%的Percoll分离液覆盖在70%的Percoll分离液上面。操作时先将15 mL离心管倾斜45°,缓缓地将两种液体接触后,再慢慢边加液体边将离心管竖直,切忌冲破70%的Percoll分离液界面。(5)离心时使用水平转子,离心机转速的增加和减少要均匀、平稳,使界面保持清晰。(6)吸取细胞层时,可先去除上层大部分Percoll液后,再收集界面部位的细胞,吸取的含有Percoll液的细胞需经3次洗涤后,再进行下一步实验。(7)为了获得更多数目的细胞,在研磨组织后,也可先加入一些消化酶(如胶原蛋白酶)处理后,再进行密度梯度离心,但需要注意的是,有些细胞表面的蛋白容易被蛋白酶破坏,从而影响之后的抗体染色和流式细胞分析。因此,本研究中为了不影响流式细胞分析的准确性,在提取过程中未使用消化酶。
综上,本文介绍的Percoll密度梯度离心分离CNS中单个核细胞的方法,操作简单快速、成本低,获取的细胞活性高,可以进一步进行细胞培养、流式细胞分析以及蛋白和核酸的分析,结合这些分析技术,可以实现单个细胞多参数的定量分析。因此,本研究为分析CNS中淋巴细胞等单个核细胞的功能提供了重要方法。
| [1] | Ransohoff R M, Engelhardt B. The anatomical and cellular basis of immune surveillance in the central nervous system[J]. Nat Rev Immunol, 2012, 12(9): 623-35. doi:10.1038/nri3265 |
| [2] | Ferretti M T, Merlini M, Spani C, et al. T-cell brain infiltration and immature antigen-presenting cells in transgenic models of Alzheimer's disease-like cerebral amyloidosis[J]. Brain Behav Immun, 2016, 54: 211-25. doi:10.1016/j.bbi.2016.02.009 |
| [3] | Dittel B N. CD4 T cells: Balancing the coming and going of autoimmune-mediated inflammation in the CNS[J]. Brain Behav Immun, 2008, 22(4): 421-30. doi:10.1016/j.bbi.2007.11.010 |
| [4] | 郑明华, 唐玉兰, 韦俊杰, 等. 载脂蛋白E拟肽对实验性自身免疫性脑脊髓炎小鼠脑脊髓CD4+、CD8+ T淋巴细胞表达的影响[J]. 临床神经病学杂志, 2013, 3: 198-201. Zheng M H, Tang Y L, Wei J J, et al. Effect of apolipoprotein E-mimetic peptides on expressions of CD4+, CD8+ T cell of brain, spinal cord in mice with experimental autoimmune encephalomyelitis[J]. J Clin Neurol, 2013, 3: 198-201. |
| [5] | 龚业莉, 李佳楠, 黄丽霞. 高丽参提取液对大鼠自身免疫性脑脊髓膜炎的保护作用[J]. 中国免疫学杂志, 2016, 32: 1632-5. Gong Y L, Li J N, Huang L X. Protective effect of korean red ginseng extract in experimental autoimmune en-cephalomyelitis rats[J]. Chin J Immunol, 2016, 32: 1632-5. doi:10.3969/j.issn.1000-484X.2016.11.014 |
| [6] | 王赵伟, 厉芳, 吴承龙, 等. 沙利度胺抑制实验性自身免疫性脑脊髓炎与促进Treg细胞中枢募集有关[J]. 浙江医学, 2017, 22: 1957-60, 1980. Wang Z W, Li F, Wu C L, et al. Thalidomide alleviates experimental autoimmune encephalomyelitis through promoting Treg cell recruitment in rats[J]. Zhejiang Med, 2017, 22: 1957-60, 1980. doi:10.12056/j.issn.1006-2785.2017.39.22.2016-2092 |
| [7] | Pino P A, Cardona A E. Isolation of brain and spinal cord mononuclear cells using percoll gradients[J]. J Vis Exp, 2011, 48(48): e2348. |
| [8] | Garcia J A, Cardona S M, Cardona A E. Isolation and analysis of mouse microglial cells[J]. Curr Protoc Immunol, 2014, 104: unit14.14.35. doi:10.1002/0471142735.im1435s104 |
| [9] | Miller S D, Karpus W J. Davidson T S. Experimental autoimmune encephalomyelitis in the mouse[M]. Curr Protoc Immunol, 2010, 88(1): 15. 1. 1 -20. |
| [10] | Jiang S, Dong C. A complex issue on CD4(+) T-cell subsets[J]. Immunol Rev, 2013, 252(1): 5-11. doi:10.1111/imr.12041 |
| [11] | 刘端勇, 黄敏芳, 徐荣, 等. 黄芪多糖对结肠炎大鼠小肠PP结中T淋巴细胞亚群的调节作用[J]. 中国药理学通报, 2015, 31(9): 1328-9. Liu D Y, Huang M F, Xu R, et al. Effect of Astragalus polysaccharides in regulating the T lymphocyte subgroup in intestinal PPs of rat with colitis[J]. Chin Pharmacol Bull, 2015, 31(9): 1328-9. |
| [12] | Zhao D, Xu A, Dai Z, et al. WNT5A transforms intestinal CD8alphaalpha(+) IELs into an unconventional phenotype with pro-inflammatory features[J]. BMC Gastroenterol, 2015, 15: 173. doi:10.1186/s12876-015-0402-3 |
| [13] | Kristian T. Isolation of mitochondria from the CNS[M]. Curr Protoc Neurosci, 2010, Chapter 7: Unit 7 22. doi: 10.1002/0471142301.ns0722S52. |

