


2. 贵州医科大学 附属医院神经内科,贵州 贵阳 550025
2. Dept of Neurology, Affiliated Hospital of Guizhou Medical University, Guiyang 550025, China
新生儿行为异常和运动缺陷,包括智力发育迟缓、癫痫、脑瘫、学习障碍等[1]。HIE也是婴幼儿死亡率和发病率增高的一个重要原因,目前还没有完善的治疗方法[2]。研究表明,HIE破坏性极强,缺氧缺血是造成患儿脑损伤的主要原因,缺氧缺血引发炎症,在新生儿大脑的生长发育过程中,炎症是导致大脑损伤的关键因素,围产期的神经炎症会增加儿童期和成年期神经性疾病和神经精神性疾病的风险,因此,减轻炎症造成的神经病理损伤,即可改善神经系统的功能[3]。先天免疫不仅是预防感染的第一道防线,而且还参与一系列炎症反应,包括脑损伤后的炎症反应[4]。NOD样受体(NOD-like receptor,NLRs)已被证实是炎症反应和免疫的主要调节者,NOD2是NLRs的主要成员之一,NOD2作为重要的胞质内模式识别受体,广泛参与免疫细胞病原体的识别与炎性反应的诱导,已有研究证明NOD2参与脑缺血后的炎症反应,过度炎症反应加重脑损伤[5-6]。因此,当发生缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)时,抗炎将作为潜在的治疗靶点。国内外研究证实,柚皮素(naringenin)有较强的抗炎、抗氧化和抗肿瘤作用,对帕金森病、阿尔茨海默病等有脑保护作用[7-9],但目前关于柚皮素在HIE方面的研究甚少。因此,本研究基于NOD2/受体相互作用蛋白2 (receptor interacting protein 2,RIP2)诱导的核因子-κB(nuclear factor kappa B,NF-κB)信号通路,观察柚皮素对新生大鼠缺血缺氧性脑损伤的保护作用。探索缺血缺氧性脑损伤的机制,为临床治疗新生儿缺氧缺血脑损伤奠定基础。
1 材料与方法 1.1 材料 1.1.1 动物健康清洁级新生7日龄SD大鼠,♀♂不限,体质量12~17 g。由贵州医科大学实验动物中心提供,许可证号:SCXK (黔) 2012-0001。
1.1.2 药物与试剂柚皮素(Sigma,批号:BCBR3619);GAPDH(批号:10494-1-AP)、NOD2(批号:20980-1-AP)、RIP2(批号:15366-1-AP)、NF-κB(批号:14220-1-AP)抗体,均购自Proteintech公司; 肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α) (批号:AK0017SEP20001)、白细胞介素-1β(interleukin-1 beta,IL-1β) (批号:AK0017SEP20 002) ELISA试剂盒,均购自Elabscience公司; 二抗(北京中杉金桥生物技术有限公司,批号:126526);ECL发光液(Millipore公司,批号1629801)。
1.1.3 仪器ELx800-MV型酶联免疫检测仪(美国Bio-Tek公司); 进口实验动物PTFE软管一次性灌胃针5202K(上海金畔生物科技有限公司); XS205型电子天平(瑞士梅特勒-托利多科学仪器公司); KJ-210A型振荡器(姜堰市康健医疗器具有限公司); Centrifuge 5810R型高速冷冻离心机(德国Eppendorf公司); Chemi Doc TM XRS+型凝胶成像仪及电泳仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 动物分组96只健康7日龄新生SD大鼠,♀♂不限,随机分为4组,假手术组(Sham)、缺血缺氧性脑损伤组(HIBD)、柚皮素低剂量组(50 mg·kg-1,NG-L)和柚皮素高剂量组(100 mg·kg-1,NG-H),每组24只。Sham组仅做颈部开口手术,暴露右侧颈总动脉,不结扎,不缺氧; HIBD组、柚皮素低、高剂量组均要进行手术建立HIBD模型。
1.2.2 给药方案将柚皮素(纯度>95%)溶于0.5%羧甲基纤维素钠溶液中,柚皮素低、高剂量组分别给予柚皮素50、100 mg·kg-1,HIBD组和Sham组给予等剂量羧甲基纤维素钠。建立HIBD模型后即刻灌胃给药,每12 h给药1次,共给药4次。
1.2.3 建立HIBD模型采用改进后的经典Rice法[10],选取健康7日龄新生SD大鼠,♀♂不限,称重后用10%水合氯醛腹腔注射麻醉(3 mL·kg-1),新生大鼠取仰卧位,头部和四肢固定于手术板上,75%酒精消毒,行颈部正中切口,分离右侧颈总动脉,注意防止迷走神经受到刺激或损失,双重结扎,并从双重结扎线中间剪断血管,缝合切口。术后恢复2~3 h后,将手术后的新生大鼠放入缺氧箱中,通入8%氧气和92%氮气的混合气体,气流量1 L·min-1,37℃缺氧2 h,制备HIBD模型,模型制备后,放回笼中母鼠身边继续饲养。
1.2.4 神经功能缺陷评分建立HIBD模型48 h后,参照Longa评分法[11]对各组新生大鼠进行神经功能缺陷评分:0分,正常; 1分,轻度神经功能缺损,左侧前肢伸展不完全; 2分,中度神经功能缺损,行走过程中转圈; 3分,重度神经功能缺损,行走过程中倾倒; 4分,不能自发行走,意识不清。神经功能缺陷评分得分越高,损伤就越严重。
1.2.5 HE染色各组新生大鼠评分完毕后,每组取8只新生大鼠,用10%水合氯醛腹腔注射麻醉(3 mL·kg-1),麻醉后打开胸腔,先用生理盐水心脏灌注,清除血液,直至流出澄清液体后,改用4%多聚甲醛灌注,待大鼠全身僵硬后,立即取脑组织,于4%多聚甲醛溶液中固定,脱水、石蜡包埋、切片、HE染色,光学显微镜下观察脑组织病理改变。
1.2.6 脑组织含水量检测建立HIBD模型48 h后,每组取8只,采用干湿重法检测脑组织含水量,将新生大鼠断头处死,迅速取脑,将新生大鼠脑从矢状缝切开,称取新生大鼠右脑组织质量为湿重,放入100℃烘箱中烘干24 h,称量后为干重。脑组织含水量/%=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
1.2.7 Western blot法检测相关蛋白表达建立HIBD模型48 h后,将各组新生大鼠麻醉处死,提取新生大鼠右侧脑组织蛋白,用于NOD2和RIP2的检测,用核蛋白提取试剂盒抽提得到细胞核蛋白进行NF-κB的检测,将提取的蛋白采用BCA法进行蛋白定量。制样后进行SDS-PAGE电泳,然后转移至PVDF膜上,转膜结束后,脱脂奶粉封闭2 h,分别加入一抗NOD2(1 :1 000)、RIP2(1 :2 000)、NF-κB(1 :1 000),4 ℃孵育过夜,洗膜后,加入相应的辣根过氧化物酶标记的二抗(1 :20 000),再次洗膜后,加入ECL发光液,于凝胶成像仪上曝光显影,用Image J图像分析软件分析条带灰度值。
1.2.8 ELISA法检测TNF-α和IL-1β含量建立HIBD模型48 h后,称取新生大鼠右侧脑组织,加入一定量的PBS (pH=7.4),于玻璃匀浆器中匀浆,匀浆充分后,离心取上清液,按照ELISA试剂盒说明进行操作。
1.3 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。计量资料采用x±s表示,组间比较采用单因素方差分析(One-way ANOVA)和Dunnett法。
2 结果 2.1 神经功能缺陷评分建立HIBD模型48 h后,对各组新生大鼠进行神经功能缺陷评分,假手术组新生大鼠无神经功能缺陷症状。HIBD组神经功能缺陷评分最高,新生大鼠神经功能缺陷明显,如行走时转圈或倾倒。与模型组比较,柚皮素低、高剂量组神经行为学指标评分下降,神经功能明显改善(Tab 1)。
| Group | Dose/mg·kg-1 | Score |
| Sham | - | 0 |
| HIBD | - | 3.08±0.65* |
| NG-L | 50 | 2.21±0.59*# |
| NG-H | 100 | 1.71 ± 0.62*# |
| *P < 0.05 vs sham; #P < 0.05 vs HIBD | ||
如Fig 1所示,假手术组新生大鼠大脑各分区结构层次清楚形态规则,胶质细胞大小、形态、数量及排列正常规则,神经元细胞排列有序,核仁清晰,形态正常,未见特殊病变。模型组右侧大脑组织结构被破坏,神经元排列紊乱,数目减少,部分神经元肿胀变性坏死,炎性细胞浸润及神经胶质细胞增生; 大脑组织水肿明显,较多变性坏死的神经细胞。柚皮素低剂量组大部分神经元及胶质细胞大小、形态、数量及排列正常规则,少数神经元肿胀变性及神经胶质细胞增生; 大脑组织轻度水肿。柚皮素高剂量组大脑组织结构基本正常,变性坏死的神经细胞明显减少,病理损伤改善明显(Fig 1)。
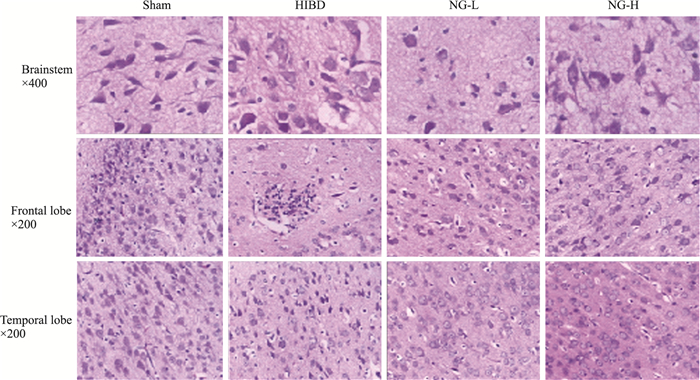
|
| Fig 1 Pictures of HE staining of brain tissues |
如Fig 2所示,与假手术组相比,模型组新生大鼠脑缺氧缺血损伤侧脑含水量明显升高,脑水肿明显,而柚皮素低、高剂量组较模型组脑含水量明显下降,脑水肿减轻,差异有统计学意义(P < 0.05)。
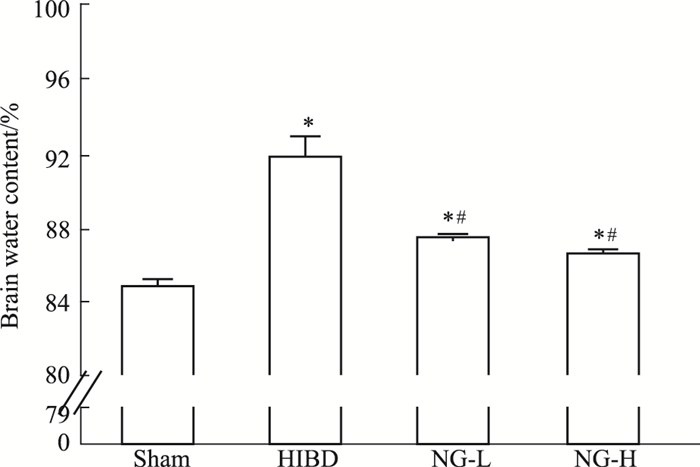
|
| Fig 2 The water content of brain tissues in each group *P<0.05 vs sham; #P < 0.05 vs HIBD |
Fig 3的Western blot检测结果显示,与假手术组比较,模型组新生大鼠缺氧缺血后NOD2、RIP2、NF-κB蛋白表达明显上调; 与模型组比较,柚皮素低、高剂量组NOD2、RIP2和NF-κB蛋白表达明显下降,差异具有统计学意义(P < 0.05)。
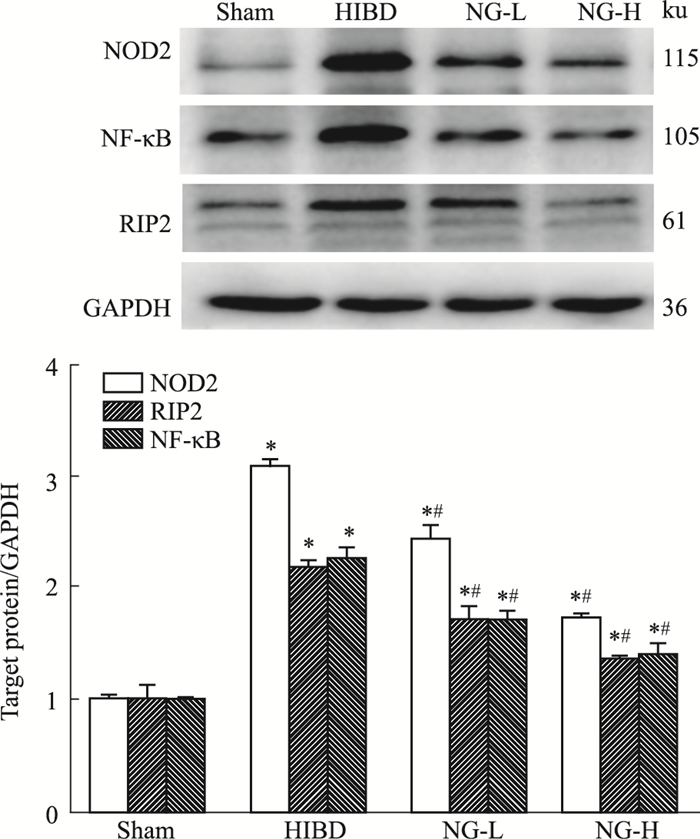
|
| Fig 3 Western blot analysis of target protein in rat brain 48h after operation *P<0.05 vs sham; #P < 0.05 vs HIBD |
Fig 4的ELISA结果显示,与假手术组比较,模型组TNF-α和IL-1β含量明显上调; 与模型组比较,柚皮素低、高剂量组TNF-α和IL-1β的含量下降,差异具有统计学意义(P < 0.05)。
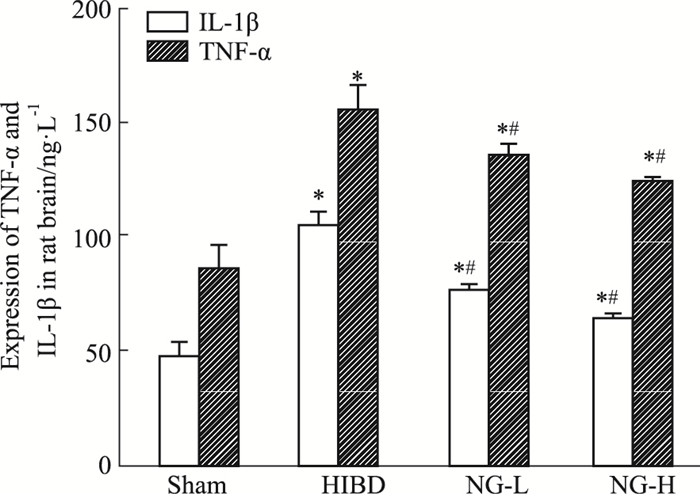
|
| Fig 4 ELISA analysis of TNF-α and IL-1β expression in rat brain 48h after operation *P < 0.05 vs sham; #P < 0.05 vs HIBD |
HIE是新生儿期常见的中枢神经系统疾病,严重危害新生儿健康,因此,探寻有效的治疗方法迫在眉睫。在HIBD的研究中,成功建立合适的缺氧缺血模型是前提,本研究采用了改进后的经典Rice法,将7 d大鼠结扎单侧颈总动脉结合缺氧,建立了新生大鼠HIBD模型,该法制作过程简单、价格低廉、成功率高、重复性好。
炎症反应是新生儿脑损伤的重要因素。NOD2作为一种重要的模式识别受体,当发生脑缺血后,来自于损伤或坏死细胞中的危险信号分子作为NOD2的配体与其结合,NOD2受体被激活募集RIP2分子,过度表达RIP2可以激活转录因子NF-κB,继而使NF-κB依赖的靶基因转录,分泌炎症因子如TNF-α、IL-1β等。NF-κB是许多细胞转化的重要调控因子,如免疫反应、炎症、细胞凋亡等[12]。TNF-α和IL-1β是脑组织炎症反应早期的炎性细胞因子,在缺氧缺血性病理损伤中起重要作用[13]。
本实验发现,HIBD组NOD2、RIP2、NF-κB蛋白表达上调,表明NOD2受体被激活,继而激活NF-κB通路,发生一系列反应参与HIE损伤,且ELISA显示TNF-α和IL-1β分泌增多,脑损伤加重。因此,如果能抑制NOD2的激活,减少炎症因子的分泌,则可以减轻新生大鼠缺血缺氧性损伤。已有研究证实[14],柚皮素预防性给药可以下调NOD2、RIP2、NF-κB、MMP-9的表达,上调Claudin-5的表达,对永久性脑缺血成年大鼠发挥神经保护作用。研究发现[15],预防性给予成年大鼠柚皮素后制备脑缺血/再灌注模型,柚皮素可以明显减小梗死体积,保护脑缺血/再灌注损伤。
柚皮素是柚皮苷的苷元, 是从芸香科植物柚中提取出来的二氢黄酮类化合物。柚皮素具有多种药理学活性, 是一种具有广阔发展前景的植物药。本研究显示,新生大鼠缺血缺氧后脑组织中NOD2、RIP2、NF-κB的表达明显升高,TNF-α和IL-1β的分泌增多,脑损伤明显。柚皮素低、高剂量均可下调NOD2、RIP2和NF-κB蛋白的表达,并减少TNF-α和IL-1β的分泌。柚皮素降低HIBD新生大鼠的神经行为学评分,改善神经系统功能,减轻脑水肿和病理学损伤,对新生大鼠HIBD发挥保护作用。其机制可能是柚皮素抑制NOD2的激活,进而使NOD2/RIP2诱导的NF-κB信号通路的蛋白表达减少,并且降低下游炎症因子TNF-α和IL-1β的分泌。本研究应用柚皮素给药,为HIBD治疗提供了可能的实验依据。
( 致谢: 本研究在贵州医科大学药理学实验室完成,在此感谢各位老师和同学的帮助。)
| [1] | Fathali N, Lekic T, Zhang J H, et al. Long-term evaluation of granulocyte-colony stimulating factor on hypoxic-ischemic brain damage in infant rats[J]. Intensive Care Med, 2010, 36(9): 1602-8. doi:10.1007/s00134-010-1913-6 |
| [2] | Dixon B J, Reis C, Ho W M, et al. Neuroprotective strategies after neonatal hypoxic ischemic encephalopathy[J]. Int J Mol Sci, 2015, 16(9): 22368-401. |
| [3] | Hagberg H, Mallard C, Ferriero D M, et al. The role of inflammation in perinatal brain injury[J]. Nat Rev Neurol, 2015, 11(4): 192-208. doi:10.1038/nrneurol.2015.13 |
| [4] | Kim J Y, Kawabori M, Yenari M A. Innate inflammatory responses in stroke: mechanisms and potential therapeutic targets[J]. Curr Med Chem, 2014, 21(18): 2076-97. doi:10.2174/0929867321666131228205146 |
| [5] | Folkard D L, Marlow G, Mithen R F, et al. Effect of Sulforaphane on NOD2 via NF-κB: implications for Crohn's disease[J]. J Inflamm, 2015, 12(1): 6. |
| [6] | Liu H, Wei X, Kong L, et al. NOD2 is involved in the inflammatory response after cerebral ischemia-reperfusion injury and triggers NADPH oxidase 2-derived reactive oxygen species[J]. Int J Biol Sci, 2015, 11(5): 525-35. doi:10.7150/ijbs.10927 |
| [7] | Chen Y, Wu H, Nie Y C, et al. Mucoactive effects of naringin in lipopolysaccharide-induced acute lung injury mice and beagle dogs[J]. Environ Toxicol Pharmacol, 2014, 38(1): 279-87. doi:10.1016/j.etap.2014.04.030 |
| [8] | Zbarsky V, Datla K P, Parkar S, et al. Neuroprotective properties of the natural phenolic antioxidants curcumin and naringenin but not quercetin and fisetin in a 6-OHDA model of Parkinson's disease[J]. Free Radic Res, 2005, 39(10): 1119-25. doi:10.1080/10715760500233113 |
| [9] | Heo H J, Kim D O, Shin S C, et al. Effect of antioxidant flavanone, naringenin, from Citrus junoson neuroprotection[J]. J Agric Food Chem, 2004, 52(6): 1520-5. |
| [10] | 黄莹, 叶兰, 冯占辉, 等. CpG-ODN对新生大鼠缺血/缺氧性脑损伤的保护作用研究[J]. 中国药理学通报, 2017, 33(7): 956-61. ]Huang Y, Ye L, Feng Z H, et al. Protective effect of CpG-ODN conditioning on hypoxic/ischemicbrain damage in neonatal rats[J]. Chin Pharmacol Bull, 2017, 33(7): 956-61. |
| [11] | Li X, Blizzard K K, Zeng Z, et al. Chronic behavioral testing after focal ischemia in the mouse: functional recovery and the effects of gender[J]. Exp Neurol, 2004, 187(1): 94-104. doi:10.1016/j.expneurol.2004.01.004 |
| [12] | Ghosh S, Karin M. Missing pieces in the NF-κB puzzle[J]. Cell, 2002, 109(2): S81-96. doi:10.1016/S0092-8674(02)00703-1 |
| [13] | Aly H, Khashaba M T, Elayouty M, et al. IL-1beta, IL-6 and TNF-alpha and outcomes of neonatal hypoxic ischemic encephalopathy[J]. Brain Dev, 2006, 28(3): 178-82. doi:10.1016/j.braindev.2005.06.006 |
| [14] | Bai X, Zhang X, Chen L, et al. Protective effect of naringenin in experimental ischemic stroke: down-regulated NOD2, RIP2, NF-κB, MMP-9 and up-regulated claudin-5 expression[J]. Neurochem Res, 2014, 39(8): 1405-15. doi:10.1007/s11064-014-1326-y |
| [15] | Raza S S, Khan M M, Ahmad A, et al. Neuroprotective effect of naringenin is mediated through suppression of NF-κB signaling pathway in experimental stroke[J]. Neuroscience, 2013, 230: 157-71. doi:10.1016/j.neuroscience.2012.10.041 |

