


肝损伤是人类最常见的疾病之一。动物肝损伤模型种类较多,与其他中毒性肝损伤如CCl4模型等相比,刀豆蛋白A(concanavalin A,ConA)诱发的肝损伤模型模拟了人类病毒性肝炎引发的免疫性肝损伤的病理生理过程,更适合研究人类病毒性肝炎。目前研究表明,ConA诱导肝损伤重要机制之一为其活化T淋巴细胞后,由肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor 2,TNF-R2)介导活性氧(reactive oxygen species,ROS)增多,进而诱导肝细胞c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)活性及表达增多[1-3]。Maeda等[4]证实,JNK在ConA肝损伤中起关键作用,在JNK1或JNK2表达缺失的小鼠中,ConA和脂多糖加半乳糖胺诱导的肝损伤被明显抑制; 更为重要的是,抗氧化剂如丁基羟基茴香醚(butylated hydroxyanisole,BHA)等可以明显抑制ConA损伤小鼠中JNK的活化并保护肝损伤,提示JNK为ROS途径的下游作用靶点[3-5]。因此,抑制ROS及其介导的JNK的活化是肝损伤,尤其是TNF-α相关依赖性肝损伤的重要环节。
目前,治疗肝损伤的药物由于有效性缺乏、不良反应多、安全性低等原因,无法满足临床需求,因此,趋向于筛选出具有更好安全性和功效特征的药物。马栗种子提取物(Aesculus hippocastanum seeds extract,AH)为欧洲七叶树种子的提取物,主要成分为七叶素,亦是其发挥药理作用的主要成分。AH具有较好的临床使用安全性,主要应用于慢性静脉功能不全、痔静脉曲张等。近年来,多项研究发现其具有抗氧化、抗炎、抗肿瘤等多种药理作用,尤其AH在体内、体外实验中均证实为强抗氧化剂,其清除ROS的能力为L-抗坏血酸的20倍之多[6-9]。关于AH的强抗氧化作用主要因其结构分子中含有大量羟基,具有很强的供H+和离子鳌合能力,从而起到清除ROS的作用[10]。近年研究发现,AH可有效改善大鼠脑缺血/再灌注损伤[11]; Elmas等[12]研究发现,AH对大鼠糖尿病肾病具有保护作用,机制与AH抑制氧化应激有关。我们前期的研究在四氯化碳诱导的肝损伤模型中,初步观察到AH可有效降低小鼠肝脏TNF-α水平,可能具有肝损伤保护作用,但具体机制尚不清楚[13]。AH是否对ConA诱导的急性肝损伤具有保护作用,其机制是否与ROS介导的JNK途径有关尚不清楚。基于我们前期的研究基础,本研究在小鼠体内实验中,观察AH对ConA诱导急性肝损伤的作用,同时探讨其相关机制是否与AH抗氧化,进而抑制其介导的JNK途径有关。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级昆明小鼠,♂,体质量18~22 g,由甘肃省中医药大学动物实验中心提供。
1.1.2 试剂ConA为Sigma公司产品; IFN-γ、TNF-α ELISA试剂盒购自上海晶抗生物工程有限公司; caspase-3活性检测试剂盒购自碧云天生物技术公司; 其余试剂均为化学分析纯。
1.1.3 仪器LS-50B型荧光分光光度计(日本Shimadu公司); IX-70型荧光显微镜(日本Olympus公司)。
1.2 马栗种子提取物混悬液的制备AH为德国威玛舒培博士药厂生产,生产批号:0780117。每片含马栗种子干燥提取物263.2 mg,标定含有50 mg七叶素。将AH粉碎溶解于蒸馏水,以其中七叶素含量为标定,制备成浓度为2.5 g·L-1的混悬液,不同剂量给药组以含七叶素量标定分别为12.5、25、50 mg·kg-1。
1.3 肝损伤模型的制备[14]将96只昆明小鼠随机分为正常组、模型组、醋酸泼尼松组(PNS)、AH低、中、高剂量保护组,每组16只。适应性饲养3 d后,分别给予PNS(7.8 mg·kg-1)、AH (12.5、25、50 mg·kg-1)灌胃,正常组与模型组分别灌胃等体积生理盐水,共计20 d。末次灌胃给药后,正常对照组小鼠尾静脉注射生理盐水10 mL·kg-1,其余各组小鼠均一次性按体质量20 mg·kg-1尾静脉注射ConA,8 h后所有小鼠进行采血、取材后处死。本研究中动物实验遵循的所有程序均符合国家及甘肃省人民医院制订的有关实验动物的规则和制度。
1.4 肝脏组织HE染色及病理学改变的评价取小鼠肝右叶条形组织块(约0.2 g),4%中性多聚甲醛固定、石蜡包埋、制成4 μm连续切片后,固定在玻片上,行常规HE染色,光镜下观察各组肝组织结构的病理变化。由3位病理科主治医师进行双盲读片,并对观察到的每张病理切片所显示肝脏损伤程度进行分级。本实验中,镜下见肝脏损伤程度评分标准如下,0级:正常肝组织细胞; Ⅰ级:轻度肝细胞肿胀,散发炎性细胞,个别肝细胞坏死; Ⅱ级:少于肝小叶1/3的局灶或斑块性肝细胞坏死,聚集炎性细胞浸润; Ⅲ级:广泛的肝细胞坏死,约占1/3至1/2的肝小叶,大量炎性细胞浸润; IV级:肝细胞坏死多于肝小叶的1/2,广泛炎性细胞浸润[14]。
1.5 血清指标检测模型制备成功后,所有小鼠进行眼眶采血,将采集好的全血置于低速自动平衡离心机内离心,2 000 r·min-1,15 min。离心后上清采用全自动生化分析仪检测AST、ALT、TP、Alb及A/G比。血清IFN-γ、TNF-α采用ELISA试剂盒按说明书进行检测。
1.6 肝组织MDA、SOD、GSH检测切取左前叶肝组织0.5 g左右,冷生理盐水冲洗,滤纸吸干,称重,冰浴中制成10%肝匀浆,3 500 r·min-1低温离心15 min, 取上清液。按说明书采用硫代巴比妥酸比色法检测MDA含量,TNB法检测GSH水平,黄嘌呤氧化酶法测定SOD活性。
1.7 caspase-3活性检测按照每3~10 mg组织加入100 μL裂解液的比例加入专用裂解液,在冰浴上用玻璃匀浆器匀浆,然后把匀浆液转移到1.5 mL离心管中,冰浴再裂解5 min后,4 ℃、16 000×g离心15 min,将上清转移到冰浴预冷的离心管中,立即测定caspase-3的酶活性,酶标仪于405 nm处读取相应值。
1.8 Western blot提取总蛋白后,用BCA试剂盒测定蛋白浓度,并将样品的浓度均调整为5 g·L-1,溶解在10 g·L-1十二烷基硫酸钠(sodium dodecyl sulfate, SDS)中,上样体积8 μL,制作转膜“三明治”,0.4 A恒流转膜60 min,5%的脱脂奶粉室温封闭1 h。倒掉封闭液, 用5%的脱脂奶粉按一定比例稀释一抗,将膜置于一抗孵育液中,4℃摇动过夜,用TBST洗膜3次,每次5 min。用5%的脱脂奶粉按一定比例稀释羊抗兔二抗,将膜置于二抗孵育液中,室温孵育1 h,TBST洗膜4次,每次5 min,ODYSSEY Fc imaging system显色,拍照。数据用样品与β-actin的比值表示。
1.9 统计学分析所有数据以x±s表示。组间差异用ANOVA及Newman-Student多重比较t检验分析; 肝组织病理分级统计数据釆用Mann-Whitney U检验,由SPSS 21.0统计软件完成。
2 结果 2.1 AH对ConA诱导急性肝损伤小鼠血清ALT、AST、TP、Alb、A/G比的影响Tab 1结果显示,与正常对照组相比,ConA模型组小鼠的血清ALT、AST水平明显增高,同时血清TP、Alb、A/G比明显降低; 阳性对照药PNS(7.8 mg·kg-1)及AH(12.5、25、50 mg·kg-1)可以浓度依赖性地抑制ConA所致小鼠血清ALT、AST水平的增高及TP、Alb、A/G比的降低(P < 0.05)。
| Group | Dose/mg·kg-1 | AST/kU·L-1 | ALT/kU·L-1 | TP/g·L-1 | Alb/g·L-1 | A/G ratio |
| Control | - | 86.13±4.15 | 33.55±2.01 | 62.29±1.58 | 41.26±1.20 | 1.78±0.13 |
| ConA model | 20 | 393.56±19.93* | 51.28±3.58* | 50.87±1.22* | 27.23±1.34* | 1.05±0.14* |
| AH | 12.5 | 254.50±5.82 # | 43.08±2.20 # | 54.64±2.01 # | 30.21±1.23 # | 1.17±0.21 # |
| 25 | 206.67±3.01 # | 38.29±3.64 # | 56.21±1.68 # | 33.33±2.01 # | 1.23±0.31 # | |
| 50 | 163.21±5.12 # | 34.58±3.01 # | 58.31±1.47 # | 36.21±1.45 # | 1.47±0.22 # | |
| PNS | 7.8 | 140.83±4.75 # | 32.05±2.89 # | 59.64±1.68 # | 38.25±1.67 # | 1.51±0.16 # |
| *P < 0.05 vs control; #P < 0.05 vs ConA | ||||||
Fig 1 HE染色结果显示,正常组小鼠肝脏未见明显异常,在染色中肝细胞胞质均匀红染,细胞核大小正常,核质淡染,肝窦清晰可见,肝索排列整齐。ConA模型组肝组织内大量淋巴细胞浸润,汇管区少量淋巴细胞、粒细胞存在,肝窦内大量红细胞淤积,肝板消失、凋亡小体散在、肝细胞脂肪变性。AH及PNS组均明显减轻肝脏炎症坏死的程度,病理损伤分级降低(Tab 2)。
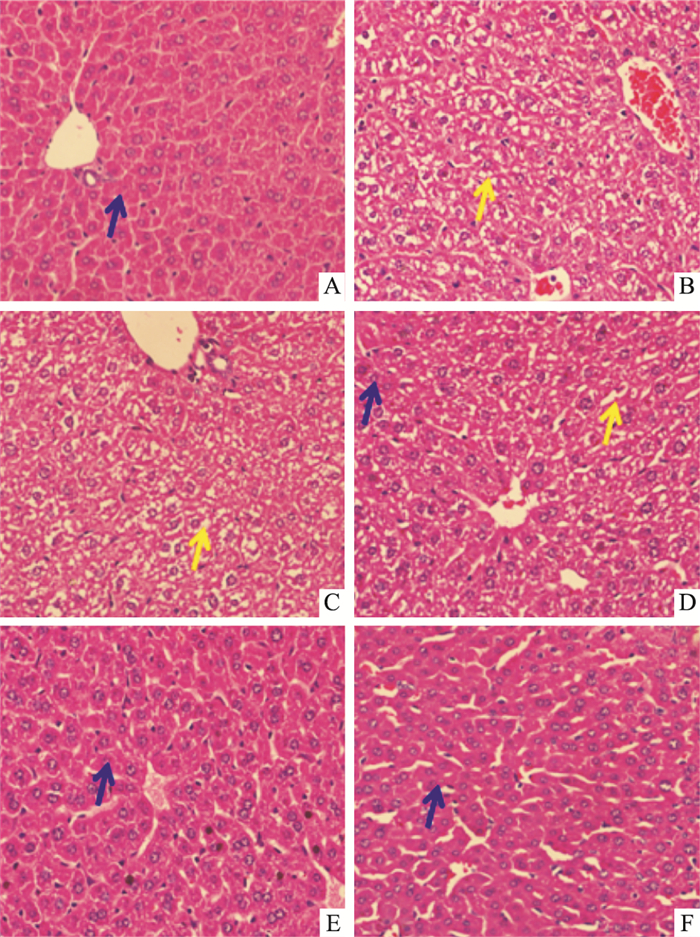
|
| Fig 1 Histopathological analysis of protective effect of AH on ConA-induced liver injury(×400) A: Control; B: ConA; C: ConA+12.5 mg·kg-1 AH; D: ConA+25 mg·kg-1 AH; E: ConA+50 mg·kg-1 AH; F: ConA+PNS. Blue arrow: Normal hepatocyte; Yellow arrow: Hepatocellular necrosis |
| Group | Dose/mg·kg-1 | Extent of liver damage (grade) | P | ||||
| 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | |||
| No. of mice | |||||||
| Control | - | 16 | 0 | 0 | 0 | 0 | - |
| ConA model | 20 | 0 | 0 | 0 | 3 | 13 | 0.000 4* |
| AH | 12.5 | 4 | 6 | 3 | 2 | 1 | 0.008# |
| 25 | 5 | 10 | 1 | 0 | 0 | 0.000 4# | |
| 50 | 9 | 7 | 0 | 0 | 0 | 0.000 4# | |
| PNS | 7.8 | 10 | 5 | 0 | 1 | 0 | 0.000 8# |
| *P < 0.05 vs control; #P < 0.05 vs ConA | |||||||
Tab 3结果显示,与正常对照组相比,ConA模型组小鼠的血清IFN-γ、TNF-α水平明显增高; PNS及AH (12.5、25、50 mg·kg-1)可以明显抑制ConA所致小鼠血清IFN-γ、TNF-α水平的增高。
| Group | Dose/mg·kg-1 | IFN-γ/ng·L-1 | TNF-α/ng·L-1 |
| Control | - | 3.45±0.14 | 30.41±2.38 |
| ConA model | 20 | 70.58±8.69* | 129.86±10.47* |
| AH | 12.5 | 58.69±4.56# | 102.65±7.56# |
| 25 | 46.52±5.69# | 81.05±6.87# | |
| 50 | 32.78±4.26# | 66.30±5.46# | |
| PNS | 7.8 | 17.42±4.95# | 57.64±5.62# |
| *P < 0.05 vs control; #P < 0.05 vs ConA | |||
与正常对照组相比,ConA模型组小鼠肝组织MDA水平明显增高,同时GSH、SOD水平明显降低; PNS及AH(12.5、25、50 mg·kg-1)均可明显抑制ConA所致小鼠肝组织MDA水平的增高及GSH、SOD的降低(Tab 4)。
| Group | Dose/mg·kg-1 | MDA/μmol·g-1 Pro | SOD/kU·g-1 Pro | GSH/mg·g-1 Pro |
| Control | - | 0.72±0.03 | 85±6.32 | 22.30±3.41 |
| ConA model | 20 | 1.82±0.11* | 19±2.37* | 5.12±2.22* |
| AH | 12.5 | 1.68±0.08# | 28±2.68# | 9.34±1.37# |
| 25 | 1.47±0.07# | 39±1.91# | 15.67±2.08# | |
| 50 | 1.25±0.06# | 50±2.64# | 18.99±2.57# | |
| PNS | 7.8 | 1.02±0.05# | 55±5.42# | 19.88±3.04# |
| *P < 0.05 vs control; #P < 0.05 vs ConA | ||||
如Fig 2所示,与正常对照组相比,ConA损伤组小鼠肝组织细胞色素C、caspase-3、Bax/Bcl-2比值明显增高; PNS及AH(12.5、25、50 mg·kg-1)组细胞色素C、caspase-3、Bax/Bcl-2比值较ConA组明显降低(P < 0.05)。

|
| Fig 2 Effect of AH on cell apoptosis-related markers in ConA-induced liver injury model (x±s, n=3) A: Expression of cytochrome C detected by Western blot; B: Caspase-3 activity; C: Bax and Bcl-2 expression. *P < 0.05 vs control group; #P < 0.05 vs ConA group |
如Fig 3所示,与正常对照组相比,ConA模型组小鼠的肝组织p-JNK表达明显增高,p-Akt表达明显降低; PNS及AH(12.5、25、50 mg·kg-1)组相比ConA损伤组,p-JNK表达明显降低,同时p-Akt明显增高。

|
| Fig 3 Effect of AH on p-JNK(A) and p-Akt(B) expression in ConA-induced liver injury model (x±s, n=3) *P < 0.05 vs control group; #P<0.05 vs ConA group |
本研究在小鼠体内实验中证实AH对ConA诱导的急性肝损伤具有一定的保护作用。AH可明显改善ConA诱导的急性肝损伤的病理分级,降低ConA所致血清ALT、AST水平的增高,相关研究显示其机制与AH保护抗氧化酶体系,抑制ROS产生,进而抑制JNK及其介导的线粒体细胞凋亡损伤途径相关。
AH具有强抗氧化作用,为了探究其是否对肝损伤具有保护作用,本研究首先检测了各组小鼠血清ALT、AST、TP、Alb水平及A/G比值这5个主要反映肝功能的指标。结果显示,不同浓度AH可以明显降低ConA诱导的ALT、AST水平的增高,同时保护TP、Alb水平及A/G比的降低。各组肝损伤的病理改变及分级情况与血清学改变结果相一致,AH可以明显改善ConA诱导的肝脏病理学改变,同时AH可以明显抑制ConA诱导的TNF-α、IFN-γ的释放。上述结果提示,AH对ConA诱导的急性肝损伤具有一定的保护作用。
本研究进一步进行了相关机制研究。我们前期研究显示,AH的抗氧化作用主要与其保护体内的抗氧化酶及抑制脂质过氧化物MDA的产生有关。正常机体内的氧化与抗氧化系统处于相对平衡状态,ROS包括O2-、OH-、H2O2等,体内的抗氧化酶主要有GSH、SOD等,其中GSH在肝内含量最高,主要由肝细胞合成。GSH可直接通过供H+拮抗氧自由基毒性,其本身则被氧化为GSSG; 而SOD可以催化O2-生成H2O2,从而减少O2-与NO的反应。另外,氧自由基能攻击生物膜中的多元不饱和脂肪酸,形成脂质过氧化代谢终产物MDA,其含量反映体内脂质过氧化的程度。与我们以往在CCl4诱导肝损伤模型中的研究结果相一致,本研究结果显示,AH可以明显升高ConA诱导的GSH、SOD水平,同时降低MDA水平,这间接反映了AH可明显抑制ConA诱导的氧化应激。
目前研究表明,ROS通过下游一系列信号转导途径诱导肝损伤,其中重要途径之一为其介导的JNK途径[3]。JNK活化后,在细胞周期、增殖、凋亡、细胞应激等多种生理和病理过程中起重要作用。JNK被细胞因子或ROS激活而磷酸化为p-JNK,作用于线粒体通路,通过影响Bax/Bcl-2比值导致线粒体凋亡,细胞色素C释放增多,同时激活caspase家族级联反应,诱导caspase-3活化,最终导致细胞凋亡[3, 15]。我们的结果显示,AH可以浓度依赖性抑制ConA所致小鼠肝组织细胞色素C水平、caspase-3活力及Bax/Bcl-2比值增高,这初步提示JNK途径可能介导了AH对ConA诱导的肝损伤的保护作用。进而我们直接检测各组小鼠肝组织的p-JNK蛋白表达情况,结果显示,ConA可以明显诱导肝组织p-JNK蛋白表达增多,而AH保护组p-JNK蛋白表达明显被抑制; 同时检测了p-Akt蛋白表达情况。Akt信号通路被生长和存活因子激活而磷酸化,诱导Bcl-2表达的增加及Bax表达的降低,从而抑制线粒体途径的凋亡,同时p-Akt也可以直接阻碍JNK的磷酸化,从而抑制caspase的活化,减轻细胞凋亡[16]。与p-JNK的表达相反,ConA可以明显诱导肝组织p-Akt蛋白表达减少,而AH可以明显升高p-Akt表达,该结果进一步证实了JNK途径在AH保护ConA诱导的肝损伤中的作用。本研究在动物模型中未能彻底验证AH抑制的JNK途径是否为ROS所介导,本课题组将在体外肝细胞培养模型中,运用ROS抑制剂、JNK siRNA及JNK的特异性阻断剂等,通过检测AH+ siRNA JNK处理后相关肝损伤指标变化、抗氧化剂处理后JNK的表达变化等,进一步探讨AH、ROS、JNK三者作用的上下游关系。
本研究在体内实验初步证实了AH对ConA诱导的急性肝损伤具有一定的保护作用,其机制可能与AH抑制ROS及其介导的JNK途径有关。本研究结果将为肝损伤靶向药物的开发及联合用药提供一定的实验及理论依据。
( 致谢: 本研究主要在甘肃省中医药大学动物实验中心及甘肃省人民医院科研中心完成,感谢课题组成员在整个实验中所付出的劳动。)
| [1] | 刘慧敏, 韩延忠, 郭玉明, 等. 六味五灵片对刀豆蛋白A诱导的小鼠急性免疫性肝损伤的保护作用研究[J]. 中国药理学通报, 2017, 33(1): 133-40. Liu H M, Han Y Z, Guo Y M, et al. The protection effects of Liuweiwuling Tablets against concanavalin A-induced acute immunological liver injury in mice[J]. Chin Pharmacol Bull, 2017, 33(1): 133-40. |
| [2] | 杨扬, 吴小琴, 李小枫, 等. 栀子柏皮汤及含栀子配伍组对免疫性肝损伤小鼠的保护作用[J]. 中国药理学通报, 2015, 31(12): 1764-9. Yang Y, Wu X Q, Li X F, et al. Study on the protective effect in immunological liver injury in mice of Zhizi Baipi Soup and its disassembled prescription[J]. Chin Pharmacol Bull, 2015, 31(12): 1764-9. doi:10.3969/j.issn.1001-1978.2015.12.027 |
| [3] | Schwabe R F, Brenner D A. Mechanisms of liver injury: role of IKK, JNK, and ROS pathways[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(4): G583-9. doi:10.1152/ajpgi.00422.2005 |
| [4] | Maeda S, Chang L, Li Z W, et al. IKKbeta is required for prevention of apoptosis mediated by cell-bound but not by circulating TNFalpha[J]. Immunity, 2003, 19(5): 725-37. doi:10.1016/S1074-7613(03)00301-7 |
| [5] | Streetz K, Fregien B, Plumpe J, et al. Dissection of the intracellular pathways in hepatocytes suggests a role for Jun kinase and IFN regulatory factor-1 in ConA-induced liver failure[J]. J Immunol, 2001, 167(1): 514-23. doi:10.4049/jimmunol.167.1.514 |
| [6] | Sirtori C R. Aescin: pharmacology, pharmacokinetics and therapeutic profile[J]. Pharmacol Res, 2001, 44(3): 183-93. doi:10.1006/phrs.2001.0847 |
| [7] | Küçükkurt I, Ince S, Keleş H, et al. Beneficial effects of Aesculus hippocastanum L. seed extract on the body's own antioxidant defense system on subacute administration[J]. J Ethnopharmacol, 2010, 129(1): 18-22. doi:10.1016/j.jep.2010.02.017 |
| [8] | Selvakumar G P, Manivasagam T, Rekha K R, et al. Escin, a novel triterpene, mitigates chronic MPTP/p-induced dopaminergic toxicity by attenuating mitochondrial dysfunction, oxidative stress, and apoptosis[J]. J Mol Neurosci, 2015, 55(1): 184-97. doi:10.1007/s12031-014-0303-x |
| [9] | Masaki H, Sakaki S, Atsumi T, et al. Active-oxygen scavenging activity of plant extracts. seed extract on the body's own antioxidant defense system on subacute administration[J]. Biol Pharm Bull, 1995, 18(1): 162-6. doi:10.1248/bpb.18.162 |
| [10] | Vaáková J, Fejerčáková A, Mojžišová G, et al. Antioxidant potential of Aesculus hippocastanum extract and escin against reactive oxygen and nitrogen species[J]. Eur Rev Med Pharmacol Sci, 2015, 19(5): 879-86. |
| [11] | Hu X M, Zhang Y, Zeng F D. Effects of beta-aescin on apoptosis induced by transient focal cerebral ischemia in rats[J]. Acta Pharmacol Sin, 2004, 25(10): 1267-75. |
| [12] | Elmas O, Erbas O, Yigitturk G. The efficacy of Aesculus hippocastanum seeds on diabetic nephropathy in a streptozotocin-induced diabetic rat model[J]. Biomed Pharmacother, 2016, 83: 392-6. doi:10.1016/j.biopha.2016.06.055 |
| [13] | 杨社华, 葛斌, 王艳红, 等. 马栗籽提取物对急性肝损伤小鼠自由基及TNF-α含量的影响[J]. 中国医院药学杂志, 2014, 34(17): 1453-6. Yang S H, Ge B, Wang Y H, et al. Extracts of European Hippocastanum seeds carbon tetrachloride liver injury free radicals TNF-α[J]. Chin J Hosp Pharm, 2014, 34(17): 1453-6. |
| [14] | Wang F, Xue Y, Yang J, et al. Hepatoprotective effect of apple polyphenols against concanavalin A-induced immunological liver injury in mice[J]. Chem Biol Interact, 2016, 258: 159-65. doi:10.1016/j.cbi.2016.08.018 |
| [15] | Horwacik I, Rokita H. Targeting of tumor-associated gangliosides with antibodies affects signaling pathways and leads to cell death including apoptosis[J]. Apoptosis, 2015, 20(5): 679-88. doi:10.1007/s10495-015-1103-7 |
| [16] | Linton M F, Babaev V R, Huang J, et al. Macrophage apoptosis and efferocytosis in the pathogenesis of atherosclerosis[J]. Circ J, 2016, 80(11): 2259-68. doi:10.1253/circj.CJ-16-0924 |

