


2. 甘肃中医药大学临床医学院;
3. 甘肃省中医药防治慢性疾病重点实验室,甘肃 兰州 730000
2. School of Clinical Medicine, Gansu University of Chinese Medicine;
3. Key Lab of Prevention and Treatment for Chronic Diseases by Traditional Chinese Medicine of Gansu Province, Lanzhou 730000, China
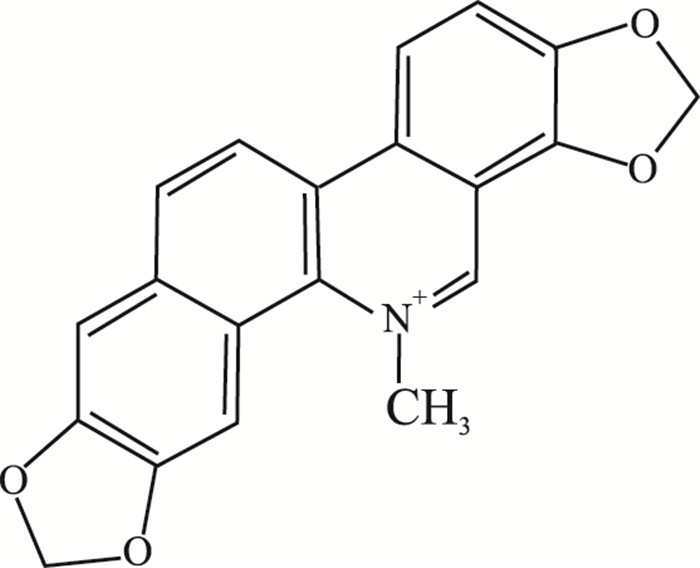
癌症严重危害着人类健康,目前世界上因病死亡的总死亡率中,癌症仅次于心血管疾病位居第二。肝癌是癌症中具有较高死亡率的一种,每年有70万的死亡病例,居癌症致死率的第3位[1]。目前,临床上治疗肝癌的化疗药物选择和临床疗效非常有限,并且价格昂贵,因此,开发安全有效、价格低廉的抗肝癌药物是国内外面临的共同难题[2]。中药博落回具有抗菌和杀虫的作用,其主要活性成分血根碱(sanguinarine,San), 结构式见Fig 1,在肿瘤化疗方面存在潜在的价值,其不仅可以抑制肿瘤细胞增殖,而且可以促进肿瘤细胞凋亡[3]。本文就血根碱诱导HepG2细胞凋亡的机制进行研究,明确血根碱通过活性氧(reactive oxygen species,ROS)调控线粒体介导的凋亡途径,进而促进HepG2细胞凋亡,为血根碱的临床药物开发及应用奠定基础。
|
| Fig 1 Chemical structure of sanguinarine |
人肝癌HepG2细胞由兰州大学药学院惠赠。
1.1.2 试剂血根碱、DMEM培养基、二甲基亚砜(DMSO)、Hoechst 33342、DCFH-DA、N-乙酰半胱氨酸(N-acetylcysteine,NAC),均购自美国Sigma公司;胎牛血清购自杭州四季青生物公司;胰蛋白酶购自美国Gibco公司;MTT、DHE、双抗和化学发光液购自北京索莱宝生物公司;BSA、PMSF和Na3VO4购自碧云天生物公司;所有抗体购自美国Abcam公司。
1.1.3 仪器RTG50005-9-VBC三气培养箱(美国Thermo公司),550酶标仪、全自动化学发光系统(美国Bio-Rad公司),IX-71倒置显微镜(日本Olympus公司),FACSCanto流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 实验分组及药物干预空白对照组(Control)加入不含药物的载体溶液1 mL·L-1 DMSO,药物干预组加入不同终浓度的血根碱,药物干预+NAC组加入1.5 μmol·L-1的血根碱及5 mmol·L-1的NAC,NAC是ROS的清除剂。
1.2.2 MTT法检测细胞活力细胞以5×106·L-1接种于96孔板中,每孔100 μL,24 h后依次加入终浓度为0.5、1、1.5、2、2.5、3 μmol·L-1的血根碱,空白对照组加入不含药物的载体溶液,每组设8个复孔;分别于12、24、48 h后,每孔加入0.5% MTT溶液20 μL,继续培养4 h,最后每孔加入三联溶解液(10% SDS、5%异丁醇、0.1% HCl)100 μL,过夜溶解后,置于酶标仪上测定570 nm处的吸光度值。按以下公式计算细胞存活率:细胞存活率=(OD药物组-OD空白组)/(OD对照组-OD空白组)×100%,SPSS软件计算半数抑制率(IC50)。
1.2.3 细胞内ROS的检测将HepG2细胞(2×105个/孔)接种于12孔板中。待细胞生长至完全贴壁且部分融合后,各组更换含药培养基处理12 h,然后弃去含药培养基,用无血清的培养基配制10 μmol·L-1的DCFH-DA或DHE,每孔加入500 μL,然后在培养箱中避光孵育30 min,最后置于荧光显微镜下观察拍照。
1.2.4 Hoechst 33342检测细胞凋亡将HepG2细胞(2×105个/孔)接种于12孔板中,待细胞生长至完全贴壁且部分融合后,加入不同的药物处理24 h,然后弃去含药培养基,加入Hoechst 33342染液(5 mg·L-1)10 μL,培养箱中避光染色15 min,最后置于荧光显微镜下观察拍照。
1.2.5 Annexin V/PI双染检测细胞凋亡将HepG2细胞(4×105个/孔)接种在6孔板中,用不同药物处理24 h,胰酶消化后收集细胞;加入Annexin V-FITC和PI染料后,置于培养箱中避光染色20 min,最后用流式细胞仪检测凋亡细胞的分布情况。
1.2.6 Rho123染色检测线粒体膜电位MMP (Δψ)将HepG2细胞(4×105个/孔)接种在6孔板中,用不同浓度的血根碱干预24 h,胰酶消化后收集细胞,加入含有无酶水的Rho123染色试剂,避光染色30 min,最后用流式细胞仪在FL-1H滤光片下检测线粒体膜电位。
1.2.7 Western blot检测凋亡相关蛋白的表达将HepG2细胞接种在培养皿中,培养至细胞完全贴壁且80%融合后,用血根碱(0.5、1、2 μmol·L-1)处理48 h。裂解液在冰上充分裂解细胞,收集裂解液,取上清后检测总蛋白浓度,且将各组总蛋白调至统一水平。95℃高温变性后凝胶电泳分离,转膜,室温封闭后加入一抗,4℃过夜;TBST漂洗后,加入辣根过氧化物酶标记的二抗,置于37℃孵育2 h,TBST漂洗3次;最后加入增强化学发光液,在化学发光系统上曝光检测目的蛋白。灰度值使用Image J软件扫描测定。
1.2.8 统计学分析所有结果均以x±s表示。采用SPSS 17.0软件处理数据,并且用单因素方差分析对数据进行统计。
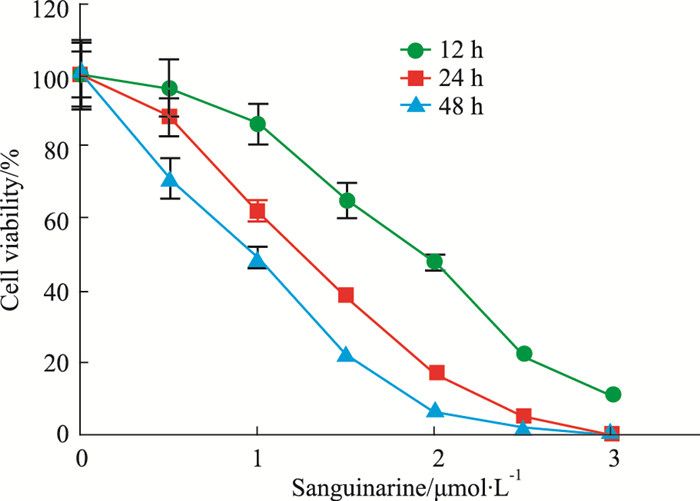
2 结果 2.1 血根碱抑制HepG2细胞的活力如Fig 2所示,在相同的作用时间下,随着血根碱药物浓度的增加,HepG2细胞活力呈现出递减趋势,血根碱作用HepG2细胞12、24、48 h的IC50分别为2.02、1.26、0.98 μmol·L-1;在相同的药物浓度下,随着血根碱作用HepG2细胞时间的延长,细胞活力明显下降。
|
| Fig 2 Viability of HepG2 cells treated with different time and concentrations of sanguinarine |
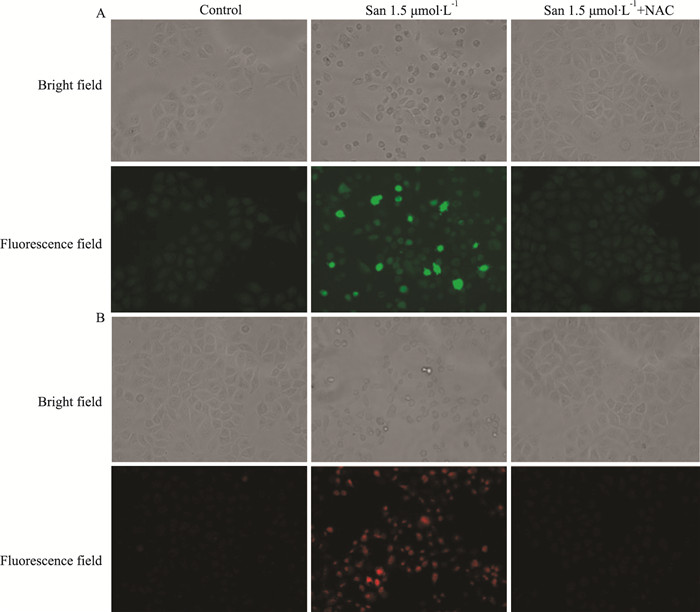
Fig 3A、3B分别显示药物干预12 h后的DCFH-DA、DHE染色,这两种染色方法都可检测细胞内ROS的含量。由Fig 3可以观察到,与对照组比较,1.5 μmol·L-1的血根碱可以明显提高细胞内ROS含量,且血根碱组的细胞与对照组比较表现出细胞扁圆、皱缩,细胞间未见融合现象;而同时加入血根碱和5 mmol·L-1 NAC(ROS清除剂)组,与血根碱组比较,细胞中ROS的含量明显减少;对照组和血根碱加NAC组细胞中ROS的含量都很低,且细胞形态无明显的差异。
|
| Fig 3 Analysis of ROS in HepG2 cells by DCFH-DA staining(A) and DHE staining(B) |
药物干预24 h后Hoechst 33342染色检测细胞凋亡,由Fig 4A可以观察到,对照组细胞核形态规则且核膜完整。与对照组比较,1.5 μmol·L-1的血根碱可以明显促进细胞核固缩、碎裂和凋亡小体的出现;且血根碱组的细胞与对照组比较表现出细胞扁圆、皱缩,细胞间未见融合现象。而同时加入血根碱和5 mmol·L-1 NAC组,与血根碱组比较,细胞中的核固缩和凋亡小体明显减少;对照组和血根碱加NAC组细胞中细胞核形态规则且核膜完整,且细胞形态无明显的变化。药物干预24 h后Annexin V/PI染色检测细胞凋亡,如Fig 4B所示,与对照组比较,1.5 μmol·L-1的血根碱可以促进细胞凋亡;而同时加入血根碱和5 mmol·L-1 NAC组,与血根碱组比较,细胞凋亡明显减少;对照组和血根碱加NAC组细胞凋亡数量无明显差异。

|
| Fig 4 Analysis of HepG2 cell apoptosis by Hoechst 33342 staining(A) and Annexin V/PI double-staining (B), and apoptosis analysis by Annexin V/PI staining (C) *P < 0.05, **P < 0.01 vs control |
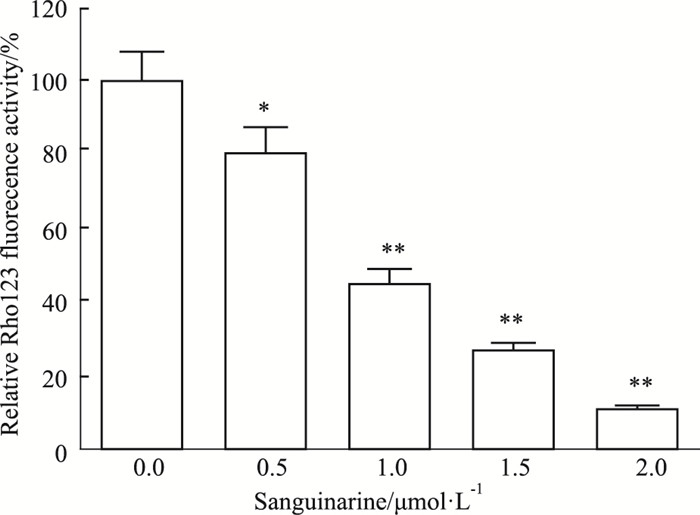
不同浓度的血根碱干预HepG2细胞后,Rho123染色检测细胞中线粒体膜电位。Fig 5结果显示,随着血根碱浓度的升高,细胞中线粒体的膜电位势能呈下降趋势;血根碱浓度在1、1.5、2 μmol·L-1时,细胞的线粒体膜电位明显低于对照组(P < 0.01)。
|
| Fig 5 Analysis of MMP (Δψ) by Rhodamine 123 staining *P < 0.05, **P < 0.01 vs control |
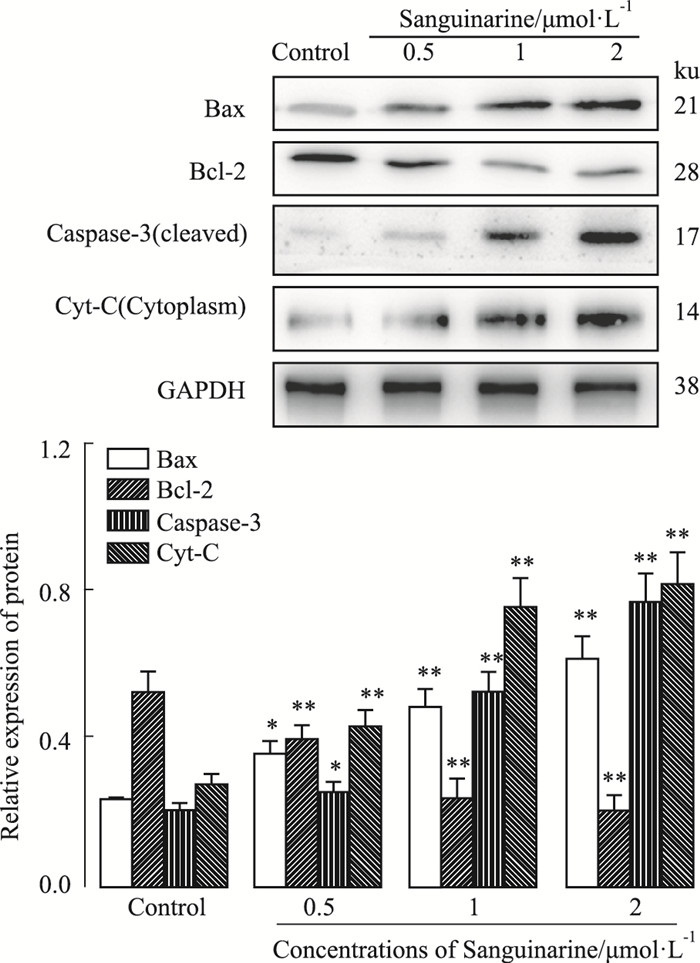
如Fig 6所示,与对照组比较,随着血根碱浓度的增加,Bax、cleaved-caspase-3(被剪切后有活性的形式)和线粒体外流到细胞质中的Cyt-C表达增加;而抑制细胞凋亡的蛋白Bcl-2的表达随着血根碱浓度的增加而减少。
|
| Fig 6 Effect of sanguinarine on expressions of key cell-apoptotic regulators mediated by mitochondria pathway in HepG2 cells *P < 0.05, **P < 0.01 vs control |
中药博落回是罂粟科植物博落回(Macleaya Cordata (wild) Br.R.[Bocconia cordata])的带根全草,多年生草本;味辛苦、温,有毒;具有消肿、解毒及杀虫之功效。血根碱是博落回植物的主要有效活性成分之一,为异喹啉衍生物类生物碱[4]。由于血根碱存在一个四元芳香环构成的离域π大键,所以其中的电子很容易发生π到π激发,使得血根碱易与细胞内的生物大分子发生相互作用[5]。血根碱这种容易与生物大分子相互作用的特点与其广泛的药理活性有着密切的关系,目前研究表明,血根碱的药理作用主要包括抗菌、抗病毒、抗炎、抗真菌、中枢神经麻醉、抗肿瘤等作用[6]。因此,本实验主要针对血根碱促进HepG2细胞凋亡的机制进行研究。
ROS源自细胞内正常代谢产物,且具有特定的化学活性,其中主要包括超氧阴离子(O2-)、HO·、过氧自由基(ROO·)、过氧化氢(H2O2)、一氧化氮自由基(NO·)和过氧亚硝基(ONOO-)[7]。所有有氧呼吸的细胞在常规生长代谢过程中或受到外界因素的刺激时,都会产生ROS。由于它们的活性不同,这些ROS会对细胞产生不同的生理效应,介导信号转导途径是其主要生理作用。研究表明,细胞内高水平的ROS累积会诱发氧化应激反应,最终通过激活凋亡信号通路使细胞死亡[8]。现有证据表明,如果ROS在细胞中不能及时清除且积累过量,会导致细胞线粒体膜损伤,同时ROS可以促进Bax蛋白、抑制Bcl-2蛋白的表达[9]。Bax和Bcl-2蛋白共属于一个家族,Bax/Bcl-2比值控制着线粒体膜通道孔(mitochondrial permeability transition pore,MPTP)的开关,如Bax/Bcl-2比值升高,MPTP打开造成线粒体膜通透性降低[10]。并且ROS能够促进细胞色素C与双磷脂酰甘油分离,从而促进细胞色素C从通透性低的线粒体膜内外流到细胞质中[11]。细胞色素C的外流到细胞质中会激活caspase家族蛋白,其中caspase-3是caspase家族蛋白引起细胞凋亡的最下游分子,也是细胞凋亡信号转导中起决定性作用的关键分子。细胞正常生长情况下,caspase-3蛋白的存在形式是没有活性的蛋白酶原,当受到上游凋亡信号激活后,水解成有活性的caspase-3(cleaved-caspase-3),因此,细胞凋亡的情况可以通过检测cleaved-caspase-3的表达量直接反映[12]。
本实验发现,血根碱对HepG2细胞的活性具有明显的抑制作用,且随着药物浓度的增加及作用时间的延长,抑制作用逐渐增强。血根碱作用HepG2细胞后,荧光显微镜下观察到HepG2细胞内ROS含量明显升高,凋亡细胞数量明显增多;而加入ROS清除剂NAC后,细胞内ROS的含量明显降低,凋亡细胞数量也明显下降,由此我们可以推断血根碱促进HepG2细胞凋亡与细胞内ROS的升高有密切的关系。通过Rho123染色检测线粒体膜电位,实验结果表明,随着血根碱浓度的升高,细胞中线粒体的膜电位势能呈下降趋势。Western blot检测凋亡相关蛋白的表达结果显示,血根碱通过激活线粒体凋亡途径来促进HepG2细胞的凋亡。本实验明确了血根碱通过ROS调控线粒体介导的凋亡途径,促进HepG2细胞凋亡,为血根碱的临床药物开发及应用奠定基础。
( 致谢: 本课题是在甘肃省中医药防治慢性疾病重点实验室完成,其他主要参与人有张兆芳、刘惠、窦霞和程芳,在此对所有参与人员的帮助表示由衷的感谢。)
| [1] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. doi:10.3322/caac.21262 |
| [2] | 聂艳丽, 南克俊. 分子靶向药物在肝细胞肝癌治疗中的研究进展[J]. 现代肿瘤医学, 2014, 22(8): 1996-9. Nie Y L, Nan K J. The progress of molecular targeted drugs for advanced hepatocecullar carcinoma[J]. Mod Oncol, 2014, 22(8): 1996-9. |
| [3] | Zhang R, Wang G, Zhang P F, et al. Sanguinarine inhibits growth and invasion of gastric cancer cells via regulation of the DUSP4/ERK pathway[J]. J Cell Mol Med, 2017, 21(6): 1117-27. doi:10.1111/jcmm.2017.21.issue-6 |
| [4] | 杜先华, 黄松, 冯泓瑞, 等. 博落回提取物血根碱对肿瘤细胞增殖及凋亡的影响[J]. 时珍国医国药, 2014, 25(12): 2860-1. Du X H, Huang S, Feng H R, et al. The effect of Sanguinarine on proliferation and apoptosis for cancer cell[J]. Lishizhen Med Mater Med Res, 2014, 25(12): 2860-1. |
| [5] | Basu P, Kumar G S. Sanguinarine and its role in chronic diseases[J]. Adv Exp Med Biol, 2016, 928: 155-72. doi:10.1007/978-3-319-41334-1 |
| [6] | Achkar I W, Mraiche F, Mohammad R M, et al. Anticancer potential of sanguinarine for various human malignancies[J]. Future Med Chem, 2017, 9(9): 933-50. doi:10.4155/fmc-2017-0041 |
| [7] | Piskounova E, Agathocleous M, Murphy M M, et al. Oxidative stress inhibits distant metastasis by human melanoma cells[J]. Nature, 2015, 527(7577): 186-91. doi:10.1038/nature15726 |
| [8] | 李昂, 邢雅琪, 李晓霞, 等. 氧化应激中ROS对FOXO3a转录因子的调控作用研究进展[J]. 中国药理学通报, 2016, 32(9): 1203-7. Li A, Xing Y Q, Li X X, et al. Redox regulation of FOXO3a transcription factor[J]. Chin Pharmacol Bull, 2016, 32(9): 1203-7. |
| [9] | Zhang J, Wang X, Vikash V, et al. ROS and ROS-mediated cellular signaling[J]. Oxid Med Cell Longev, 2016, 2016: 4350965. |
| [10] | Hatok J, Racay P. Bcl-2 family proteins: master regulators of cell survival[J]. Biomol Concepts, 2016, 7(4): 259-70. |
| [11] | Zhang Z W, Xu X C, Liu T, et al. Mitochondrion-permeable antioxidants to treat ROS-burst-mediated acute diseases[J]. Oxid Med Cell Longev, 2016, 2016: 6859523. |
| [12] | Mirzayans R, Andrais B, Kumar P, et al. The growing complexity of cancer cell response to DNA-damaging agents: caspase 3 mediates cell death or survival[J]. Int J Mol Sci, 2016, 17(5): pii: E708.. |

