


2. 军事认知与脑科学研究所,北京 100850
2. Institute of Military Cognitive and Brain, Beijing 100850, China
小肠是对缺血/再灌注(ischemia/reperfusion,I/R)损伤最敏感的器官,在失血性休克、创伤等情况下,均不可避免地会造成小肠的缺血性损伤,在解除或缓解缺血损伤的过程中,又会造成I/R损伤[1]。I/R损伤的病理生理机制十分复杂,涉及氧自由基损伤、白细胞黏附浸润、炎症介质释放、能量代谢障碍等多方面因素的参与[2-3]。肠道I/R不仅损害肠道本身,还会引发全身炎症反应综合征、多脏器功能不全综合征等[4],是造成重伤伤员康复率、生存率低的重要因素之一。目前,临床主要采用抗能量衰竭[5]、调控巨噬细胞激活转变[6]、抑制氧自由基[7]等药物治疗肠I/R损伤,但这些药物的疗效并不是很理想,I/R损伤的死亡率并未得到有效改善。因此,研究者们有必要进一步探究肠I/R损伤的发病机制,并努力研发出疗效更好、安全性更高的药物,进而达到抑制继发症发生、改善预后、提高存活率的目的。许多研究发现,炎症反应在肠I/R损伤的发生和发展过程中至关重要。白细胞介素-1(interleukin-1,IL-1)是一种重要的促炎因子,生物学效用广泛,可激活淋巴细胞,上调免疫功能,促进其他炎性细胞因子表达,诱导中性粒细胞浸润,刺激细胞增殖等[8]。白介素-1受体拮抗剂(interleukin-1 receptor antagonist, IL-1Ra)是天然抗炎因子,与IL-1竞争性结合细胞膜上的IL-1受体,从而拮抗IL-1信号传递,阻断其生物学功能,在调节免疫、抑制炎症方面发挥重要作用[9]。
肠道是自由基产生最为丰富的组织,肠I/R时,黄嘌呤氧化酶系统活性增强,线粒体功能受损,产生大量氧自由基。氧自由基不仅会通过氧化损伤蛋白质、脂质与DNA,从而直接破坏细胞,并且会激活多条信号通路,增加促炎因子、转录因子等的表达,从而诱导、调节细胞的凋亡和坏死[10]。有研究表明,IL-1Ra具有一定的清除自由基和增强内源性抗氧化系统的能力,对氧化应激损伤具有一定的治疗作用,可缓解脑、卵巢等多种器官的I/R损伤诱发的氧化应激[11-13],但其对肠I/R损伤是否具有防治作用尚不清楚。本研究通过夹闭肠系膜上动脉制备肠I/R损伤大鼠模型,探讨IL-1Ra对大鼠肠I/R后的肠损伤是否具有保护作用,为IL-1Ra的临床应用提供理论和实践依据。
1 材料 1.1 实验动物♂ SD大鼠35只,体质量245~265 g,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2016-0011。在每天光照12 h环境中饲养2周。
1.2 重组蛋白的制备以本研究室保存的PBV220IL-1Ra cDNA重组表达质粒,进行工程菌培养和诱导表达,获得含该蛋白的大量表达菌体,最后经阴、阳离子交换层析和纯化,制备IL-1Ra蛋白。
1.3 试剂肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(ERC102a)、IL-1β ELISA试剂盒(ERC007)、IL-6 ELISA试剂盒(ERC003),均购自欣博盛生物科技公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、髓过氧化物酶(myeloperoxidase, MPO)试剂盒,均购自南京建成生物工程公司;RIPA裂解液(01408)、BCA蛋白定量试剂盒(CW0014S),均购自北京康为世纪公司;蛋白酶抑制剂、磷酸酶抑制剂购自罗氏生物公司。
1.4 仪器Mode1550酶标仪、蛋白纯化系统Biologic Duo-Flow System (Bio-Rad公司);DU640紫外分光光度计(美国Beckman公司);3K18高速低温离心机(美国Sigma公司);GeneAmp PCR system 2700DNA扩增仪(Bio-Rad公司);URP Imagestore 7500凝胶成像分析系统(VILBER公司);BIOFLO Ⅲ发酵罐,LS-B高压灭菌器,阴、阳离子色谱分离层析柱Hit rap QFF,Hit rap SPFF (GE Healthcare公司);FPLC纯化仪(AKTA公司)。
2 方法 2.1 动物模型的制备及实验分组动物于实验前禁食12 h,正常饮水。2.5%戊巴比妥钠腹腔注射麻醉大鼠后,上腹正中部位开腹,暴露肠系膜上动脉(superior mesenteric artery, SMA)后,分离SMA并用动脉夹夹闭其根部造成缺血,1 h后取下动脉夹,使血流再灌注1 h。实验结束后处死,距回盲结5 cm取小肠,生理盐水清洗后,部分置于4%多聚甲醛中固定,剩余部分-70℃保存。
实验大鼠随机分成5组:假手术(S)组、模型(I/R)组、10 mg·kg-1 IL-1Ra+ I/R (C1)组、20 mg· kg-1 IL-1Ra+ I/R(C2)组、50 mg·kg-1 IL-1Ra+ I/R(C3)组。S组开腹后只分离SMA;I/R组夹闭SMA 1 h后再灌注1 h;C1、C2、C3给药组手术同I/R组,在松夹前15 min尾静脉注射不同剂量的IL-1Ra。
2.2 肠组织损伤评分4%多聚甲醛中固定的小肠组织经脱水、透明、石蜡包埋后,制成2~3 μm组织切片后,经苏木精-伊红(HE)染色,分别在100倍和400倍显微镜下随机选5个非重叠视野观察肠黏膜病理学改变。用Chiu氏法对肠组织病理损伤进行评分,取平均值用于统计[14],评分标准参见Tab 1。
| score | classification | standard |
| 1 | 0 | Normal mucosal villi |
| 2 | 1 | Form a gap in the middle axis of the villi, often withcapillary congestion |
| 3 | 2 | Extension of the subepithelial space with lifting of the epithelial layer from the lamina propria |
| 4 | 3 | Massive epithelial lifting down the sides of villi possibly with a few denuded tips |
| 5 | 4 | Denuded villi with the lamina propria and dilated capillaries exposed with possible increased cellularity of the lamina propria. |
| 6 | 5 | Digestion and disintegration of the lamina propria and presence of hemorrhage and ulceration |
取10%肠组织,室温解冻后匀浆,依照MPO试剂盒说明,用紫外可见分光光度计在460 nm处测定吸光度,计算MPO活性。
2.4 肠组织匀浆IL-1β、IL-6、TNF-α的含量检测取10%肠组织,室温解冻后匀浆,分别按ELISA试剂盒说明书进行操作,计算小肠组织IL-1β、IL-6、TNF-α的含量。
2.5 肠组织SOD和MDA检测取10%肠组织匀浆,用生理盐水稀释成1%组织匀浆液后,按SOD试剂盒说明,采用黄嘌呤氧化酶法测定组织中SOD活性。
2.6 统计学分析采用SPSS 20.0统计学软件对实验数据进行分析,结果以x±s表示,采用单因素方差分析,多组计量资料方差齐性,两两比较采用Bonfferoni检验。图形绘制应用Graphpad Prism6软件。
3 结果 3.1 IL-1Ra蛋白制备将含有PV220/IL-1Ra重组表达质粒的工程菌进行培养,并诱导表达重组蛋白。随后经过阴、阳离子交换层析和纯化,制备了IL-Ra重组蛋白,纯度>90 %(Fig 1)。
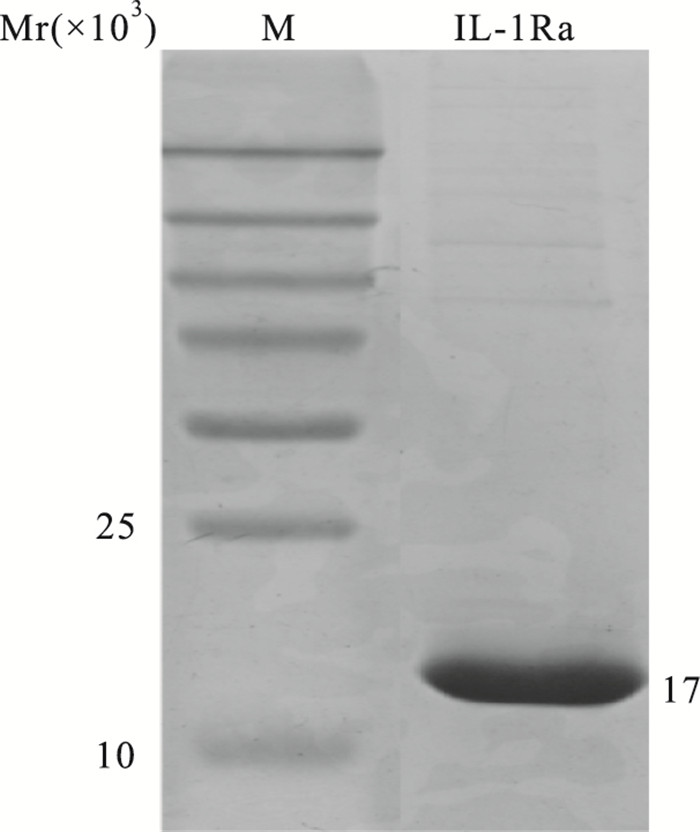
|
| Fig 1 Purified IL-1Ra recombinant protein M: Protein relative molecular mass markers; IL-1Ra: The recombinant protein prepared from purification |
肠组织石蜡切片经HE染色,分别在100倍和400倍光镜下观察,S组大鼠未见明显病理改变, 绒毛顶端上皮微有脱落。I/R组可见明显上皮细胞和绒毛顶端上皮脱落,固有层崩解,可见散在的出血灶和溃疡,腺体明显受损。应用IL-1Ra后, 大鼠肠黏膜损伤均明显减轻,C2组大鼠黏膜仅有轻度损伤,绒毛上皮细胞结构完整,未见毛细血管和淋巴管扩张。分别在100倍和400倍显微镜下随机选5个非重叠视野观察,根据Chiu氏评分标准,对不同组大鼠的肠组织损伤进行分级评分后,取平均值用于统计分析。结果显示,I/R 2 h后,I/R组小肠组织受损严重,与S组相比,差异具有显著性。而不同剂量给药组大鼠的肠组织损伤程度较模型组均有所改善,20 mg·kg-1给药组疗效最佳(Fig 2)。
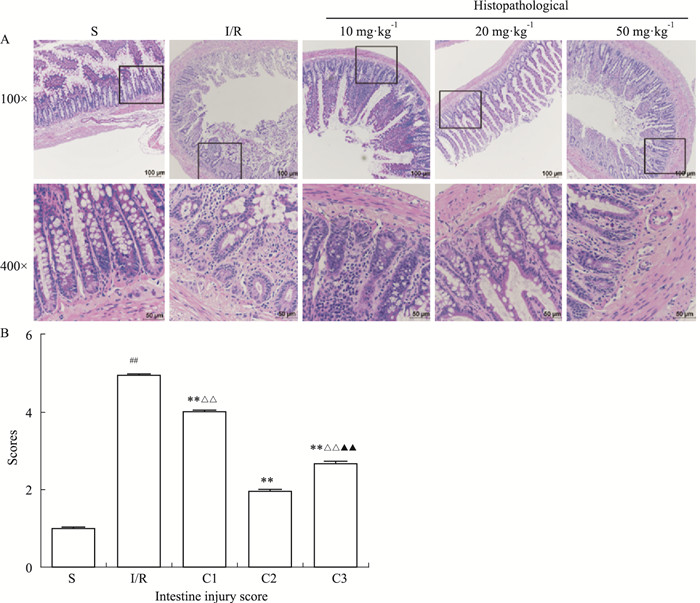
|
| Fig 2 Histopathological changes of intestinal mucosa and evaluation of intestinal injury with Chiu's scores (x±s, n=7) A: Histopathological pictures; B: Intestine injury score. ##P < 0.01 vs S group; **P < 0.01 vs I/R group; △△P < 0.01 vs C2 group; ▲▲P < 0.01 vs C1 group |
大鼠经I/R处理后,相比于S组,I/R组的促炎因子IL-1β、IL-6、TNF-α含量明显上升,再灌注前15 min尾静脉给药后,大鼠的小肠组织中上述炎症因子含量均下降,C1、C2给药组与I/R组相比,差异尤为明显(Fig 3)。
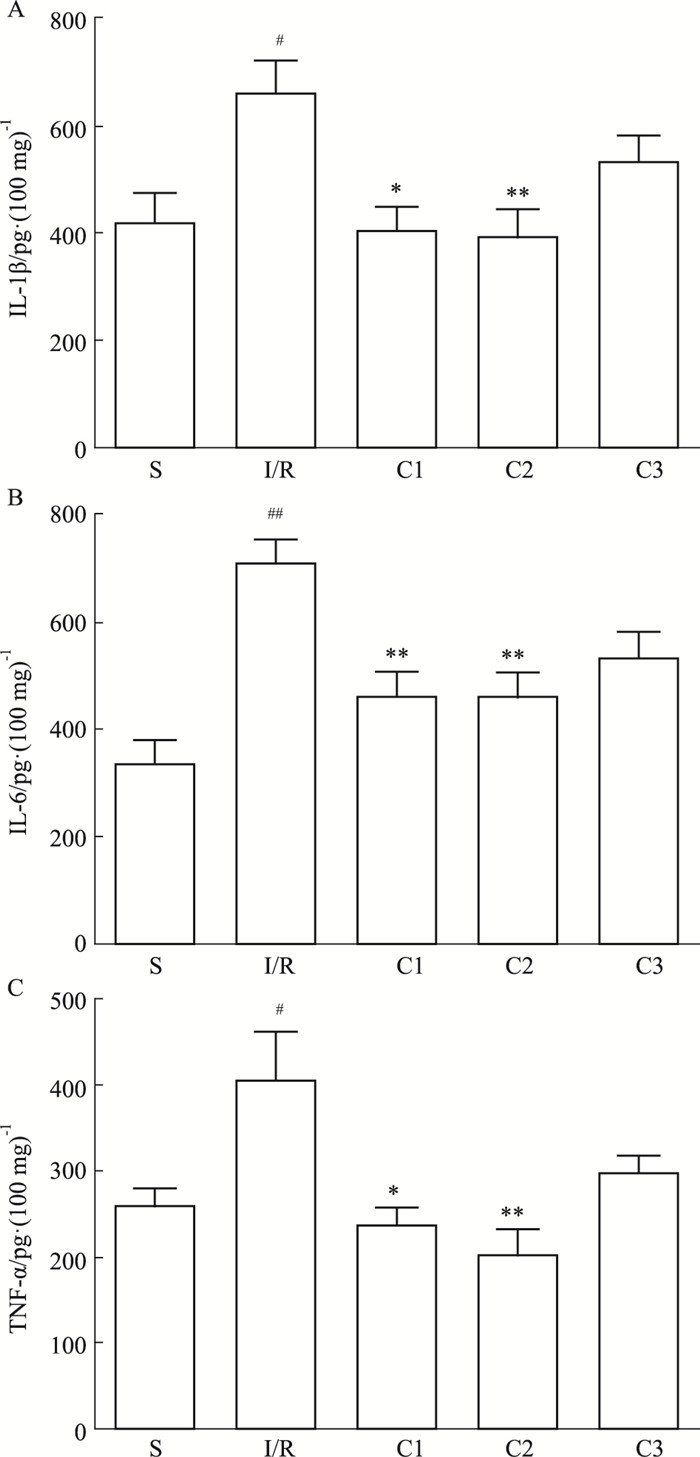
|
| Fig 3 Effects of IL-1Ra on contents of IL-1β(A), IL-6(B), TNF-α(C) (x±s, n=7) #P < 0.05, ##P < 0.01 vs S group; *P < 0.05, **P < 0.01 vs I/R group |
I/R 2 h后,I/R组大鼠的中性粒细胞标志物MPO指标明显上升,表明有大量中性粒细胞在肠组织聚集并活化,促进炎症反应。而尾静脉注射给药后,MPO含量下降,中性粒细的浸润得以缓解(Fig 4)。
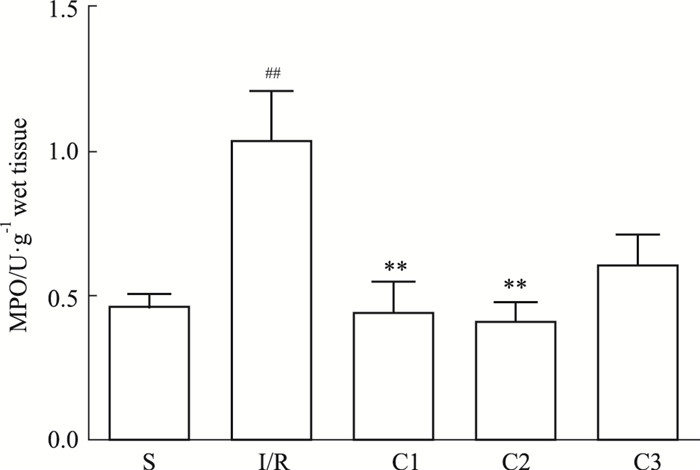
|
| Fig 4 Effects of IL-1Ra on contents of neutrophile granulocyte(x±s, n=7) ##P < 0.01 vs S group; **P < 0.01 vs I/R group |
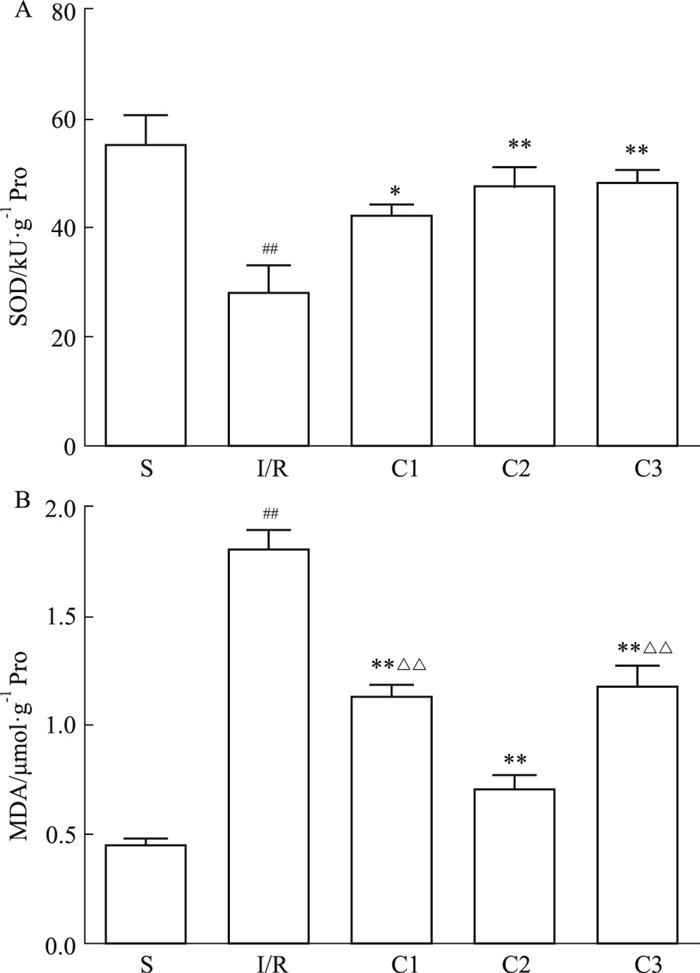
如Fig 5所示,I/R组与假手术S组相比,肠组织中抗氧化酶SOD被大量消耗,活力明显降低;肠组织中脂质过氧化产物MDA水平明显增加。给药治疗后,与I/R组相比,给药组大鼠SOD活性有所增高,MDA含量有不同程度的降低,C2组治疗效果明显。
|
| Fig 5 Effects of IL-1Ra on contents of SOD(A) and MDA(B) (x±s, n=7) ##P < 0.01 vs S group; *P < 0.05, **P < 0.01 vs I/R group; △△P < 0.01 vs C2 group |
IL-Ra是体内天然存在的抗炎因子,通过竞争性拮抗IL-1与膜上IL-1受体结合,阻断IL-1发挥生物活性。2001年被美国FDA批准用于临床治疗类风湿性关节炎,同时,大量研究表明,其对于化疗性肠炎、败血症性休克、脑中风、哮喘[15]等疾病诱发的炎症也有很好的治疗作用。本实验采用动脉夹夹闭肠系膜上动脉1 h,松开动脉夹恢复血流灌注制备了大鼠肠I/R模型,在再灌注前15 min尾静脉注射3个不同剂量的IL-Ra,探究IL-1Ra对肠I/R损伤的作用。结果发现,相比于I/R组,IL-Ra不同给药剂量组的炎症因子、MPO、SOD、MDA及Chui氏评分指标均有所改善,差异具有显著性。表明IL-Ra可有效抑制氧化应激和炎症反应,对肠I/R诱导的损伤具有很好的保护作用。
最新研究发现,IL-Ra对一些疾病伴随的氧化应激具有一定的抑制作用[11-13]。本实验研究结果显示,IL-Ra给药组大鼠肠组织氧化应激指标与模型组相比有明显改善,进一步表明IL-Ra对肠I/R损伤诱发的氧化应激同样也具有抑制作用。至于IL-Ra抑制氧化应激的作用机制,目前还未有明确的阐述。IL-Ra竞争性结合IL-1R,阻断IL-1作用于NF-κB和MAPK信号通路,我们推测其对氧化应激的抑制作用很可能与NF-κB和MAPK信号转导有关,具体作用机制有待进一步研究。
分析本实验结果发现,IL-1β、IL-6、TNF-α、MPO 4个炎性指标,高剂量C3组比中剂量C2组均略高,但差异都没有统计学意义,而高剂量组和中剂量组的SOD变化情况则基本一致,只有肠组织损伤评分和MDA指标,C2和C3组比较有较大差异。这可能是因为IL-1Ra在作用部位的浓度远高于IL-1后,拮抗阻断IL-1的生物学作用达到饱和,继续增加IL-1Ra给药剂量,其拮抗作用不会随之增强,即文中SOD指标基本无变化,IL-1β、IL-6、TNF-α和MPO检测指标差异无显著性。本实验只是初步研究了IL-1Ra对大鼠肠I/R诱导的肠损伤的保护作用,由于手术过程的繁琐,本次实验组只制备了7只大鼠,动物实验只数较少,同时,实验动物存在个体差异,可能出现高剂量组MDA值和组织损伤评分略高于中剂量组,但与I/R组相比,IL-1Ra高、中剂量组均能很好地降低MDA和组织损伤评分。在后续研究中,我们会增加实验动物的数量,再次检测以上指标,验证高、中剂量组的疗效,并进一步探究IL-1Ra对大鼠肠I/R诱导的肠损伤发挥保护作用的具体机制。
总之,肠I/R损伤是临床常见疾病,该损伤不仅会损伤局部肠组织,还可能导致肠黏膜屏障损伤,致使细菌移位、炎性介质释放,诱发急性肺损伤、系统性炎症反应综合征等远端器官或全身的炎症反应[4],致死率高。因此,针对肠I/R损伤的治疗,是重创伤救治领域密切关注的热点问题。本研究发现,IL-1Ra对肠I/R诱发的的炎症反应和氧化应激反应具有明显的抑制作用,在肠I/R损伤的治疗方面具有巨大的潜力,有望成为治疗这类疾病的新药。
( 致谢: 本实验在军事医学科学院基础医学研究所基因组工程研究室完成,衷心感谢各位老师和同学的帮助与鼓励!)
| [1] | Kalogeris T, Baines C P, Krenz M, et al. Ischemia/reperfusion[J]. Compr Physiol, 2016, 7(1): 113-70. |
| [2] | Woodman O L, Long R, Pons S, et al. The cardioprotectant 3', 4'-dihydroxyflavonol inhibits opening of the mitochondrial permeability transition pore after myocardial ischemia and reperfusion in rats[J]. Pharmacol Res, 2014, 81: 26-33. doi:10.1016/j.phrs.2014.01.004 |
| [3] | Bertoni S, Arcaro V, Vivo V, et al. Suppression of inflammatory events associated to intestinal ischemia-reperfusion by 5-HT1A blockade in mice[J]. Pharmacol Res, 2014, 81: 17-25. doi:10.1016/j.phrs.2014.02.002 |
| [4] | 李茜, 张彦敏, 关玥, 等. 人参皂苷Rg1对大鼠肠缺血/再灌注损伤的影响[J]. 中国药理学通报, 2010, 26(3): 358-61. Li Q, Zhang Y M, Guan Y, et al. Effect of ginsenoside Rgl on gut injury following intestinal ischemia reperfusion in rats[J]. Chin Pharmacol Bull, 2010, 26(3): 358-61. |
| [5] | Thurman J M. Triggers of inflammation after renal ischemia-reperfusion[J]. Clin Immunol, 2007, 123(1): 7-13. doi:10.1016/j.clim.2006.09.008 |
| [6] | 刘卫锋, 温仕宏, 李云胜, 等. 重组旋毛虫蛋白rTsP38对小鼠肠缺血/再灌注肠损伤的保护作用及机制研究[J]. 中国药理学通报, 2014, 30(9): 1235-41. Liu W F, Wen S H, Li Y S, et al. The protective effects of rTsP38 on intestinal ischemia/reperfusion injury in mice and its underlying mechanisms[J]. Chin Pharmacol Bull, 2014, 30(9): 1235-41. |
| [7] | Sargis R M, Subbaiah P V. Protection of membrane cholesterol by sphingomyelinagainst free radical-mediated oxidation[J]. Free Radic Biol Med, 2006, 40(12): 2092-102. doi:10.1016/j.freeradbiomed.2006.02.005 |
| [8] | Vivo V, Zini I, Cantoni A M, et al. Protection by the EPH-EPHRIN system against mesenteric ischemia-reperfusion injury[J]. Shock, 2017, 48(6): 681-9. doi:10.1097/SHK.0000000000000890 |
| [9] | Lin Y Z, Yao S Y, Veach R A, et al. Inhibition of nuclear translocation of transcription factor NF-kappa a synthetic peptide containing a cell membrane-permeable motif and nuclear localization sequence[J]. J Biol Chem, 1995, 270(24): 14255-8. doi:10.1074/jbc.270.24.14255 |
| [10] | Wen S H, Ling Y H, Li Y, et al. Ischemic postconditioning during reperfusion attenuates oxidative stress and intestinal mucosal apoptosis induced by intestinal ischemia/reperfusion viaaldose reductase[J]. Surgery, 2013, 153(4): 555-64. doi:10.1016/j.surg.2012.09.017 |
| [11] | Wahab F, Santos-Junior N N, Almeida Rodrigues R P, et al. Interleukin-1 receptor antagonist decreases hypothalamic oxidative stress during experimental sepsis[J]. Mol Neurobiol, 2016, 53(6): 3992-8. doi:10.1007/s12035-015-9338-4 |
| [12] | Pradillo J M, Murray K N, Coutts G A, et al. Reparative effects of interleukin-1 receptor antagonist in young and aged/co-morbid rodents after cerebral ischemia[J]. Brain Behav Immun, 2017, 61: 117-26. doi:10.1016/j.bbi.2016.11.013 |
| [13] | Nayki U A, Nayki C, Cetin N, et al. Effect of Kineret on ovarian ischemia reperfusion injury in a rat model[J]. J Obstet Gynaecol Res, 2016, 42(11): 1525-33. doi:10.1111/jog.13095 |
| [14] | Chiu C J, McArdle A H, Brown R, et al. lntestinal mucosal lesion in low-flow states[J]. Arch Surg, 1970, 101(4): 478-83. doi:10.1001/archsurg.1970.01340280030009 |
| [15] | 刘中成, 张艳芬. IL-1ra-Fcε融合基因在大鼠体内表达条件优化及免疫原性分析[J]. 中国药理学通报, 2010, 26(5): 638-42. Liu Z C, Zhang Y F. Optimization on expression condition of IL-1ra-Fcε fusion gene in rats and its immunogenicity analysis[J]. Chin Pharmacol Bull, 2010, 26(5): 638-42. |

