


L-色氨酸是人体必需氨基酸,参与蛋白质以及一些重要生理物质代谢。最近研究发现,肿瘤细胞过度代谢色氨酸,其代谢产物犬尿氨酸可以促进肿瘤细胞生长迁移,并能抑制抗肿瘤免疫应答,且色氨酸代谢与肿瘤恶化程度及预后明显相关[1]。吲哚胺-2, 3-双加氧酶(indoleamine-2, 3-dioxygenase,IDO)是催化色氨酸生成犬尿氨酸的关键蛋白酶,且IDO对于免疫系统的调控也非常重要[2-4]。目前,已进入抗肿瘤临床试验阶段的IDO抑制剂主要包括INCB024360、NLG-919、1-MT等[5-7]。
槲皮素是一种多羟基黄酮类化合物(结构式见Fig 1),其药理作用广泛,对多种恶性肿瘤均有抑制其生长的作用[8-10]。据报道,槲皮素能够抑制LPS诱导的THP-1细胞中犬尿氨酸的产生,对IDO1有一定的抑制作用[11]。本研究从细胞水平、体外酶催化活性反应等多方面进一步确证了槲皮素对IDO1活性和色氨酸代谢的抑制作用,这可能是槲皮素抑制HeLa细胞增殖的机制之一。该研究为槲皮素抗肿瘤提供了又一理论依据,而且可以为指导临床妇科用药,特别是为更年期妇女保健及宫颈癌等肿瘤患者的用药提供参考。
|
| Fig 1 Chemical structure of quercetin |
人宫颈癌HeLa细胞、人宫颈上皮永生化H8细胞均购自ATCC。
1.2 试剂DMEM培养基、胎牛血清、胰蛋白酶(美国Gibco公司);槲皮素、3-(N-吗啉基)丙磺酸[3-(N-morpholino) propanesulfonic acid,MOPS]、抗坏血酸、L-色氨酸、过氧化氢酶、亚甲基蓝、三氯乙酸、对二甲基氨基苯甲醛、L-犬尿氨酸、免疫印迹及其他所需试剂等,均购自Sigma-Aldrich;CCK-8试剂盒、细胞周期检测试剂盒,购自碧云天生物技术公司;人IFN-γ购自北京义翘神州生物技术有限公司;抗His抗体购自Cell Signaling Technology;引物由南京金斯瑞设计合成;RNA提取、反转录试剂盒(Promega);SYBR Green mix(日本TOYOBO)。
1.3 仪器FACS CaliburTM流式细胞仪(Becton Dickinson公司),高效液相色谱仪STI-501 plus(配备N2000色谱工作站,杭州赛智公司),C1000实时荧光定量PCR系统、垂直板电泳仪(美国Bio-Rad公司),Spectra Max 250酶标仪(美国Molecular Devices公司),Flour Chem-FC2成像系统(美国Alpha Innotech)。
1.4 细胞培养HeLa细胞置于DMEM培养基(10%胎牛血清)中,于37℃、5% CO2恒温培养箱中培养。传代时,用PBS洗涤2次,胰蛋白酶消化3 min,300×g离心5 min,更换新鲜的完全培养基。
1.5 CCK-8法检测细胞增殖HeLa细胞接种于96孔板中,加入不同浓度的槲皮素,于37℃、5% CO2的恒温培养箱中培养48 h后,每孔加入10 μL CCK-8溶液,继续培养4 h,设置未处理的正常对照组以及未加CCK-8的背景空白组,酶标仪450 nm处检测其吸光值(A)。用以下公式计算细胞相对存活率:细胞相对存活率=(A处理组-A空白组)/(A对照组-A空白组)×100%。
1.6 流式细胞术检测细胞周期5×105个HeLa细胞接种于培养皿中,待细胞贴壁后,更换无血清培养基培养12 h,使细胞统一在G0期,再更换完全培养基,加入不同浓度的槲皮素,继续培养48 h。收细胞,加入预冷的体积分数为0.7的乙醇,置于冰箱4℃过夜,弃去乙醇,PBS洗2遍,加入碘化丙啶染液(0.03 g·L-1)、RNaseA(0.3 g·L-1),37℃避光30 min,流式细胞仪检测细胞周期分布。
1.7 qPCR检测IDO1基因的mRNA表达按照试剂盒说明书操作,提取HeLa细胞的总RNA,逆转录,然后用SYBR Green PCR Mix进行qPCR扩增反应。每组2个复孔,重复3次。结果以2-ΔΔCt表示实验组与对照组目的基因表达倍数关系,GAPDH作为内参基因。本项实验中用到的引物序列如下:IDO1-F:5′-AGGGTTCTGGGAAGACCCAA-3′,IDO1-R:5′-ATGTCCTCCACCAGCAGTCT-3′;GAPDH-F:5′-CATGTTCGTCATGGGTGTGAAC-3′,GAPDH-R:5′-AGTGATGGCATGGACTGTGGT-3′。
1.8 HeLa细胞IDO的诱导表达及犬尿氨酸生成测定5×103个HeLa细胞接种于96孔培养板中,向培养基中加入人IFN-γ(终浓度为0.05 ng·L-1)和不同浓度的槲皮素,处理48 h后,取上清,加入三氯乙酸,50℃孵育30 min。离心去沉淀,加入质量体积比为0.02的对二甲氨基苯甲醛(溶剂为醋酸)并混匀,用酶标仪在480 nm波长处检测吸光度。
1.9 IDO1蛋白的表达、纯化及体外催化反应系统将pCMV3-C-His-IDO1质粒转染293T细胞,48 h后收细胞裂解蛋白,免疫印迹方法检测IDO1蛋白的表达情况,并用Ni柱纯化该蛋白,考马斯亮蓝染色法检测蛋白纯化的效率。IDO1蛋白体外酶活性反应实验的体系如下:2 mmol·L-1色氨酸,20 mmol·L-1抗坏血酸,3.5 μmol·L-1亚甲蓝,0.2 ng·L-1过氧化氢酶,10 μL IDO1蛋白裂解液,溶剂为50 mmol·L-1的MOPS缓冲液(pH 6.5),37℃温箱中反应6 h。
1.10 高效液相色谱法(HPLC)检测色氨酸和犬尿氨酸含量的变化所用色谱柱是Hypersil Gold C8柱(5 μm,150 mm×4.6 mm,Thermo Fisher)。流动相是体积分数为0.09的乙腈,体积分数为0.001的乙酸和三氟乙酸。色谱柱的温度设定为25℃,流速为0.8 mL·min-1,使用紫外检测器,色氨酸的检测波长为280 nm,犬尿氨酸的检测波长为355 nm。
1.11 统计学分析统计学评估采用Student’s t test(两组比较)和One-way ANOVA(多组比较)。除非特殊说明,每个实验至少重复3次。数据用GraphPad Prism进行分析。
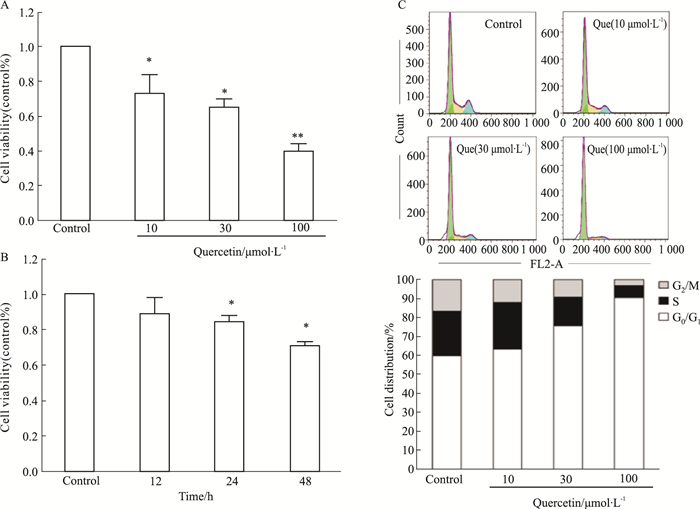
2 结果 2.1 槲皮素抑制HeLa细胞的增殖分别用不同浓度的槲皮素处理人宫颈癌HeLa细胞24 h。如Fig 2A所示,与对照组相比,槲皮素对HeLa细胞增殖具有明显的抑制作用,呈现剂量依赖效应;用10 μmol·L-1槲皮素处理HeLa细胞,随着时间的增长,其抑制效应也增强,48 h作用最明显(Fig 2B)。此外,用不同浓度的槲皮素处理HeLa细胞48 h,流式细胞仪检测槲皮素对细胞周期的影响,结果显示,与对照组相比,槲皮素作用于HeLa细胞48h后,可明显增加G0/G1期细胞的比例,抑制细胞增殖,并呈现出剂量依赖性(Fig 2C)。
|
| Fig 2 Inhibition of cell proliferation and cell cycle progression by quercetin in HeLa cells A, B:Effect of quercetin on cell viability of HeLa cells; C:Quercetin induced cell cycle arrest in HeLa cells.*P < 0.05, **P < 0.01 vs control group |
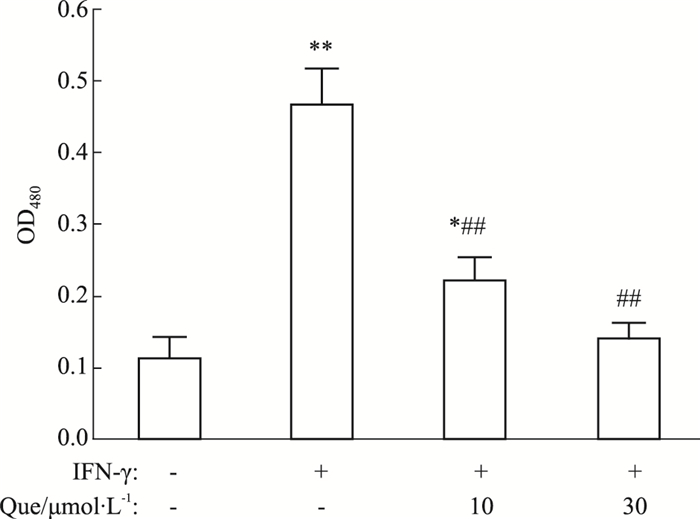
HeLa细胞等肿瘤细胞在促炎因子(如IFN-γ)的诱导下,可表达大量内源性的IDO,因而在细胞培养上清中可检测到犬尿氨酸含量的变化。值得注意的是,在HeLa细胞中IFN-γ只能诱导IDO1的表达,而不能诱导IDO2或色氨酸-2, 3-双加氧酶(tryptophan 2, 3-dioxygenaes,TDO)的表达。在HeLa细胞中加入IFN-γ和不同浓度的槲皮素,48 h后收集细胞培养上清,经检测,槲皮素能够明显抑制IFN-γ诱导的犬尿氨酸生成(Fig 3)。
|
| Fig 3 Effect of quercetin on kynurenine production Quercetin potently inhibited kynurenine production in IFN-γ treated HeLa cells. *P < 0.05, **P < 0.01 vs control group; ##P < 0.01 vs IFN-γ treatment group without quercetin |
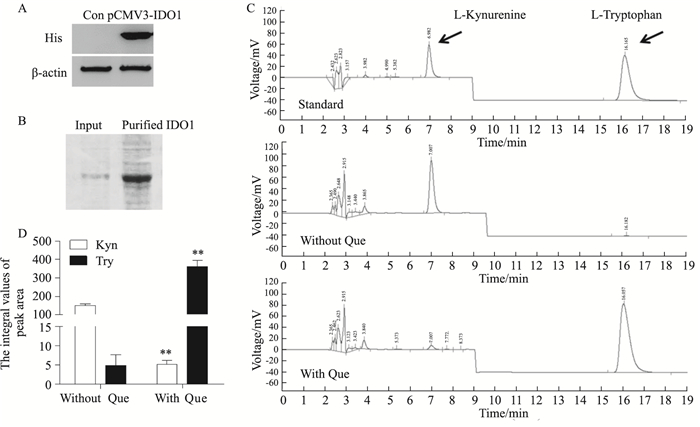
为了验证槲皮素是否抑制人IDO1蛋白的酶活性,首先在293T细胞中表达了IDO1蛋白,用Ni柱纯化得到His-IDO1蛋白,并进行体外酶催化活性实验(Fig 4A、4B)。如Fig 4C、4D所示,加入IDO1蛋白的反应体系中犬尿氨酸(保留时间为6.8 min)的含量明显增加,底物色氨酸(保留时间为16.2 min)的含量相应减少,而加入1 μmol·L-1的槲皮素的样品中,犬尿氨酸的生成受到明显抑制,体系中还存在大量的底物色氨酸未发生反应,为排除蛋白和体系反应缓冲液的影响,我们对蛋白空白和体系空白也平行地进行了HPLC检测。该结果表明,槲皮素抑制IDO1的体外酶催化活性,导致色氨酸代谢受阻以及肿瘤细胞的增殖抑制。
|
| Fig 4 Expression and catalytic activity of IDO1 in vitro A, B: The expression and purification of IDO1 protein; C: Determination of L-tryptophan and L-kynurenine by using HPLC after treatment with or without quercetin; D: Quantitative values from integrated peak area of HPLC. **P < 0.01 vs group treated without quercetin |
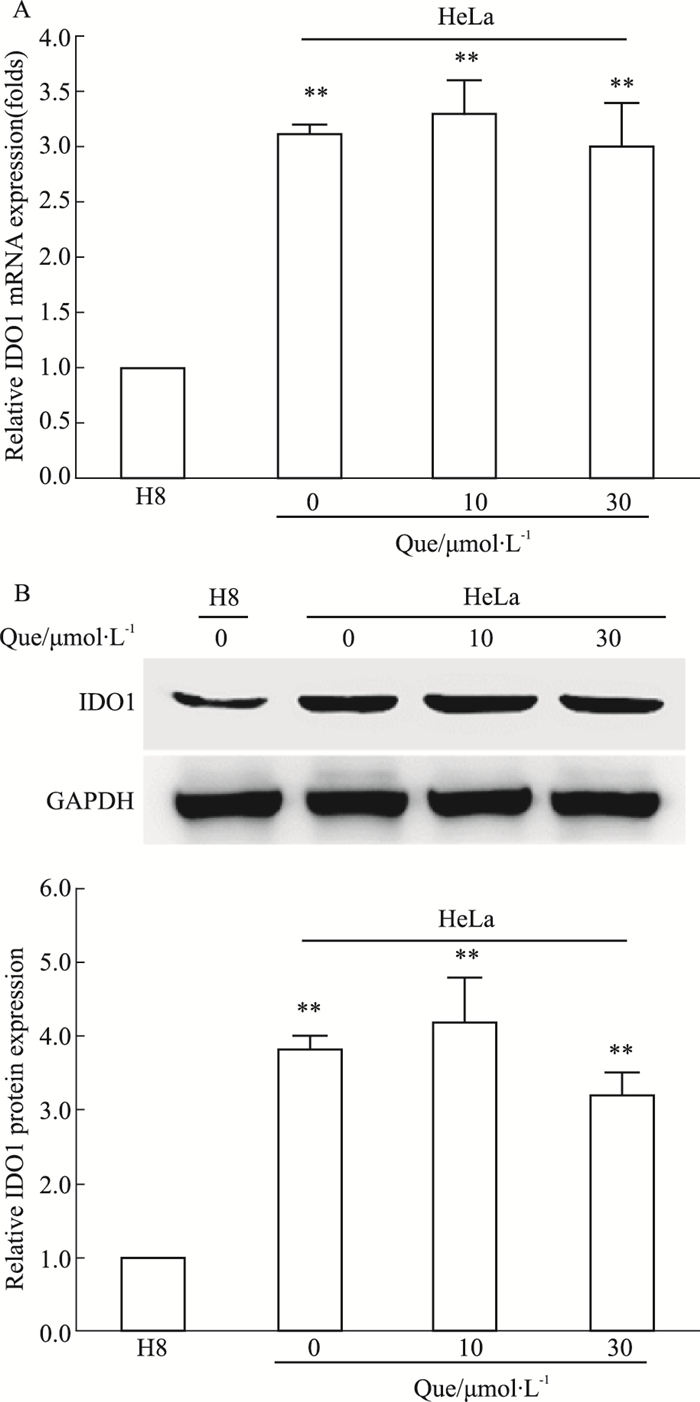
为了进一步确定槲皮素抑制HeLa细胞增殖与IDO1的酶催化活性有关,本研究检测槲皮素处理对IDO1表达的影响。如Fig 5所示,人宫颈癌HeLa细胞与正常人宫颈上皮永生化细胞相比,其IDO1的mRNA水平以及蛋白表达明显升高,这与已报道的结果相一致。多种肿瘤细胞高表达IDO1,从而异常代谢色氨酸,导致色氨酸的代谢产物犬尿氨酸大量堆积,从而促进肿瘤细胞的生成和迁移。另外,加入不同浓度的槲皮素(10、30 μmol·L-1)处理HeLa细胞24 h以后,其IDO1的转录水平和蛋白表达均无明显变化,证明槲皮素并不影响IDO1的表达。
|
| Fig 5 Effect of quercetin on IDO1 mRNA level(A) and protein expression (B) in HeLa cells **P < 0.01 vs H8 cells group |
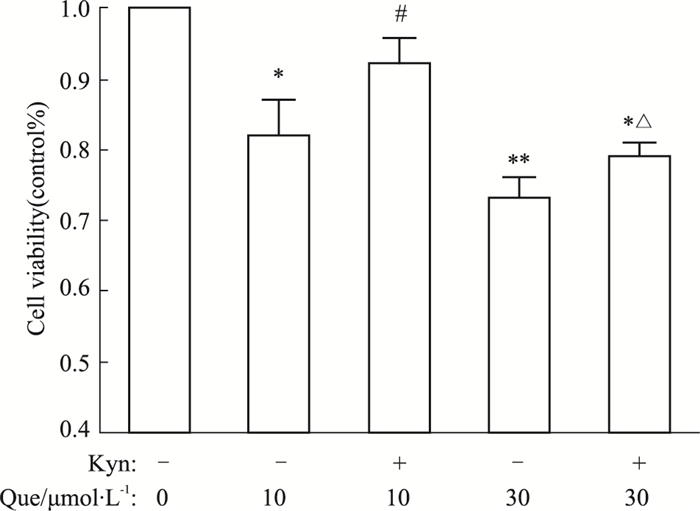
犬尿氨酸与肿瘤的发生与发展密切相关,为了进一步证明槲皮素抑制HeLa细胞的增殖与色氨酸代谢受阻有关,我们用槲皮素处理细胞的同时,外源性添加不同浓度的犬尿氨酸,观察细胞的增殖情况。如Fig 6所示,外源性添加犬尿氨酸能够明显逆转槲皮素引起的增殖抑制,一定程度上抵消了槲皮素的抗肿瘤作用。
|
| Fig 6 Addition of kynurenine reverses inhibition of cell proliferation induced by quercetin *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs quercetin (10 μmol·L-1) treatment group without kynurenine addition; △P < 0.05 vs quercetin (30 μmol·L-1) treatment group without kynurenine addition |
色氨酸是人体必需氨基酸,色氨酸摄入不足或者代谢异常可导致疾病的发生。另据报道,色氨酸代谢在肿瘤细胞中异常活跃,这与肿瘤的免疫逃逸密切相关。色氨酸在肿瘤细胞中主要通过IDO进行代谢,IDO可催化色氨酸降解生成犬尿氨酸,犬尿氨酸可以与芳香族化合物受体AHR结合,激活AHR通路,从而促进肿瘤细胞生长和迁移。这也可能是槲皮素抑制HeLa细胞增殖的更深入的分子机制,我们还在做进一步的研究。
IDO在肿瘤的发生发展中扮演了重要的角色。IDO在人类不同肿瘤中的表达均有所升高,如卵巢癌、肺癌、乳腺癌等,且IDO与肿瘤的预后也密切相关[12]。IDO不仅可催化色氨酸产生大量的犬尿氨酸,还可通过抑制抗肿瘤免疫反应,影响肿瘤的生长。临床试验证明,IDO的小分子抑制剂治疗能够恢复机体对肿瘤的排斥反应,而且可增强化疗药物的抗肿瘤效果。本研究表明,槲皮素对IDO的表达无影响,但具有明显抑制IDO酶活性的作用。
槲皮素是一种多羟基黄酮类化合物,许多中草药中都含有槲皮素,其具有多种生物学活性,如抗肿瘤、抗氧化、抗炎、保护心血管系统等[13-14]。槲皮素抗肿瘤机制复杂,如槲皮素可引起肿瘤细胞的凋亡、抑制血管生成、促进肿瘤细胞自噬等。本研究发现,槲皮素可能通过抑制IDO1的酶催化活性,从而影响细胞色氨酸的代谢,这也可能是槲皮素发挥抑制HeLa细胞增殖的作用机制之一。天然的小分子化合物是宝贵的资源,本文为槲皮素抗肿瘤提供了又一新的理论依据,同时也为免疫检查点IDO抑制剂的筛选开拓了新的思路。
| [1] | Opitz C A, Litzenburger U M, Sahm F, et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor[J]. Nature, 2011, 478(7368): 197-203. doi:10.1038/nature10491 |
| [2] | Sugimoto H, Oda S, Otsuki T, et al. Crystal structure of human indoleamine 2, 3-dioxygenase: catalytic mechanism of O2 incorporation by a heme-containing dioxygenase[J]. Proc Natl Acad Sci USA, 2006, 103(8): 2611-6. doi:10.1073/pnas.0508996103 |
| [3] | Dai W, Gupta S L. Molecular cloning, sequencing and expression of human interferon-gamma-inducible indoleamine 2, 3-dioxygenase cDNA[J]. Biochem Biophys Res Commun, 1990, 168(1): 1-8. doi:10.1016/0006-291X(90)91666-G |
| [4] | Mellor A L, Munn D H. IDO expression by dendritic cells: tolerance and tryptophan catabolism[J]. Nat Rev Immunol, 2004, 4(10): 762-74. doi:10.1038/nri1457 |
| [5] | Metz R, Rust S, Duhadaway J B, et al. IDO inhibits a tryptophan sufficiency signal that stimulates mTOR: a novel IDO effector pathway targeted by D-1-methyl-tryptophan[J]. Oncoimmunology, 2012, 1(9): 1460-8. doi:10.4161/onci.21716 |
| [6] | Seegers N, van Doornmalen A M, Uitdehaag J C, et al. High-throughput fluorescence-based screening assays for tryptophan-catabolizing enzymes[J]. J Biomol Screen, 2014, 19(9): 1266-74. doi:10.1177/1087057114536616 |
| [7] | Beatty G L, O'Dwyer P J, Clark J, et al. First-in-human phase Ⅰ study of the oral inhibitor of indoleamine 2, 3-dioxygenase-1 epacadostat (INCB024360) in patients with advanced solid malignancies[J]. Clin Cancer Res, 2017, 23(13): 3269-76. doi:10.1158/1078-0432.CCR-16-2272 |
| [8] | Zheng Y Z, Deng G, Liang Q, et al. Antioxidant activity of quercetin and its glucosides from propolis: a theoretical study[J]. Sci Rep, 2017, 7(1): 7543. doi:10.1038/s41598-017-08024-8 |
| [9] | 孙涓, 余世春. 槲皮素的研究进展[J]. 现代中药研究与实践, 2011, 25(3): 85-8. Sun J, Yu S C. Research progress of quercetin[J]. Res Pract Chin Med, 2011, 25(3): 85-8. |
| [10] | 王艳芳, 王新华, 朱宇同. 槲皮素药理作用研究进展[J]. 天然产物研究与开发, 2003, 15(2): 171-3. Wang Y F, Wang X H, Zhu Y T. Advances in pharmacological effects of quercetin[J]. Nat Prod Res Dev, 2003, 15(2): 171-3. |
| [11] | Yamamoto R, Yamamoto Y, Imai S, et al. Effects of various phytochemicals on indoleamine 2, 3-dioxygenase 1 activity: galanal is a novel, competitive inhibitor of the enzyme[J]. PLoS One, 2014, 9(2): e88789. doi:10.1371/journal.pone.0088789 |
| [12] | Smith C, Chang M Y, Parker K H, et al. IDO is a nodal pathogenic driver of lung cancer and metastasis development[J]. Cancer Discov, 2012, 2(8): 722-35. doi:10.1158/2159-8290.CD-12-0014 |
| [13] | 刘红亮, 胡磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3): 373-7. Liu H L, Hu L, Wang J K, et al. Protective effect of quercetin on the oxidative damage induced by hydrogen peroxide and mechanism in PC12 cells[J]. Chin Pharmacol Bull, 2014, 30(3): 373-7. |
| [14] | 施剑明, 殷嫦嫦, 孙维君, 等. 槲皮素联合顺铂对人骨肉瘤MG-63细胞增殖及凋亡的影响[J]. 中国药理学通报, 2014, 30(10): 1361-6. Shi J M, Yin C C, Sun W J, et al. Effect of quercetin combined with cisplatin on proliferation and apoptosis of human osteosarcoma cell line MG-63[J]. Chin Pharmacol Bull, 2014, 30(10): 1361-6. doi:10.3969/j.issn.1001-1978.2014.10.008 |

