

2. 广州中医药大学第一附属医院药学部,广东 广州 510405;
3. 广州中医药大学岭南医学研究中心,广东 广州 510405
2. Pharmaceutical Dept, the First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China;
3. Lingnan Medical Research Center, Guangzhou University of Chinese Medicine, Guangzhou 510405, China
内脏高敏感性是腹泻型肠易激综合征(irritable bowel syndrome with diarrhea, IBS-D)的主要病理特征,具体机制涉及神经、内分泌、免疫等多个系统,但确切机制至今尚无定论。近年来研究发现,干细胞因子/酪氨酸激酶受体(stem cell factor-C-kit,SCF/C-kit)系统在疼痛感知、胃肠动力紊乱和免疫炎症异常激活中均有重要作用,可能与IBS-D内脏高敏感性有关[1],但相关报道目前尚不充分。已知免疫系统作为IBS-D精神-肠道因素互动的关键纽带,其平衡对IBS-D内脏敏感性有重要影响。本研究通过观察SCF/C-kit系统在IBS-D中的变化及其与IBS-D免疫功能紊乱的关系,旨在进一步探索IBS-D内脏高敏感发生的机制。
1 材料 1.1 实验动物新生SD大鼠窝鼠,SPF级,购于广州中医药大学实验动物中心,动物合格证号SCXK(粤):2013-0034。饲养员协助剔除♀乳鼠,得♂乳鼠,与哺乳母鼠同窝饲养。哺乳母鼠自由进食与饮水,饲养环境温度18℃~24℃,相对湿度50%~70%。
1.2 试剂总RNA提取试剂盒(批号AK501)、逆转录试剂盒(批号AK3101)、SYBR染料(批号AK6004),均购自日本TaKaRa公司;引物(Invitrogen公司);SCF一抗(Abcam,批号:AB101072);C-kit一抗(Thermofisher,批号:PA5-16770);二抗试剂盒(北京博奥森,批号SP0023);EDTA抗原修复液(福州迈新,批号:MVS-009810099);DAB显色液(康为世纪,批号CW0125)。
1.3 仪器荧光定量PCR仪器(美国Bio Rad,型号CFX96);多功能酶标仪(Thermo公司,型号1510);倒置显微镜(OLYMPUS公司,型号TH4-200)。
2.1 动物模型的制备及评估按照文献方法,采用三因素法(母婴分离、醋酸刺激、束缚应激)制备肝郁脾虚IBS-D大鼠模型[2]。造模结束后,参照文献用腹部回缩反射(abdominal withdrawal reflex,AWR)方法进行模型的评估:将10F双腔导尿管涂抹润滑油后,小心插入大鼠肛门8 cm(预实验确定),用胶带绑好,放入自制的玻璃盒中,任其自由活动,适应环境。等大鼠安静后,用注射器向管腔内分别注入0.5、1、1.5 mL水,经预实验评估后,选用1.5 mL作为正式实验注水量,观察大鼠5 min内的活动情况(Fig 1),并进行内脏敏感性评分。
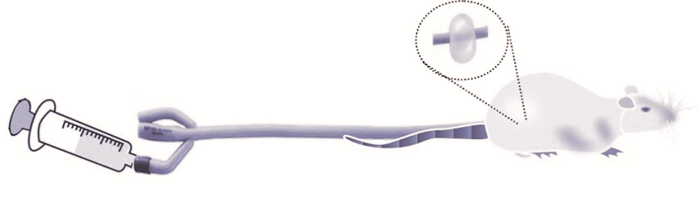
|
| Fig 1 Valuation of visceral sensitivity by abdominal withdrawal reflex |
评估结束后,按照0.4 g ·kg-1剂量腹腔注射水合氯醛麻醉大鼠。腹主动脉采血,离心后取上层血清,-80℃保存;迅速截取远端结肠2 cm,分成两份,分别用于免疫组化和PCR检测。
2.3 免疫组化法观察结肠SCF及C-kit的原位表达各组取白片6张,烤片20 min; 二甲苯(To生物制片透明剂代替),10 min×2次; 梯度乙醇脱蜡至水; 置于H2O2室温20 min; 枸橼酸修复后加5% BSA封闭液,室温20 min; 滴加一抗,37℃ 1 h; PBS洗后滴加二抗,室温20 mim; PBS 2 min×3次; 滴加SABC,室温20 mim; PBS洗后DAB显色,显色4~8 min后自来水洗; 无水乙醇梯度脱水后风机吹干,封片。显微镜下观察,呈现棕色者为阳性表达,无着色则为阴性表达。
2.4 qPCR法检测结肠中SCF、C-kit mRNA的表达称取100 mg结肠组织,加液氮研成细粉。加入TaKaRa Mini BEST Universal Genomic RNA Extraction Kit裂解液充分裂解,用70%乙醇沉淀,后转入RNA吸附柱,12 000 r·min-1,离心1 min,用试剂盒中洗液充分洗涤柱子后,用无RNA酶水洗脱RNA。用微量核酸测定仪检测吸光度值,以260 nm/280 nm比值在1.8~2.2为标准,控制RNA的纯度,用琼脂糖横向电泳检测总RNA的完整性。逆转录成cDNA,引物序列见Tab 1。采用以下逆转录体系:37℃ 15 min,85℃ 5 s。扩增反应:95℃ 30 s; 95℃ 5 s,60℃ 30 s,40个循环。扩增结果用CT值表示,以β-actin为内参照,通过2-△△CT法计算相对表达量。
| Gene | Primer sequence(5' to 3') | Gene bank number | |
| C-kit | Forward | TGGATCAGCAAATGTCACAACAAC | NM-022264 |
| Reverse | TAGGCCTCGAACTCAACAACCA | ||
| SCF | Forward | TGACCTCGTGGCATGTATGGA | NM-021843.4 |
| Reverse | ACTAGTGTCAGATGCCACCATGAAG | ||
| p-actin | Forward | CCCATCTAT GAGGGT TACGC | NM-031144.3 |
| Reverse | TTT AAT GTC ACG CAC GAT TTC |
实验结束后,分离胸腺、脾脏,计算胸腺系数和脾系数,双抗体夹心ELISA法检测血清中TNF-α、IL-8、IL-10的表达[3]。分析SCF、C-kit与免疫指标的相关性,用单样本K-S检验分析各指标数据的正态性; 对于符合双变量正态分布的数据资料,采用积矩相关系数(Pearson相关系数); 对于非双变量正态分布的数据资料,选用等级相关系数(Spearman相关系数)。
2.6 统计学方法采用SPSS 20.0软件进行数据处理和分析,计量资料数据均以x±s表示。两组间比较,采用独立样本t检验; 方差齐时,整体组间均数比较采用方差分析,进一步多重比较采用LSD法; 方差不齐时,采用非参数检验中多个独立样本的秩和检验(采用Kruskal-Wallis法)。
3 结果 3.1 SCF及C-kit的原位表达显微镜下观察结肠中SCF和C-kit蛋白表达,呈现棕色者为阳性表达,无着色则为阴性表达。Fig 2、3结果表明,SCF和C-kit蛋白在肌层、黏膜层、黏膜下层均有不同程度的表达。与正常组相比,模型组大鼠肠道肌层、黏膜层SCF和C-kit蛋白的阳性表达减弱。每张切片取5个区域拍照,随机选取1张应用IPP6.0病理图像分析软件测定免疫阳性产物的光密度值(OD值),作为该样本的OD值。Tab 2结果表明,与正常组相比,模型组的SCF和C-kit的蛋白表达量均明显下降(P < 0.01)。
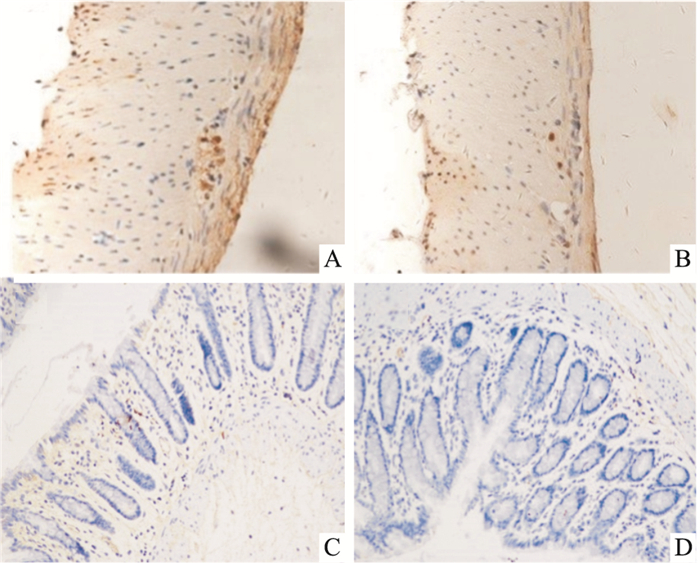
|
| Fig 2 In situ expression of SCF in rat colon(×200) A: Muscular layer in normal rat; B: Muscular layer in model rat; C: Mucous layer in normal rat; D: Mucous layer in model rat |
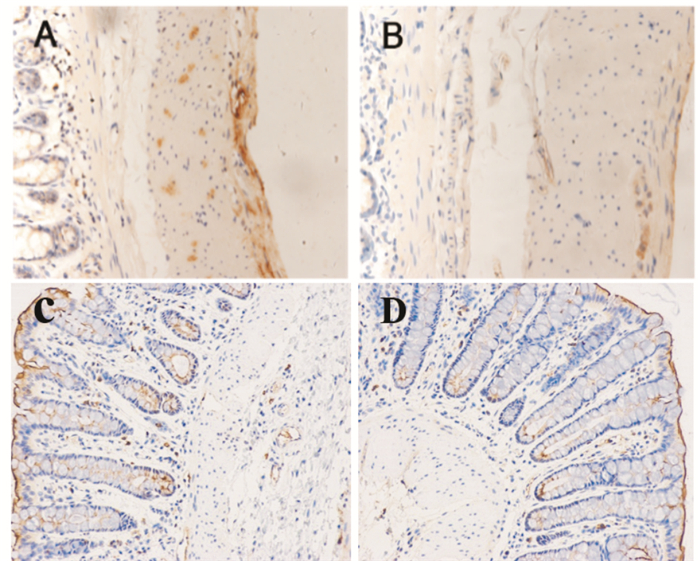
|
| Fig 3 In situ expression of C-kit in rat colon (×200) A: Muscular layer in normal rat; B: Muscular layer in model rat; C: Mucous layer in normal rat; D: Mucous layer in model rat |
| Group | SCF | C-kit |
| Normal | 0.29±0.02 | 0.34±0.06 |
| Model | 0.18±0.01## | 0.27±0.04# |
| #P < 0.05, ##P < 0.01 vs normal | ||
Fig 4结果表明,与正常组相比,肠道SCF和C-kit的mRNA表达量均明显降低(P < 0.01)。
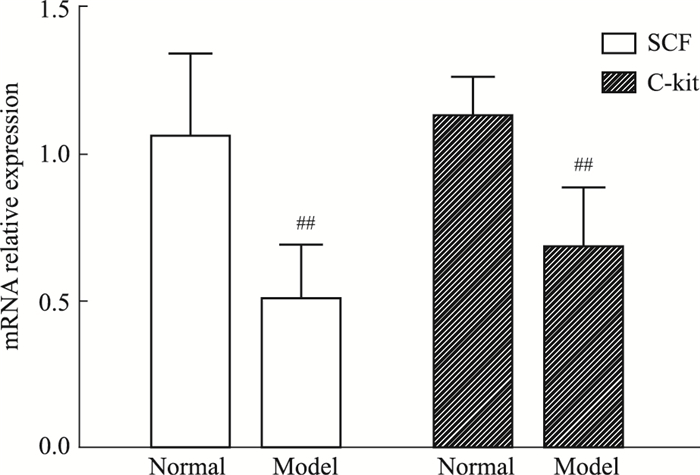
|
| Fig 4 Relative expressions of SCF and C-kit mRNA in rat colon ##P < 0.01 vs normal |
IBS-D大鼠与正常组相比,胸腺系数、脾系数、TNF-α、IL-8、IL-10的表达数据另文发表[3]。如Tab 3所示,SCF的表达与脾系数呈负相关(P < 0.01),与TNF-α、IL-8呈负相关(P < 0.01,P < 0.05),与IL-10呈正相关(P < 0.05);C-kit的表达与胸腺系数和脾系数呈负相关(P < 0.01),C-kit的表达与TNF-α呈负相关(P < 0.05)。
| Pearson correlation coefficient | ||
| SCF | C-kit | |
| Thymus index | -0.310 | -0.430** |
| Spleen index | -0.452** | -0.477** |
| TNF-α | -0.474** | -0.423* |
| IL-8 | -0.344* | -0.210 |
| IL-10 | 0.333* | 0.282 |
| *P < 0.05, **P < 0.01 | ||
SCF/C-kit是人类多种细胞生长、发育、分化和凋亡的重要调控系统。C-kit受体是由原癌基因C-kit编码的一种具有酪氨酸激酶活性的跨膜蛋白,是肠道Cajal间质细胞(intestinal Cajal interstitial cell,ICC)的特异性识别因子。SCF是C-kit的配体因子,同时又是肥大细胞生长的重要因子,在调控各系造血细胞的生长发育中起着重要作用。SCF作用的发挥需要依赖其与C-kit的结合。SCF/C-kit的下游信号传导通路主要包括Ras/ERK通路、PI3K通路、PLC-γ通路、Src激酶通路及JAK/STAT通路,这些均为机体的重要通路,其具体机制复杂。
ICC、肥大细胞(mast cell,MC)、神经细胞及上皮细胞形成的网络系统是IBS-D神经-内分泌-免疫系统的细胞学基础。SCF与C-kit结合后形成二聚体复合物,引起细胞膜内酪氨酸残基的磷酸化及下游信号变化,从而对多种细胞的分裂、增殖产生影响,如ICC、MC、神经细胞等[1, 4]。
ICC是引起IBS肠道高敏感性和动力紊乱的起搏细胞,在IBS的发病中有重要作用[5]。研究认为,与ICC膜表面的P物质、5-HT等受体相关[6-7],它们均参与IBS内脏高敏感的发生。SCF调控肥大细胞的生存、黏附、脱颗粒、介质释放,发挥炎症调节功能[8]。作为MC趋化因子,SCF能够促进它们从CD34+祖细胞中再生; 在体外,SCF能够诱导MC的生存和细胞外基质的黏附,SCF/C-kit系统受到抑制会导致体内组胺水平的明显下降,从而减轻肠道黏膜的损伤及降低对痛觉的敏感性。而通过C-kit抗体干预SCF/C-kit通路能够减缓MC的分化,进而缓解炎症。SCF/C-kit被认为是炎症发生时控制MC的潜在作用靶点之一[8-9]。SCF/C-kit系统不仅具有维持神经嵴细胞存活、增殖、营养的作用,并且能够诱导神经嵴向感觉神经元的分化。C-kit主要存在于有丝分裂后的神经细胞中,这些细胞处于向神经元和神经胶质细胞谱系分化的早期阶段。SCF则沿基板分布于丘脑和嗅上皮,提示这一配基-受体系统参与了发育中脑背-腹侧的形成。研究表明SCF能够刺激神经再生,且和机体的精神状态相关[10],提示干预SCF极有可能影响神经功能传输,进而影响到疼痛感知。近年来研究发现,SCF/C-kit信号对肠道上皮屏细胞的生物学功能也有调节作用,能够促进上皮(intestinal epithelial cell,IECs)细胞向纤维蛋白黏附[11],从而加强屏障功能。
SCF/C-kit信号在肠道动力、内脏感知、过敏及免疫中的作用均有报道,但是在IBS-D中的报道较为少见。国内有报道,内脏高敏感性大鼠肠道肌层ICC升高[12-13],结合本研究中模型组的IBS-D大鼠SCF/C-kit降低的实验结果,我们推测,由于SCF/C-kit在肌层、黏膜固有层及上皮层等广泛存在,某局部位置ICC的变化可能不能够完全反映SCF/C-kit信号的变化。本研究所采用标本是结肠的整体组织标本,即对肌层、黏膜层等的整体影响,提示SCF/C-kit信号的变化在不同的部位如黏膜固有层、上皮层等可能有差异。另外本实验采用的造模方法是三因素结合的方法制备IBD-D大鼠模型,模型制备方法也可能是SCF/C-kit信号变化的影响因素。
我们前期研究表明,三因素法制备的IBS-D大鼠出现免疫系统异常[3],包括胸腺系数、IL-10降低,TNF-α以及IL-8的表达升高。本研究进一步通过相关性分析表明,这些免疫指标的异常与SCF/C-kit有关,进一步阐释了IBS-D内脏高敏感发生的机制。
SCF/C-kit系统影响范围较广,机制相对复杂,其对多种靶细胞分别有怎样的调控途径,也还有待进一步深入研究。目前,该信号在IBS-D中的研究尚多限于ICC范畴,深入探讨其多层面的变化,对于探索IBS-D内脏高敏感的发生有实际意义。
( 致谢: 本实验在广州中医药大学国家重点学科实验室和郑州大学第一附属医院临床药学(免疫)实验室共同完成,感谢参与实验的老师和同学。)
| [1] | Chai Y, Huang Y, Tang H, et al. Role of stem cell growth factor/c-Kit in the pathogenesis of irritable bowel syndrome[J]. Exp Ther Med, 2017, 13(4): 1187-93. doi:10.3892/etm.2017.4133 |
| [2] | 唐洪梅, 房财富, 廖小红, 等. 神经肽Y和5-羟色胺在腹泻型肠易激综合征模型大鼠中表达的研究[J]. 中国药理学通报, 2012, 28(7): 916-20. Tang H M, Fang C F, Liao X H, et al. Expression of NPY and 5-HT in rat model of diarrhea-predominant irritable bowel syndrome[J]. Chin Pharmacol Bull, 2012, 28(7): 916-20. |
| [3] | 柴玉娜, 黄育生, 唐洪梅, 等. 疏肝健脾法肠激安方对IBS-D大鼠免疫功能的影响[J]. 中国实验方剂学杂志, 2016, 22(21): 93-8. Chai Y N, Huang Y S, Tang H M, et al. Effect of Shugan Jianpi method (Changji'an fomulation) on IBS-D immune function[J]. Chin J Exp Tradit Med Formulae, 2016, 22(21): 93-8. |
| [4] | Liang J, Wu Y L, Chen B J, et al. The C-kit receptor-mediated signal transduction and tumor-related diseases[J]. Int J Biol Sci, 2013, 9(5): 435-43. doi:10.7150/ijbs.6087 |
| [5] | Eshraghian A, Eshraghian H. Interstitial cells of Cajal: a novel hypothesis for the pathophysiology of irritable bowel syndrome[J]. Can J Gastroenterol, 2011, 25(5): 277-9. doi:10.1155/2011/478370 |
| [6] | Ward S M, Sanders K M, Hirst G D. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles[J]. Neurogastroenterol Motil, 2004, 16(Suppl 1): 112-7. |
| [7] | Kim M W, Jiao H Y, Kim S W, et al. Prostanoid EP3 receptor agonist sulprostone enhances pacemaker activity of colonic interstitial cells of Cajal[J]. Naunyn Schmiedebergs Arch Pharmacol, 2017. |
| [8] | Al-Azzam N, Kondeti V, Duah E, et al. Modulation of mast cell proliferative and inflammatory responses by leukotriene d4 and stem cell factor signaling interactions[J]. J Cell Physiol, 2015, 230(3): 595-602. doi:10.1002/jcp.24777 |
| [9] | Cho K A, Park M, Kim Y H, et al. Th17 cell-mediated immune responses promote mast cell proliferation by triggering stem cell factor in keratinocytes[J]. Biochem Biophys Res Commun, 2017, 487(4): 856-61. doi:10.1016/j.bbrc.2017.04.141 |
| [10] | Benedetti F, Poletti S, Hoogenboezem T A, et al. Stem cell factor (SCF) is a putative biomarker of antidepressant response[J]. J Neuroimmune Pharmacol, 2016, 11(2): 248-58. doi:10.1007/s11481-016-9672-y |
| [11] | Jeong W, Jung S, Bazer F W, et al. Stem cell factor-induced AKT cell signaling pathway: effects on porcine trophectoderm and uterine luminal epithelial cells[J]. Gen Comp Endocrinol, 2017, 250: 113-21. doi:10.1016/j.ygcen.2017.05.015 |
| [12] | 潘锋, 张涛, 陈建永. 痛泻要方对腹泻型肠易激综合征Cajal间质细胞影响的研究[J]. 中华中医药学刊, 2009, 27(6): 1272-3. Pan F, Zhang T, Chen J Y. The effect of TongxieYaofang decoction on Cajal cells in a rat model of D-IBS[J]. Chin Archives Tradit Chin Med, 2009, 27(6): 1272-3. |
| [13] | 丁瑞峰, 王爱鱼, 王宏杰, 等. 内脏高敏感大鼠结肠Cajal间质细胞C-KIT表达增加[J]. 基础医学与临床, 2012, 32(5): 566-9. Ding R F, Wang A Y, Wang H J, et al. Increased expression of C-KIT in ICC in colon of rats with visceral hypersensitivity[J]. Basic Clin Med, 2012, 32(5): 566-9. |

