


非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)是目前世界上广泛流行的一种慢性疾病,其发病过程可由早期阶段的单纯性脂肪肝逐渐发展到非酒精性肝炎(nonalcoholic steatohepatitis, NASH),甚至肝纤维化和肝硬化等严重病症。根据NAFLD形成机制的“二次打击”学说,肝细胞内甘油三酯(triglyceride, TG)过度沉积是“第一次打击”,导致单纯性脂肪肝的发生;随之,氧化应激和炎症因子上演“第二次打击”,促使NASH的发展[1]。可见,在无“第二次打击”的情况下,单纯性脂肪肝不一定会转化成NASH,其临床表现为肝脏单纯性脂肪变性,是预防NAFLD发生和发展的最佳时期。鉴于膳食疗法的预防和早期治疗原则以及无毒副作用等优点,寻求新的食疗方法,以预防肝脂肪变性及防止其向NASH的转化成为食品营养学领域的研究热点。因而,首先要建立一种方便、实用的单纯性肝脂肪变性模型。目前,细胞模型由于实验条件可控、影响因素少而被广泛用于NAFLD的体外研究[2],但大部分研究采用的细胞模型并非单纯性肝脂肪变性模型,如Yin等[3]和Xie等[4]的研究分别以一定浓度游离脂肪酸诱导L02或HepG2细胞脂肪变性,在TG蓄积的同时,谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)等指标亦明显变化,引起细胞氧化应激损伤。因此,本研究拟采用油酸诱导HepG2建立单纯性肝脂肪变性细胞模型,并利用该细胞模型,评价黄酮类化合物预防肝脂肪变性的作用,旨在建立一种早期NAFLD的细胞模型,并应用于膳食营养或食品功能因子等活性物质预防NAFLD的体外研究。
1 材料与方法 1.1 材料 1.1.1 细胞人肝癌细胞HepG2由中国科学院干细胞库提供。
1.1.2 试剂与仪器MEM培养液、胎牛血清、非必需氨基酸溶液,购自美国Thermo Fisher公司;油酸(oleic acid,OA)、牛血清白蛋白(bull serum albumin, BSA)、油红O、尼罗红染料,购自美国Sigma公司;MTT细胞增殖-毒性检测、ALT、AST、MDA、SOD测定试剂盒,购自南京建成生物工程研究所;TG酶法检测试剂盒、BCA蛋白测定试剂盒,购自北京普利莱技术有限公司。荧光倒置相差显微镜购自德国Leica公司;Infinite M200pro荧光酶标仪购自瑞士Tecan公司。
1.2 方法 1.2.1 细胞培养HepG2细胞用含10%胎牛血清、1%非必需氨基酸和抗生素的MEM培养液培养于T25细胞培养瓶中,置于37℃、5%的CO2培养箱中培养,观察并记录细胞的生长状态。待细胞汇合度达到80%~90%时,用1 mL 0.25%胰酶-EDTA消化细胞,1:3传代。取对数生长期的HepG2细胞进行实验。
1.2.2 细胞存活率的测定取对数生长期的HepG2细胞以5×108·L-1,每孔100 μL接种于96孔细胞培养板,待细胞完全贴壁后,加入不同浓度的油酸(以异丙醇作溶剂[5]),每个浓度设置6个复孔。培养24、48 h后,按照MTT法检测试剂盒的说明书测定各组细胞活力,筛选油酸的安全浓度范围。以酶标仪测定570 nm处吸光度值A,计算细胞存活率/%=[(A实验组-A空白组)/(A对照组-A空白组)]×100%
1.2.3 油酸诱导肝细胞脂肪变性取对数生长期的HepG2细胞以5×108·L-1,每孔2 mL接种于6孔细胞培养板,待细胞汇合至70%~80%时,弃去旧的培养液,用含1% BSA的无血清MEM培养基饥饿处理16 h后,加入不同浓度的油酸(“1.2.2”确定的安全浓度范围内),每个浓度重复3次,培养24 h。
1.2.4 单纯性肝脂肪变性细胞模型的鉴定 1.2.4.1 细胞内脂滴染色观察细胞按“1.2.3”方法做相应处理后,弃去培养液,用PBS清洗3次,冰冻的4%多聚甲醛固定10 min,分别采用油红O染色法[3]和尼罗红染色法[5]进行染色,荧光显微镜下观察、拍照。
1.2.4.2 TG、ALT、AST、MDA和SOD的测定细胞按“1.2.3”方法做相应处理后,收集培养液和细胞。培养液1 000 r·min-1离心5 min,取上清,以试剂盒测定ALT、AST的含量;加入细胞裂解液裂解细胞,2 000 r·min-1离心5 min,取上清,以试剂盒测定TG、MDA、SOD浓度,并以BCA法测定蛋白浓度,分别以每克细胞蛋白中所含的量来表示。
1.2.5 模型的应用选取“1.2.4”确定的最佳油酸浓度,按“1.2.3”所述的方法建立单纯性肝细胞脂肪变性模型。设置正常对照组、油酸模型组和油酸+不同浓度药物的实验组(槲皮素或表儿茶素),每组重复3次。处理完成后收集细胞,以试剂盒测定细胞内TG的变化。
1.3 统计学分析数据以x±s表示,采用SPSS18.0统计软件进行数据处理和分析。多组间的比较采用单因素方差分析,两组间的比较采用t检验。
2 结果 2.1 油酸对HepG2细胞活力的影响由Fig 1可知,相比于未加油酸的正常对照组,油酸浓度为0.8 mmol·L-1时,诱导24 h能明显降低HepG2细胞活力(P<0.05),且当油酸浓度达到1.0 mmol·L-1时,存活细胞量明显减少,仅为79%(P<0.01);诱导48 h,油酸对HepG2细胞活力的影响更大,其浓度为0.6 mmol·L-1时,HepG2细胞活力已明显降低至正常对照组的90%(P<0.05)。由此可见,油酸浓度和诱导时间对HepG2细胞活力均有一定影响。油酸浓度≤0.6 mmol·L-1,孵育24 h时,对HepG2细胞活力无明显影响。

|
| Fig 1 Effect of oleic acid on HepG2 cell viability *P < 0.05, **P < 0.01 vs control group |
从Fig 2A可看出,对比2种脂质染色方法,均能很好地呈现油酸负荷下HepG2细胞内脂肪沉积的特征。随着油酸浓度的增加,细胞内红色脂滴越来越多,脂滴主要分布在细胞质内靠近细胞膜的部位,当其浓度达到0.4 mmol·L-1时,在靠近细胞膜的区域聚集大量的红色脂滴且连成片状。细胞内TG含量的测定结果与染色观察结果一致(Fig 2B),随着油酸浓度的增加,细胞内TG逐渐上升,呈剂量效应关系。油酸浓度为0.1 mmol·L-1时,细胞内TG含量比正常对照组中TG含量高出64%;当油酸浓度增加到0.4 mmol·L-1时,细胞内TG含量已达到正常对照组的3.5倍。表明油酸浓度为0.4 mmol·L-1时能明显导致HepG2细胞内脂肪沉积。

|
| Fig 2 Effect of oleic acid on lipid accumulation in HepG2 cells A:Oil red O staining and Nile red staining(×400); B:Intracellular TG content.*P < 0.05, **P < 0.01 vs control group |
由Fig 3A可知,相比于正常对照组,浓度≤0.4 mmol·L-1的油酸诱导24 h后,ALT和AST水平无明显增加,当浓度达到0.6 mmol·L-1时,ALT水平明显升高(P<0.05)。由Fig 3B、3C可知,相比于正常对照组,浓度≤0.4 mmol·L-1的油酸组细胞内MDA和SOD含量亦无明显变化,而0.6 mmol·L-1油酸组细胞内MDA水平明显增加(P<0.05),SOD活性明显降低(P<0.05),表明高浓度油酸可引发HepG2细胞氧化应激反应,导致细胞氧化损伤,甚至死亡。
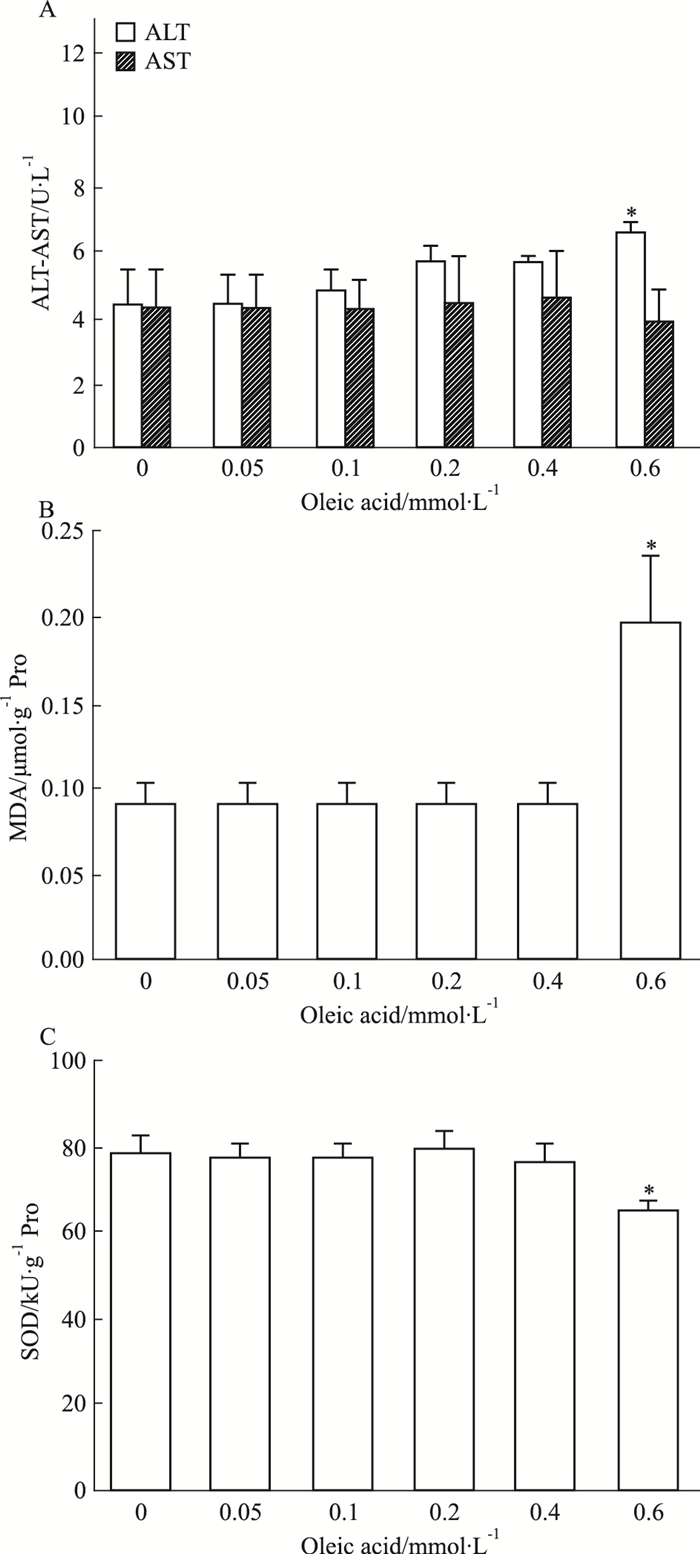
|
| Fig 3 Effect of oleic acid on transaminase activities and oxidative injury in HepG2 cells A: ALT and AST activity in cell culture medium; B:Intracellular MDA content; C: SOD activity. *P < 0.05 vs control group |
上述结果表明,油酸浓度为0.4 mmol·L-1时,细胞内聚集的甘油三酯明显增加,且此浓度未引起细胞氧化应激损伤。因此,以0.4 mmol·L-1的油酸诱导HepG2细胞24 h可成功建立单纯性肝脂肪变性细胞模型。
2.3 黄酮类化合物对HepG2细胞内脂质聚集的影响以0.4 mmol·L-1油酸诱导HepG2细胞建立单纯性肝细胞脂肪变性模型,在加入油酸的同时,给予不同浓度槲皮素或表儿茶素干预24 h,检测各组细胞内TG的变化。结果如Fig 4所示,各浓度槲皮素和表儿茶素均能明显降低细胞内TG含量(P<0.05),其中20 μmol·L-1时抑制效果最好,与油酸模型组相比,表儿茶素的抑制率为24%,槲皮素的抑制率达到45%。表明黄酮类化合物对单纯性肝细胞脂肪变性具有良好的改善作用。

|
| Fig 4 Inhibitory effects of flavonoids on lipid accumulation in HepG2 cells **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs OA model group |
建立肝脂肪变性细胞模型的关键在于选择合适的细胞和诱导剂。大量研究发现,以油酸或软脂酸诱导HepG2细胞脂肪变性是一种较合适的体外研究NAFLD模型,而其中关于单纯性肝脂肪变性细胞模型的研究报道较少[2]。单纯性脂肪变性的特征是细胞内TG蓄积,但无明显氧化应激损伤,通常以肝酶ALT、AST以及MDA、SOD等脂质过氧化指标来判断是否造成肝损伤[6]。而刘江等[7]仅通过模型组和正常组细胞内MDA无明显差异,则认为所建模型是单纯脂肪变性。殷锦锦等[8]通过细胞培养液中MDA变化来判断模型是否存在脂质过氧化,这些研究均不能完全说明建立的模型是单纯性脂肪变性模型。此外,有研究发现,不同游离脂肪酸诱导肝细胞脂肪变性时,软脂酸更易造成细胞急性脂毒性,而油酸更易被细胞吸收而引起TG蓄积,这说明油酸比软脂酸更适合用于建立单纯性肝脂肪变性细胞模型[9]。
本研究发现,以0.4 mmol·L-1油酸诱导HepG2细胞24 h后,细胞内TG含量明显增加,表明脂肪变性细胞模型造模成功。同时测定发现,该模型组细胞培养液中ALT和AST水平无明显增加,表明该模型无明显的肝损伤;且细胞内MDA和SOD含量无明显变化,表明该模型不会导致脂质过氧化,符合单纯性脂肪变性模型的特征。Cui等[10]的研究发现,油酸浓度不超过0.4 mmol·L-1时细胞活力无明显影响,且细胞内TG含量呈剂量依赖增加,这与本研究结果一致。Liu等[11]的研究以1 mmol·L-1油酸诱导HepG2细胞24 h建立了单纯性脂肪变性模型,这可能是由于油酸溶解的方法不同,此方法先用BSA乳化油酸,再使其溶解于培养液中,而油酸必须与BSA分离后才能被细胞吸收,导致其有效浓度降低。这提示本研究的方法简单方便,更具可行性。
为了进一步确定该细胞模型适用于天然活性物质预防NAFLD的体外研究,本研究选用槲皮素和表儿茶素来评价黄酮类化合物对肝细胞脂肪变性的改善作用。槲皮素和表儿茶素是水果和蔬菜中常见的2种黄酮类化合物,研究表明其具有良好的降脂活性。本研究结果显示,槲皮素和表儿茶素均能明显抑制细胞内TG聚集,表明该细胞模型应用于植物活性物质预防NAFLD的体外研究是可行的[12]。此外,Zhang等[13]研究认为,槲皮素等黄酮类化合物抑制油酸负荷的肝细胞内TG聚集作用与其细胞内抗氧化活性密切相关。但在本研究模型中,HepG2细胞内并无明显的氧化应激反应,推测槲皮素和表儿茶素等天然活性物质抑制该模型细胞内TG聚集作用可能是通过调节脂肪酸吸收、甘油三酯合成和分解相关基因的表达而实现[14-15]。
| [1] | Hassan K, Bhalla V, El Regal M E, et al. Nonalcoholic fatty liver disease:a comprehensive review of a growing epidemic[J]. World J Gastroenterol, 2014, 20(34): 12082-101. doi:10.3748/wjg.v20.i34.12082 |
| [2] | Willebrords J, Pereira I V, Maes M, et al. Strategies, models and biomarkers in experimental non-alcoholic fatty liver disease research[J]. Prog Lipid Res, 2015, 59: 106-25. doi:10.1016/j.plipres.2015.05.002 |
| [3] | Yin J, Luo Y, Deng H, et al. Hugan Qingzhi medication ameliorates hepatic steatosis by activating AMPK and PPARα pathways in L02 cells and HepG2 cells[J]. J Ethnopharmacol, 2014, 154(1): 229-39. doi:10.1016/j.jep.2014.04.011 |
| [4] | Xie C, Chen Z, Zhang C, et al. Dihydromyricetin ameliorates oleic acid-induced lipid accumulation in L02 and HepG2 cells by inhibiting lipogenesis and oxidative stress[J]. Life Sci, 2016, 157: 131-9. doi:10.1016/j.lfs.2016.06.001 |
| [5] | Malhi H, Bronk S F, Werneburg N W, et al. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis[J]. J Biol Chem, 2006, 281(17): 12093-101. doi:10.1074/jbc.M510660200 |
| [6] | Ucar F, Sezer S, Erdogan S, et al. The relationship between oxidative stress and nonalcoholic fatty liver disease:its effects on the development of nonalcoholic steatohepatitis[J]. Redox Rep, 2013, 18(4): 127-33. doi:10.1179/1351000213Y.0000000050 |
| [7] | 刘江, 厉有名, 陈韶华, 等. 一种实用的体外非酒精性脂肪肝细胞模型[J]. 浙江大学学报(医学版), 2009, 38(6): 626-9. Liu J, Li Y M, Chen S H, et al. An in vitro hepatic steatosis cell model for study of non-alcoholic fatty liver disease[J]. J Zhejiang Univ(Med Sci), 2009, 38(6): 626-9. |
| [8] | 殷锦锦, 唐外姣, 曾璐, 等. 人肝细胞系L-02细胞单纯肝脂肪变性细胞模型的建立与应用[J]. 南方医科大学学报, 2014, 34(6): 837-42. Yin J J, Tang W J, Zeng L, et al. Establishment of a L-02 cell model of hepatic steatosis[J]. J South Med Univ, 2014, 34(6): 837-42. |
| [9] | Niklas J, Bonin A, Mangin S, et al. Central energy metabolism remains robust in acute steatotic hepatocytes challenged by a high free fatty acid load[J]. BMB Rep, 2012, 45(7): 396-401. doi:10.5483/BMBRep.2012.45.7.070 |
| [10] | Cui W, Chen S L, Hu K Q. Quantification and mechanisms of oleic acid-induced steatosis in HepG2 cells[J]. Am J Transl Res, 2010, 2(1): 95-104. |
| [11] | Liu Y, Wang D, Zhang D, et al. Inhibitory effect of blueberry polyphenolic compounds on oleic acid-induced hepatic steatosis in vitro[J]. J Agric Food Chem, 2011, 59(22): 12254-63. doi:10.1021/jf203136j |
| [12] | 王俊杰, 龙婷, 曹欣, 等. 荷叶黄酮对油酸孵育的HepG2细胞甘油三酯代谢的影响[J]. 中国药理学通报, 2010, 26(12): 1626-30. Wang J J, Long T, Cao X, et al. The influence of flavonoids extracted from lotus on the triglyceride metabolism of HepG2 cells incubated in oleic acid[J]. Chin Pharmacol Bull, 2010, 26(12): 1626-30. |
| [13] | Zhang D, Xie L, Jia G, et al. Comparative study on antioxidant capacity of flavonoids and their inhibitory effects on oleic acid-induced hepatic steatosis in vitro[J]. Eur J Med Chem, 2011, 46(9): 4548-58. doi:10.1016/j.ejmech.2011.07.031 |
| [14] | 徐军, 王国恩, 章时杰, 等. 1, 3, 7, 9-四甲基尿酸激活SirT3/AMPK/ACC信号通路减少高脂饮食小鼠肝脏脂肪化[J]. 中国药理学通报, 2014, 30(6): 791-5. Xu J, Wang G E, Zhang S J, et al. Theacrine ameliorates high fat diet induced hepatic steatosis in mice via SirT3/AMPK/ACC pathway[J]. Chin Pharmacol Bull, 2014, 30(6): 791-5. |
| [15] | 耿雅娜, 于滨, 孔维佳, 等. 天麻素通过激活AMPK通路减少油酸诱导的HL-7702细胞脂肪蓄积[J]. 中国药理学通报, 2015, 31(1): 39-44. Geng Y N, Yu B, Kong W J, et al. Gastrodin ameliorates oleic acid-induced fat accumulation through activation of AMPK pathway in HL-7702 cells[J]. Chin Pharmacol Bull, 2015, 31(1): 39-44. |

