


2. 益阳医学高等专科学校解剖教研室,湖南 益阳 413000
 ,
LIAO Jun1
,
LIAO Jun1
 ,
PENG Xi-wei1,
LIU Yang1,
CHENG Shao-wu1,
QIN Li-hua1,
DENG Yi-hui1,
WANG Guo-zuo1,
HE Xu1,2,
GE Jin-wen1
,
PENG Xi-wei1,
LIU Yang1,
CHENG Shao-wu1,
QIN Li-hua1,
DENG Yi-hui1,
WANG Guo-zuo1,
HE Xu1,2,
GE Jin-wen1

2. Dept of Anatomy, Yiyang Medical College, Yiyang Hunan 413000, China
脑缺血/再灌注损伤机制包括兴奋性氨基酸毒性,氧自由基大量生成,细胞内钙离子超载,线粒体损伤,细胞凋亡和免疫炎症损伤等[1]。近年来,铁代谢失衡作为神经系统疾病损伤机制研究受到广泛关注[2]。我们课题组前期研究表明,铁调节失衡可能是导致脑缺血神经元损伤的新机制,而脑泰方(Naotai formula extract,NTE)可通过调节铁转运相关蛋白的表达,抑制铁的细胞内转运,促进胞内铁外排,达到保护神经元,促进神经功能恢复的作用[3-5]。氧自由基是导致缺血/再灌注损伤机制之一[6]。神经退行性疾病中线粒体内铁聚集导致氧化应激损伤[7],Liu等[8]提出氧化应激在缺血/再灌注损伤中扮演重要角色,血红素加氧酶-1(heme oxygenase-1,HO-1) 是重要的血红素降解酶,具有抗炎抗凋亡作用。因此,我们推测铁代谢失衡可能是脑缺血/再灌注损伤的新机制,本研究拟探讨脑缺血/再灌注大鼠海马组织核转录因子E2相关因子(nuclear factor-erythroid 2 related factor 2,Nrf2)、HO-1和膜铁转运辅助蛋白(hephaestin,Heph)的表达及脑泰方发挥保护作用的具体机制。
1 材料 1.1 实验动物Sprague-Dawley(SD)♂大鼠80只,体质量250 ~280 g,SPF级,8周龄。由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号: SCXK(湘)2013-0004,动物合格证号:43004700023825。动物饲养于湖南中医药大学实验动物中心,湿度45%~65%、室温25℃、自由饮水、摄食,适应性饲养1周后开始实验。
1.2 药物脑泰方组方由黄芪、川芎、地龙和僵蚕四味药组成。黄芪主要成分为黄芪甲苷,具有抗脑缺血/再灌注损伤及氧化应激等作用;川芎的主要成分为川芎嗪,具有保护血管内皮、抗缺血/再灌注损伤、抗氧化应激等作用;地龙提取液具有抗氧自由基、脂质过氧化、炎性因子损伤作用;僵蚕提取物具有抗凝、抗血栓、促纤溶等作用。药材均购于湖南中医药大学第一附属医院。药材经水煎、醇提后制成浸膏粉(由湖南中医药大学药学院制剂教研室提取),临用时以生理盐水调成所需浓度。
1.3 仪器与试剂Real-Time PCR仪(7500,ABI);凝胶成像分析系统、电泳槽(Bio-Rad)。逆转录试剂盒、SYBR Premix Ex Taq(TaKaRa);Nrf2多克隆抗体(批号:sc-722)、HO-1多克隆抗体(批号:sc-1796)、Heph多克隆抗体(批号:sc-49969S)均购自Santa Cruz;PVDF膜(Millipore公司);ECL化学发光试剂盒(GE Healthcare);去铁酮(加拿大奥贝泰克制药有限公司);2, 3, 5-氯化三苯基四氮唑(上海如吉生物科技有限公司);水合氯醛(国药集团);线栓(2636 A4,北京西浓)。
2 方法 2.1 分组及给药方法随机数字表法将80只大鼠分为5组,每组16只,分别为假手术组(Sham,灌胃生理盐水)、模型组(I/R,灌胃生理盐水)、脑泰方低、中、高剂量组(NTE+I/R, 灌胃剂量分别是4.5、9、18 g·kg-1)。药物剂量按公式计算:大鼠剂量/g=成人每日剂量(g)×大鼠体重与体表面积比值/人体重与体表面积比值[9]。每只大鼠术前灌胃3 d、术后灌胃2 d,每日1次,于术后d 3处死取材。
2.2 动物造模采用改良的线栓法制备大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型[10]。阻塞右侧大脑中动脉2 h后拔出线栓,造成脑缺血/再灌注模型,假手术组只分离血管,不插入线栓。麻醉清醒后,采用神经行为学评分判断模型是否成功。
2.3 指标检测 2.3.1 神经行为学评分大鼠缺血/再灌注后72 h评分,采用Zea Longa等[11]制定5级4分制评分标准。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失;分值越高,说明动物行为障碍越严重。
2.3.2 TTC染色术后72 h大鼠断头取材,生理盐水冲洗后放入-20 ℃速冻15 min,将大脑冠状切成6片,每片厚2 mm,放入1% 2, 3, 5-氯化三苯基四氮唑溶液,37℃避光染色15 min,每5 min轻微震荡数次,染色后用4%多聚甲醛固定,拍照。正常区为红色,缺血梗死区为白色,用Image-Pro Plus 6.0图像分析软件计算脑梗死体积,梗死体积百分比/%=(对侧半球体积-梗死侧正常体积)/对侧半球体积×100%。
2.3.3 Real-time PCR大鼠麻醉后断头,在冰盒上快速取出梗死侧(右侧)海马组织,按照TRIzol试剂盒说明的步骤提取总RNA,通过紫外分光光度计测定RNA浓度,电泳查看RNA完整性。按照逆转录试剂盒合成cDNA,将制备好的cDNA进行PCR扩增,反应条件:95℃ 10 min,95℃ 15 s,60℃ 1 min,95℃ 15 s,60℃ 15s,进行40个循环。反应结束后,确认实时荧光定量PCR的扩增曲线和熔解曲线,得出各试验孔的Ct值,同一cDNA样本设3个复孔,求其Ct值的均值,并以同一样本中β-actin的Ct值作为内参,按照公式计算各组样品的2-△△Ct值。引物序列:Nrf2:正向5′-ATATACGCAGGAGGGAAG-3′,反向5′-TCCCATCCTCATCACGTAAC-3′;HO-1:正向5′-GCACTGCTGACAGAGGAACACA-3′,反向5′-CCACGGTCGCCAACAGGAAA-3′;Heph:正向5′-GCCAACACTACCAAGCGTCAAG-3′;反向5′-TGGAACCCAGGAGCCCATCTT-3′;β-actin:正向5′-CCCATCTATGAGGGTTACGC-3′,反向5′-TTTAATGTCACGCACGATTTC-3′。
2.3.4 Western blot大鼠麻醉后断头,在冰盒中取出右侧海马,按说明书提取蛋白并测定含量。取蛋白样品与5×SDS凝胶上样缓冲液混合后煮沸变性,SDS-PAGE电泳分离,湿转至PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭1 h,再分别与兔抗大鼠Nrf2一抗(1:200)、羊抗大鼠HO-1一抗(1:200)、羊抗大鼠Heph一抗(1:200) 和小鼠抗大鼠β-actin一抗(1:1 000) 溶液混合,4℃摇床过夜,TBST洗3次,然后分别加羊抗兔二抗(1:2 000)、驴抗山羊二抗(1:3 000) 和羊抗小鼠二抗(1: 2 000),于37℃孵育1 h,TBST洗3次后TBS洗1次,然后在膜的正面滴加ECL化学发光液反应1 min左右,放入凝胶成像系统中扫描成像。用Quantity One图像分析软件测定目的条带的累积光密度(integrated optical density,IOD),以目的条带的IOD与β-actin条带的IOD的比值作为该目的条带相对表达量。
2.4 统计学方法采用SPSS17.0统计软件进行统计分析,实验数据采用x±s表示。先将各组数据进行正态性和方差齐性检验,采用单因素方差分析。神经功能损伤评分用均数表示,多组间比较采用Kruskal-Wallis H检验,当多组间比较显示有差异时,再采用Mann-Whitney U检验。
3 结果 3.1 神经行为学评分结果缺血/再灌注后72 h,与假手术组比较,模型组神经行为学评分明显升高(P<0.01);与模型组比较,NTE中、高剂量组神经行为学评分明显降低(P<0.01),NTE低剂量组与模型组比较差异无显著性(P>0.05),见Fig 1。
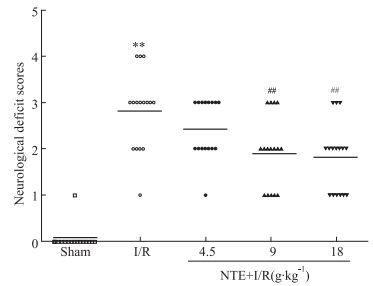
|
| Fig 1 Effects of Naotai formula extract (NTE) on neurological deficit scores of I/R in rats (x±s, n=16) **P < 0.01 vs sham; ##P < 0.01 vs I/R |
TTC染色后,与假手术组比较,模型组呈现较大梗死面积(P<0.01);与模型组比较,NTE各剂量组梗死范围明显缩小(P<0.01),见Fig 2。
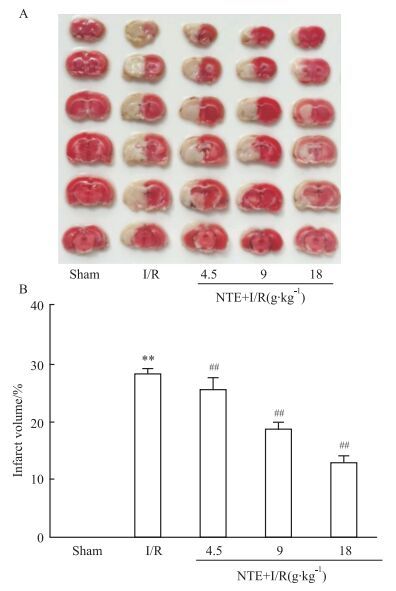
|
| Fig 2 Effects of naotai formula extract on infarct volume of I/R in rats(x±s, n=6) A:Coronal sections of 2, 3, 5-triphenyltetrazolium-stained brains; B:Infarct volume. **P < 0.01 vs sham; ##P < 0.01 vs I/R. |
PCR检测结果与模型组比较,各NTE剂量组HO-1 mRNA表达明显增加(P<0.05),NTE中、高剂量组Heph mRNA表达明显增加(P<0.05)。各NTE剂量组中Nrf2 mRNA表达增高,但与模型组比较差异均无统计学意义(P>0.05)。见Fig 3。
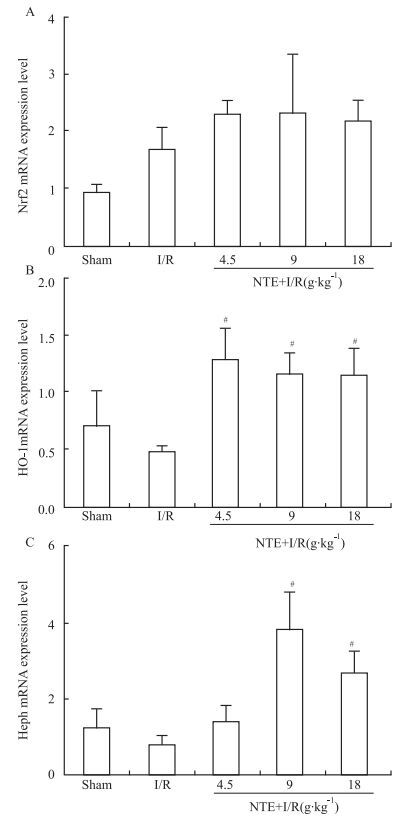
|
| Fig 3 Effects of naotai formula extract on hippocampus Nrf2(A), HO-1 (B) and Heph (C) mRNA levels of I/R in rats(x±s, n=5) #P < 0.05 vs I/R |
假手术组中Nrf2、HO-1和Heph蛋白呈少量表达,模型组中Nrf2蛋白表达增加,HO-1和Heph蛋白表达降低,但与假手术组比较差异均无统计学意义(P>0.05)。各NTE组能不同程度上调Nrf2、HO-1和Heph蛋白表达,其中NTE中、高剂量组Nrf2和Heph蛋白的表达明显高于模型组(P<0.05,P<0.01);各NTE剂量组HO-1的表达较模型组明显增高,差异有统计学意义(P<0.01)。见Fig 4。
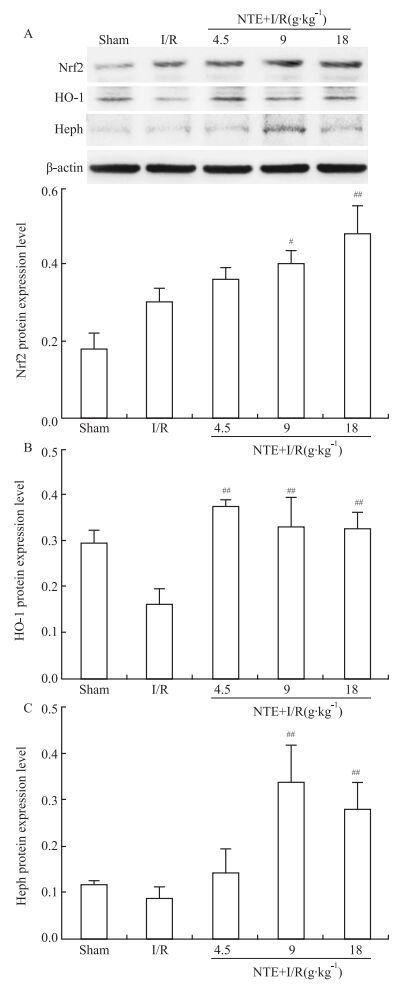
|
| Fig 4 Effects of naotai formula extract on hippocampus Nrf2(A), HO-1(B) and Heph (C) protein levels of I/R in rats(x±s, n=5) #P < 0.05, ##P < 0.01 vs I/R |
脑缺血/再灌注后因自由基大量生成、兴奋性氨基酸毒性、钙超载及炎症反应等原因导致脑损伤[12-13]。近年来也有研究表明,脑缺血/再灌注损伤与自噬、铁代谢等相关。脑缺血/再灌注后铁过载的两条途径:IL-6表达上调,激活JAK/STAT3通路使铁调素增加,而铁调素可以使膜铁转运蛋白表达下降,因此铁外排减少,造成铁沉积;再灌注后低氧诱导因子-1α表达上调,使转铁蛋白受体增加,导致铁在缺血组织中的沉积[14]。脑缺血/再灌注后脑铁超载能通过氧化损伤或直接的神经毒性等机制加重神经损伤,引起细胞铁死亡[15]。
Keap1-Nrf2/ARE信号通路在抗氧化应激损伤中发挥重要的作用。在生理状态下,Nrf2与果蝇肌动蛋白结合蛋白(Keap1) 结合位于胞质中,从而不能进入细胞核发挥转录活性。当受到氧化应激时,Nrf2与Keap1解离进入细胞核,与抗氧化反应组件ARE结合,从而启动下游抗氧化基因和HO-1的转录,提高细胞的的抗氧化应激能力。Keap1-Nrf2/ARE通路可以靶向调节与铁代谢密切相关的蛋白,如铁蛋白和膜铁转运蛋白,从而进一步调节机体铁代谢[16]。HO-1作为一种与铁代谢相关的应激蛋白,HO-1可以将血红素分解成为胆绿素、CO和铁,应激状态下能对抗氧化应激起到保护作用,而慢性过表达时可以促使铁沉积,通过Fenton反应,生成毒性更大的羟自由基[17]。Heph在皮质、纹状体、海马、黑质、脑干等部位均有表达[18],在脑铁代谢中发挥重要的作用。Heph属于铁转运相关蛋白,具有亚铁氧化酶活性,能将二价铁氧化成三价,与膜铁转运蛋白共同调节铁释放,减轻铁过载诱发的氧化损伤。已有研究报道,大鼠脑缺血/再灌注后损伤区Nrf2表达迅速上调,而再灌注后3~72 h各时间点,Nrf2蛋白的表达变化不明显;HO-1蛋白的表达在48 h达高峰,在72 h逐渐下降[19]。缺血/再灌注后12 h皮层和纹状体中Heph蛋白表达明显增加,在24 h达到峰值,在72 h恢复到正常水平[20]。脑缺血/再灌注后Keap1-Nrf2/ARE信号通路激活,急性期HO-1及Heph表达增加可减少氧化应激损伤,这是一种保护性应激反应,但是反应持续时间短,因此需要药物干预缺血/再灌注损伤。脑缺血后,中药补阳还五汤精简方干预可以上调Nrf2和HO-1蛋白和基因的表达,明显改善其神经功能缺失症状,减小脑梗死面积,减轻脑组织水肿[21]。黄芪与三七有效成分配伍作用脑缺血/再灌注后小鼠,单用黄芪甲苷组能降低胞质Nrf2蛋白含量,胞核内Nrf2表达升高,同时上调HO-1 mRNA和蛋白表达,黄芪甲苷与人参皂苷Rg1配伍的效应最明显[22]。本研究中脑缺血/再灌注后脑泰方干预,脑泰方各剂量组神经行为学评分较模型组降低,大鼠神经功能得到改善,脑梗死体积缩小,缺血/再灌注损伤的海马组织HO-1和Heph mRNA及蛋白表达均上调,Nrf2蛋白表达增高,而Nrf2 mRNA表达上调不明显,这与蛋白表达不相一致,提示Nrf2调控并非发生于基因转录水平,可能是因为Nrf2转录活性增强而mRNA表达无明显改变[23]。
因此,我们推测细胞内铁代谢失衡是脑缺血/再灌注损伤的机制,脑泰方可能通过激活Keap1-Nrf2/ARE通路,促进HO-1和Heph表达,促进铁外排,降低脑铁沉积,抑制铁离子介导的氧化应激损伤,具有平衡铁代谢,保护神经元,恢复神经功能的作用。
( 致谢: 本实验主要在湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室完成,感谢实验室及课题组老师和同学的帮助。)
| [1] | Hu Y, Deng H, Xu S, et al. MicroRNAs regulate mitochondrial function in cerebral ischemia-reperfusion injury[J]. Int J Mol Sci, 2015, 16(10): 24895-917. doi:10.3390/ijms161024895 |
| [2] | Ward R J, Zucca F A, Duyn J H, et al. The role of iron in brain ageing and neurodegenerative disorders[J]. Lancet Neurol, 2014, 13(10): 1045-60. doi:10.1016/S1474-4422(14)70117-6 |
| [3] | 廖君, 陈懿, 夏兴, 等. 大鼠脑缺血后海马CA2区FLVCR和BCRP的表达及益气活血法干预[J]. 中国动脉硬化杂志, 2014, 22(11): 1091-6. Liao J, Chen Y, Xia X, et al. Research on expression of FLVCR and BCRP in hippocamp CA2 of rats subjected to cerebral ischemia and traditional Chinese medicine of supplementing qi and activating blood circulation intervention effects[J]. Chin J Arteriosclerosis, 2014, 22(11): 1091-6. |
| [4] | 廖君, 夏兴, 石咏梅, 等. 脑缺血大鼠海马CA2区转铁蛋白受体及膜铁转运蛋白的表达及脑泰方提取物干预研究[J]. 中华中医药杂志, 2014, 29(5): 1406-11. Liao J, Xia X, Shi Y M, et al. NTE treatment results in TFR and Fpn expression in hippocampus CA2 of rats subjected to cerebral ischemia[J]. China J Tradit Chin Med Pharm, 2014, 29(5): 1406-11. |
| [5] | Liao J, Xia X, Wang G Z, et al. Naotaifang extract treatment results in increased ferroportin expression in the hippocampus of rats subjected to cerebral ischemia[J]. Mol Med Rep, 2015, 11(6): 4047-52. doi:10.3892/mmr.2015.3309 |
| [6] | Bagheri F, Khori V, Alizadeh A M, et al. Reactive oxygen species-mediated cardiac-reperfusion injury: Mechanisms and therapies[J]. Life Sci, 2016, 165: 43-55. doi:10.1016/j.lfs.2016.09.013 |
| [7] | Gille G, Reichmann H. Iron-dependent functions of mitochondria—relation to neurodegeneration[J]. J Neural Transm, 2011, 118(3): 349-59. doi:10.1007/s00702-010-0503-7 |
| [8] | Liu B, Qian J M. Cytoprotective role of heme oxygenase-1 in liver ischemia reperfusion injury[J]. Int J Clin Exp Med, 2015, 8(11): 19867-73. |
| [9] | 贺石林, 王键, 王净净. 中医科研设计与统计学[M]. 湖南: 科学技术出版社, 2012: 48-9. He S L, Wang J, Wang J J. Scientific research design and statistics of Chinese medicine[M]. Hunan: Science & Technology Press, 2012: 48-9. |
| [10] | 龚哲, 张晓旎, 李红红, 等. 羟基红花黄素A对脑缺血/再灌注后缺血半暗带自噬活性的调节作用[J]. 中国病理生理杂志, 2017, 33(3): 449-54. Gong Z, Zhang X N, Li H H, et al. Modulation of autophagy in ischemic penumbra by hydroxysafflor yellow A after cerebral ischemia/reperfusion injury[J]. Chin J Pathophys, 2017, 33(3): 449-54. |
| [11] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [12] | Sanderson T H, Reynolds C A, Kumar R, et al. Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive oxygen species generation[J]. Mol Neurobiol, 2013, 47(1): 9-23. doi:10.1007/s12035-012-8344-z |
| [13] | Chouchani E T, Pell V R, Gaude E, et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS[J]. Nature, 2014, 515(7527): 431-5. doi:10.1038/nature13909 |
| [14] | Ding H, Yan C Z, Shi H, et al. Hepcidin is involved in iron regulation in the ischemic brain[J]. PLoS One, 2011, 6(9): e25324. doi:10.1371/journal.pone.0025324 |
| [15] | 康传杰, 张相彤, 马威. 细胞铁死亡发生与调控机制的研究进展[J]. 中国病理生理杂志, 2017, 33(3): 567-71. Kang C J, Zhang X T, Ma W. Progress in occurrence and development of ferroptosis[J]. Chin J Pathophys, 2017, 33(3): 567-71. |
| [16] | 常彦忠, 段相林. 铁代谢失衡疾病的分子生物学原理[M]. 北京: 人民卫生出版社, 2012: 72. Chang Y Z, Duan X L. Molecular biological principles of iron metabolism disorders[M]. Beijing: People's Medical Publishing House, 2012: 72. |
| [17] | Aztatzi-Santillan E, Eduardo Nares-Lopez F E, Marquez-Valadez B, et al. The protective role of heme oxygenase-1 in cerebral ischemia[J]. Cent Nerv Syst Agents Med Chem, 2010, 10(4): 310-6. doi:10.2174/187152410793429764 |
| [18] | Jiang R, Hua C, Wan Y, et al. Hephaestin and ceruloplasmin play distinct but interrelated roles in iron homeostasis in mouse brain[J]. J Nutr, 2015, 145(5): 1003-9. doi:10.3945/jn.114.207316 |
| [19] | 李敏. Nrf2, HO-1在实验性大鼠脑缺血/再灌注模型中的动态表达及氧化苦参碱的神经保护作用[D]. 石家庄: 河北医科大学, 2009. Li M. Nrf2、HO-1 in cerebral ischemia-reperfusion in rats and the neuroprotective effect of oxymatrine[D]. Shijiazhuang: Hebei Medical University, 2009. http://d.g.wanfangdata.com.cn/Thesis_Y1637123.aspx |
| [20] | 温仲民. 大鼠急性脑缺血/再灌注模型的制备和Hephastin表达变化的研究[D]. 苏州: 苏州大学, 2004. Wen Z M. Improved model of middle cerebral artery occlusion and the expression of hephaestin after acute focal cerebral ischemia and reperfusion in rats[D].Suzhou:Soochow University, 2004. http://d.wanfangdata.com.cn/Thesis/Y645341 |
| [21] | 佘颜, 王宇红, 邵乐, 等. 补阳还五汤精简方对大鼠脑缺血后血管新生及Nrf2/HO-1信号途径的影响[J]. 中国药理学通报, 2016, 32(1): 123-8. She Y, Wang Y H, Shao L, et al. Effects of thin recipe of Buyang Huanwu Decoction on angiogenesis and signal pathway of Nrf2/HO-1 after cerebral ischemic injury in rat[J]. Chin Pharmacol Bull, 2016, 32(1): 123-8. |
| [22] | 黄小平, 邓常清, 邱咏园, 等. 黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血/再灌注后氧化应激和Nrf2/HO-1途径的影响[J]. 中国药理学通报, 2013, 29(11): 1596-601. Huang X P, Deng C Q, Qiu Y Y, et al. Effects of combinations of astragaloside Ⅳ and three active components in notoginseng on oxidative stress and Nrf2/HO-1 pathway after cerebral ischemic-reperfusion in mice[J]. Chin Pharmacol Bull, 2013, 29(11): 1596-601. doi:10.3969/j.issn.1001-1978.2013.11.028 |
| [23] | Dinkova-Kostova A T, Holtzclaw W D, Cole R N, et al. Direct evidence that sulfhydryl groups of Keap1 are the sensors regulating induction of phase 2 enzymes that protect against carcinogens and oxidants[J]. Proc Natl Acad Sci U S A, 2002, 99(18): 11908-13. doi:10.1073/pnas.172398899 |