


2. 贵州省中国科学院天然产物化学重点实验室药理与生物活性研究中心,贵州 贵阳 550014;
3. 贵州医科大学省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
2. Center for Pharmacology and Bioactivity Research, the Key Lab of Chemistry for Natural Products, Guizhou Province and Chinese Academy of Sciences, Guiyang 550014, China;
3. State Key Lab of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550014, China
补体在天然免疫中具有重要作用,但其过度激活会引发炎症和组织损伤。近年来研究表明,补体在与炎症相关的脓毒症、急性肺损伤、缺血/再灌注损伤、多器官功能衰竭等临床急危重症与病理损伤中扮演了重要的角色[1-2]。在这些病症和损伤中往往伴随有纤溶凝血功能的异常和广泛的微血栓生成。研究表明,凝血系统功能的异常与补体的激活以及炎症存在密切的关系[3-5]。我们之前的研究表明了补体旁路的过度激活能引起微血管内皮细胞的活化和炎症反应[6-7],与纤溶凝血功能相关的分子出现了表达的变化,而PDTC和Res能在一定程度上影响这种变化[8],但尚不清楚这种分子表达上的变化及干预是否会引起相应的功能改变。基于内皮细胞在维持纤溶与凝血平衡方面的重要生理功能[9],本文研究了补体旁路激活对微血管内皮细胞纤溶凝血功能的影响以及PDTC、Res对相关变化的干预作用。
1 材料与方法 1.1 材料人微血管内皮细胞(human microvascular endothelial cells,HMEC)由本实验室传代培养;RPMI 1640培养基购自Gibco;胎牛血清为天津灏洋生物制品科技有限公司产品;发色底物S-2251为意大利Chromogenix公司产品;吡咯烷二硫氨基甲酸(pyrrolidinedithiocarbamate,PDTC)、白藜芦醇(resveratrol,Res)购自美国Sigma公司;标准人血浆购自德国SIEMENS公司;凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)测定试剂盒购自上海太阳生物技术有限公司;正常人血清(normal human serum,NHS)由本实验室多名健康志愿者献血制备而成,分装后冻存于-80℃,经补体活性检测正常,备用;灭活人血清(inactivated normal human serum,INHS)由NHS于56℃孵育30 min制备;眼镜蛇毒因子(cobra venom factor,CVF)由本实验室纯化制备,其制备方法和活性测定同文献[6];其余试剂均为符合实验要求的分析纯。
1.2 主要仪器Forma 3111型CO2培养箱(美国Thermo公司);Nikon TS100倒置相差显微镜(日本Nikon公司);Milli Q超纯水系统和Elix纯水系统(美国Millipore公司);Molecular Devices Spectra MAX-190酶标仪(美国MD公司);5810R冷冻离心机(德国Eppendorf公司);Revco超低温冰箱(美国Thermo公司)。
1.3 方法 1.3.1 内皮细胞培养人微血管内皮细胞株HMEC由本实验室传代培养,用含20%胎牛血清的RPMI 1640培养基在37℃,5% CO2饱和湿度培养箱内培养,收集对数生长期细胞进行实验。
1.3.2 血清补体旁路活化参照前期已发表文献[6]的方法,将NHS与CVF(6.5×104 U·L-1)等体积混合,在37 ℃水浴孵育30 min制成CAC(CVF-activated complement)备用。实验以INHS与CVF的孵育混合物作为对照。
1.3.3 CAC对HMEC纤溶活性的影响将HMEC以1×104 cells·well-1接种于96孔细胞培养板,培养24 h后弃上清,用无血清RPMI 1640洗1遍,加入140 μL无血清RPMI 1640培养基,再加入60 μL CAC至200 μL,分别孵育不同时间,取1、6、12、24 h细胞上清,离心,冻存。取100 μL细胞上清和50 μL的100 U·L-1纤溶酶原加入酶标板中,加入100 μL 0.75 mmol·L-1发色底物S-2251后,37℃孵育3 h,酶标仪测定405 nm处的OD值。
1.3.4 CAC对HMEC凝血功能的影响 1.3.4.1 CAC对细胞培养上清凝血功能的影响将HMEC以1×104 cells·well-1,接种于96孔细胞培养板,培养24 h后弃上清,用无血清RPMI 1640洗1遍,加入140 μL无血清RPMI 1640培养基,再加入60 μL CAC至200 μL,分别孵育不同时间,取1、6、12、24 h细胞上清,离心,冻存。取解冻的20 μL细胞上清与100 μL标准人血浆在37℃孵育10 min,加入100 μL预温的APTT试剂,继续孵育5 min,加入100 μL预温的CaCl2溶液,记录凝固时间;取化冻的100 μL细胞上清与100 μL标准人血浆在37 ℃孵育3 min,加入100 μL预温的CaCl2溶液,记录凝固时间。
1.3.4.2 CAC对细胞表面凝血功能的影响将单层融合的HMEC收获后以5×105个接种于细胞培养瓶,24 h后消化收集细胞,离心,将细胞沉淀用无血清RPMI 1640混匀,每个EP管加入200 μL细胞悬液(2×104 cells),离心,弃上清,然后加入140 μL无血清RPMI 1640培养基悬浮细胞,加入60 μL CAC,分别培养1、2、6 h,离心,用预冷PBS洗涤细胞2次,然后分别配成1×109 cells·L-1和2×108 cells·L-1的细胞悬液。取1×109 cells·L-1细胞悬液20 μL与100 μL标准人血浆在37 ℃孵育10 min,加入100 μL预温的APTT试剂,37 ℃孵育5 min,加入100 μL预温的CaCl2溶液,记录凝固时间;取2×108 cells·L-1细胞悬液100 μL与100 μL标准人血浆于37 ℃孵育3 min,加入100 μL预温的CaCl2溶液,记录凝固时间。
1.3.5 PDTC、Res对CAC致HMEC凝血纤溶功能变化的作用 1.3.5.1 PDTC、Res对HMEC纤溶活性的影响将HMEC以1×104 cells·well-1接种于96孔细胞培养板,24 h后弃上清,用无血清RPMI 1640洗1遍。分别加入140 μL含PDTC(终浓度为20、50、100 μmol·L-1)、Res(终浓度为5、10、20 μmol·L-1)的无血清RPMI 1640,孵育1 h。每孔加入60 μL CAC,1 h取培养上清,冻存。纤溶活性测定方法同“1.3.3”。
1.3.5.2 PDTC、Res对HMEC细胞培养上清凝血功能改变的影响将HMEC以1×104 cells·well-1接种于96孔细胞培养板,24 h后弃上清,用无血清RPMI 1640洗1遍。分别加入140 μL含PDTC(终浓度为20、50、100 μmol ·L-1)、Res(终浓度为5、10、20 μmol·L-1)的无血清RPMI 1640,孵育1 h。每孔加入60 μL CAC,1 h取培养上清,冻存。APTT、PT测定方法同“1.3.4.1”。
1.3.5.3 PDTC、Res对HMEC细胞表面凝血功能改变的影响将单层融合的HMEC收获后以5×105 cells接种于细胞培养瓶,24 h后消化收集细胞,离心,将细胞沉淀用无血清RPMI 1640混悬,取200 μL(2×104 cells)加入EP管中,离心,弃上清,分别加入140 μL含不同浓度PDTC(20、50、100 μmol·L-1)、Res(5、10、20 μmol·L-1)的无血清RPMI 1640培养基140 μL预处理细胞1 h,再加入60 μLCAC,分别培养1、6 h,离心,用预冷PBS洗涤细胞2次,后续操作及APTT、PT的测定同“1.3.4.2”。
1.3.6 统计学分析实验数据以x±s表示,采用SPSS 16.0软件进行单因素方差分析,组间多重比较采用LSD法。
2 结果 2.1 CAC对HMEC纤溶活性的影响HMEC暴露于CAC后,在1h时间点检测到培养上清中酶切发色底物S-2251的活性有明显的上升(P<0.01),而在后续的各时间点没有出现进一步的明显变化(Fig 1)。(CVF+INHS)对照组培养上清中的酶活性在后续的时间点中有所上升。而NHS本底对照组酶切S-2251活性的OD值只有0.164±0.046。
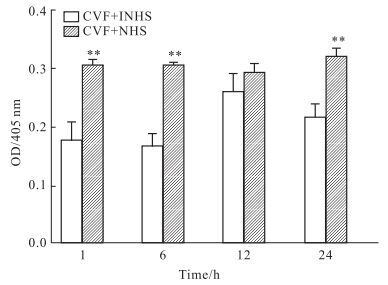
|
| Fig 1 Effect of CAC on fibrinolysis of HMEC(n=4) **P < 0.01 vs control |
CAC刺激HMEC后,细胞培养上清导致了正常血浆的APTT和PT明显缩短(P<0.01)(Fig 2)。
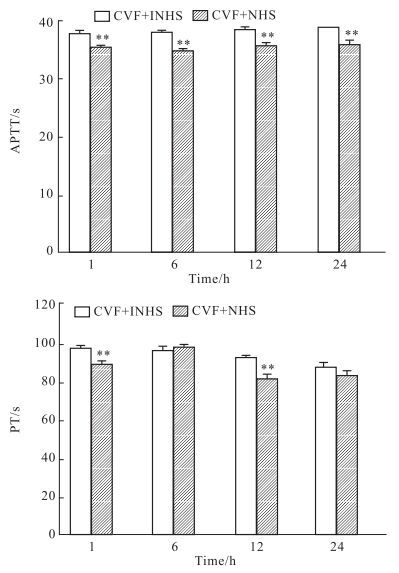
|
| Fig 2 Effect of cell culture supernatant on coagulation after HMEC exposure to CAC(n=4) **P < 0.01 vs control |
对细胞表面的凝血功能测定表明,CAC刺激HMEC后,导致了细胞表面凝血功能的变化,使正常血浆的APTT和PT均明显缩短(P<0.01),其中PT的变化明显晚于APTT(Fig 3)。
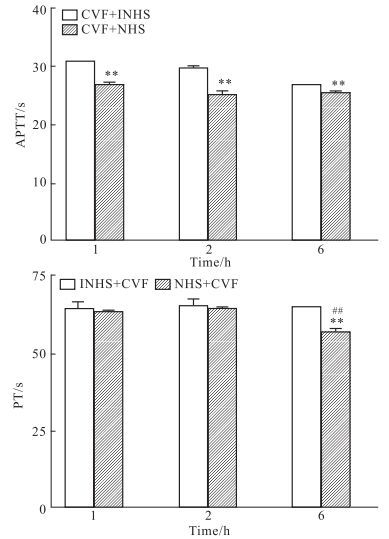
|
| Fig 3 Effect of cell suspension on coagulation after HMEC exposure to CAC(n=4) **P < 0.01 vs control; ##P < 0.01 vs all other groups |
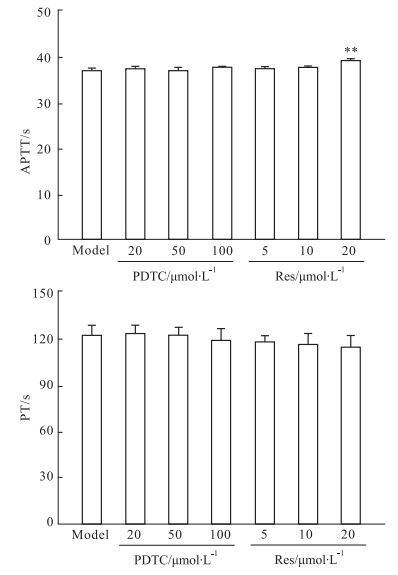
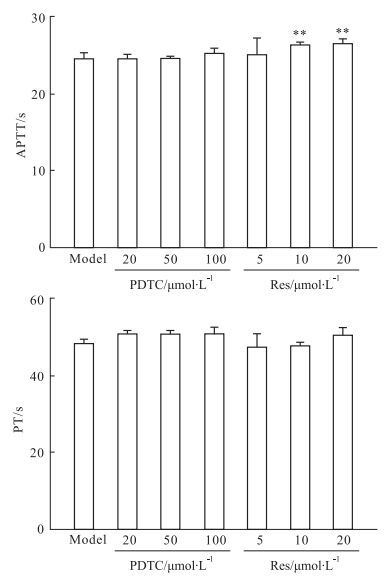
干预实验的结果表明,PDTC和Res对HMEC受CAC刺激后的纤溶功能上调没有明显的影响(Fig 4);PDTC对培养上清和细胞悬液致正常血浆APTT、PT的缩短有一定的干预作用,但在统计学上没有显著性;Res对培养上清和细胞悬液导致的APTT缩短有明显的干预作用(P<0.01),但对PT缩短的干预作用不明显(Fig 5、6)。
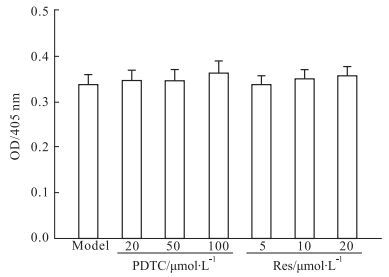
|
| Fig 4 Effect of PDTC and Res on fibrinolysis after HMEC exposure to CAC(n=4) |
|
| Fig 5 Effect of PDTC and Res on coagulation function of cell culture supernatant after HMEC exposure to CAC(n=4) **P < 0.01 vs model |
|
| Fig 6 Effect of PDTC and Res on coagulation function of cell after HMEC exposure to CAC(n=4) **P < 0.01 vs model |
我们之前的研究表明,补体旁路激活会导致HMEC纤溶凝血相关分子(t-PA、PAI-1、TF、TM、NO)的表达变化,PDTC、Res对这种表达的变化具有一定的干预作用[8]。这些纤溶凝血相关分子的表达变化能否引起相应的功能变化,在本工作中进一步研究了HMEC暴露于CAC后在纤溶凝血功能方面的变化情况以及PDTC、Res的干预作用。
研究结果显示,HMEC受到CAC刺激后,1 h时间点的培养上清水解发色底物S-2251的活性明显增强,而在后续各时间点中,没有进一步的明显变化。这与之前研究揭示HMEC受到CAC刺激后t-PA、PAI-1分子表达的比值变化的结果是相一致的,表明补体旁路激活对t-PA、PAI-1分子表达的改变会影响HMEC的纤溶功能。对各时间点细胞上清的凝血功能的测定结果表明,细胞上清能导致正常血浆APTT的明显缩短,其次,也导致了PT的缩短。在接下来对细胞表面的凝血功能进行检测后发现,经CAC刺激后的HMEC表面能明显缩短正常血浆APTT,与APTT相比,对PT的影响相对滞后。此前我们的研究表明,补体旁路激活产物刺激HMEC后,组织因子TF分子的表达上调,在6 h时间点开始与对照组出现显著性的差异[8]。因此,上述PT的变化较APTT滞后,其原因可能与激活PT路径的TF分子在细胞表面的表达变化情况相关。从细胞培养上清和细胞表面的检测结果表明,两者对正常血浆凝血功能的影响情况较为一致。我们之前的研究表明,CAC刺激HMEC后,具有抗凝作用的NO的分泌和血栓调节蛋白TM的表达均下调[8],提示HMEC经CAC刺激后抗凝功能减弱。本研究中的纤溶凝血功能测定结果则进一步表明HMEC经CAC刺激后,纤溶促凝分子表达的上调和抗凝分子的下调会促使其抗凝/促凝调控功能失衡,从而导致凝血功能紊乱。
PDTC和Res对HMEC纤溶凝血功能变化的干预研究表明,PDTC和Res对纤溶活性的上调基本没有影响,但Res对上述的APTT缩短有明显的干预作用,而PDTC能在一定程度上干预PT的缩短。PDTC是NF-κB信号通路p65的特异抑制剂,同时也能通过清除活性氧中间产物发挥抗氧化作用,而Res具有抗炎、抗氧化等作用,其机制与直接抑制NF-κB信号通路的活化以及通过抑制烟酰胺腺嘌呤二核苷酸磷酸氧化酶的活化从而减少活性氧的产生有关[10]。PDTC和Res对纤溶、凝血功能变化的干预作用的不同,既反映了两者在作用机制上的差异,也为深入开展相关的调控机制及干预研究提供了线索和参考。
本研究通过体外细胞实验表明补体旁路激活会导致微血管内皮细胞纤溶凝血功能的变化和失调,而PDTC、Res对这种变化具有一定的干预作用,这有助于进一步认识炎症情况下纤溶凝血功能改变的发生机制以及补体激活在其中扮演的角色,并可能为临床治疗新策略及新药的筛选和研发提供参考和适宜的细胞模型。
( 致谢: 本实验是在贵州省中国科学院天然产物化学重点实验室药理与生物活性研究中心孙黔云研究员实验室完成。)
| [1] | Karpman D, Tati R. Complement activation in thrombotic microangiopathy[J]. Hamostaseologie, 2013, 33(2): 96-104. doi:10.5482/HAMO-12-12-0025 |
| [2] | Ricklin D, Hajishengallis G, Yang K, Lambris J D. Complement: a key system for immune surveillance and homeostasis[J]. Nat Immunol, 2010, 11(9): 785-97. doi:10.1038/ni.1923 |
| [3] | Semeraro N, Ammollo C T, Semeraro F, Colucci M. Sepsis, thrombosis and organ dysfunction[J]. Thromb Res, 2012, 129(3): 290-5. doi:10.1016/j.thromres.2011.10.013 |
| [4] | Carter A M. Complement activation: an emerging player in the pathogenesis of cardiovascular disease[J]. Scientifica (Cairo), 2012, 2012: 402783. |
| [5] | 李敏, 孙黔云, 赵琼, 等. 补体旁路过度激活影响体内凝血功能[J]. 中国药理学通报, 2014, 30(1): 39-4. Li M, Sun Q Y, Zhao Q, et al. Abnormality of blood coagulation induced by excessive activation of the alternative complement pathway[J]. Chin Pharmacol Bull, 2014, 30(1): 39-4. |
| [6] | 孙黔云, 李敏, 叶巧玲, 李红玲. 补体旁路激活导致内皮细胞活化和损伤[J]. 中国药理学通报, 2012, 28(7): 925-9. Sun Q Y, Li M, Ye Q L, Li H L. Endothelial cell activation and injury induced by complement alternative pathway[J]. Chin Pharmacol Bull, 2012, 28(7): 925-9. |
| [7] | 李红玲, 孙黔云, 李敏, 石京山. 补体旁路激活产物刺激内皮细胞NF-κB、p38MAPK、JAK2通路活化及抑制剂的干预研究[J]. 中国细胞生物学学报, 2013, 35(6): 836-41. Li H L, Sun Q Y, Li M, Shi J S. Activation of NF-κB, p38MAPK, and JAK2 in endothelial cells induced by activated complement alternative pathway and intervention by inhibitors[J]. Chin J Cell Biol, 2013, 35(6): 836-41. doi:10.11844/cjcb.2013.06.0239 |
| [8] | 路青瑜, 李敏, 孙黔云. 补体旁路激活致内皮细胞纤溶凝血相关分子表达变化及干预研究[J]. 中国药理学通报, 2015, 31(8): 1142-6. Lu Q Y, Li M, Sun Q Y. Expression of coagulation-and fibrinolysis-related molecules of endothelial cells induced by activated complement alternative pathway and intervention[J]. Chin Pharmacol Bull, 2015, 31(8): 1142-6. |
| [9] | Pober J S, Sessa W C. Inflammation and the blood microvascular system[J]. Cold Spring Harb Perspect Biol, 2014, 7(1): a016345. |
| [10] | Ma T, Tan M S, Yu J T, Tan L. Resveratrol as a therapeutic agent for Alzheimer's disease[J]. Biomed Res Int, 2014, 2014: 350516. |

