


阿尔茨海默病(Alzheimer's disease,AD)是多发于65岁以上人群的神经系统退行性疾病,临床表现为进行性的记忆损伤、认知障碍以及精神行为异常。β-淀粉样蛋白(beta-amyloid peptide,Aβ)沉积形成的老年斑和细胞微管连接蛋白tau的高度磷酸化产生的神经纤维缠结是AD的两大病理特征[1]。Aβ异常产生与沉积可引起tau蛋白磷酸化、递质丢失、神经胶质增生和炎症等复杂的级联反应,引发了神经纤维缠结、神经元丢失和脑组织萎缩等AD病理现象[2-3]。目前治疗AD的药物,如多奈哌齐、加兰他敏等,主要通过调节兴奋性神经递质通路而改善轻、中度AD症状,但不能预防、终止或逆转AD进程,且伴有呕吐、腹泻等胃肠道不良反应[4-6]。因此,研发疗效确切、安全无毒的AD防治药物迫在眉睫。
蛇床子素(osthole,Ost),又名甲基欧芹酚或欧芹酚甲醚,是中药独活的主要活性成分。研究表明,蛇床子素具有改善学习记忆、延缓衰老、抗肿瘤等药理活性[7]。近年来本实验组发现,蛇床子素能改善AD模型细胞损伤[8-9],维持AD神经元突触的结构和功能[10],并能够促进AD神经干细胞向多种神经细胞分化[11-12],提示蛇床子素有可能成为治疗AD的潜在开发药物。但蛇床子素对Aβ的影响及机制尚不明确,故本实验采用APP595/596基因感染小鼠神经元,构建AD细胞模型,探讨蛇床子素是否通过上调miRNA-107,抑制将淀粉样前体蛋白(amyloid precursor protein, APP)剪切成Aβ的β-分泌酶1(β-site APP cleaving enzyme 1,BACE1) 的表达,进而减少Aβ的生成,发挥对AD细胞的保护作用。
1 材料 1.1 药品与试剂蛇床子素,购自中国药品生物制品检定所(纯度≥98.0%,批号:110822-200305);DMEM培养基、胎牛血清、胰蛋白酶-EDTA消化液和青霉素-链霉素均购自Gibco;APP595/596质粒、绿色荧光蛋白(green fluorescein protein,GFP)质粒及慢病毒包装系统(pLP1、pLP2、pLP/VSV-G)由天津医科大学闫亚平教授构建;脂质体2000(Invitrogen公司);DH5α感受态大肠杆菌、无内毒素质粒小提试剂盒(Omega公司);CCK-8试剂盒(Dojindo公司);二甲基亚砜(Amresco公司);乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(南京建成公司);cDNA合成试剂盒和PCR Master Mix试剂,购自Fermentas;兔抗人NF-M、APP、Aβ1-42、BACE1一抗(Bioss公司);二抗Cy3标记羊抗兔免疫球蛋白G(Jackson公司)。
1.2 仪器与设备Ti-S型荧光显微镜(日本尼康)、DIV-86L386超低温冰箱(青岛海尔)、CO2培养箱(NUAIRE,BPN)、酶标仪(深圳迈瑞,MR-96A)、PCR仪(杭州朗基,MG96G)、凝胶成像系统(UVP,GeneGenius)。
1.3 动物SPF级C57BL/6小鼠,购自辽宁长生生物有限公司,许可证号:SCXK(辽)2015-0001。出生48 h内的新生小鼠用于实验。
2 方法 2.1 蛇床子素溶液的配制精密称取2.31 mg Ost,溶于50 μL DMSO中,加DMEM稀释至1 mL, 制成浓度为10 mmol·L-1的Ost母液,加DMEM稀释至终浓度为50 μmol·L-1的Ost工作液,-20℃冻存备用。
2.2 小鼠皮层神经元的分离与培养取新生小鼠大脑皮层,剪成糜状,胰酶消化15 min,筛网过滤得到细胞悬液,以6×108·L-1的密度接种于96孔板(经多聚赖氨酸包被过),加入DMEM完全培养基,5% CO2培养箱中培养。接种d 3,培养基替换为含有2.5 μmol·L-1阿糖胞苷的DMEM完全培养基,48 h后更换新的完全培养基。待细胞融合度达70%~80%以上,用于转染实验。
2.3 APP595/596转染神经元构建AD细胞模型GFP-APP595/596质粒转化DH5α感受态大肠杆菌,接种于LB固体培养基,37℃倒置培养16 h,挑取阳性克隆,置于LB液体培养基中,37℃振荡培养18 h,提取GFP-APP595/596质粒。取GFP或GFP-APP595/596质粒15 μg、pLP1质粒6.5 μg、pLP2质粒2.5 μg、pLP/VSV-G质粒3.5 μg,采用脂质体2000介导转染293T细胞,空白对照组转染GFP质粒。培养24 h后,荧光显微镜下观察,呈现绿色荧光。转染72 h后,分别收集含有病毒的细胞培养液上清,离心,浓缩,检测病毒滴度;浓缩的病毒上清转染神经元,72 h后,采用免疫荧光化学法检测转染情况,RT-PCR检测APP的mRNA表达,Western blot检测APP的蛋白表达。
2.4 实验分组实验分为正常对照组(转染GFP的神经元,GFP)、模型对照组(转染GFP-APP595/596基因的神经元,APP)和Ost干预组(转染GFP-APP595/596基因的神经元,Ost)。Ost组给予蛇床子素(终浓度为50 μmol·L-1),GFP组和APP组给予等量溶媒,作用24 h后,检测下列指标。
2.5 CCK-8法检测神经元活力各组细胞药物干预24 h后,每孔加入CCK-8溶液10 μL,37℃孵育4 h后,450 nm下检测吸光度。
2.6 试剂盒法检测神经元LDH释放量各组细胞药物干预24 h后,离心取上清液,根据试剂盒说明书操作,510 nm下检测各组吸光度,计算LDH的释放量。
2.7 TUNEL染色法检测神经元凋亡按照TUNEL试剂盒说明书进行操作。各组细胞药物干预24 h后,以1%多聚甲醇固定30 min,0.2%的Triton X-100透化5 min,PBS冲洗,加入PE,37℃孵育1 h,用PBS洗净,DAPI避光染色5 min,置荧光显微镜下观察神经元凋亡情况。用Image J软件进行计数,计算凋亡率。凋亡率/%=红色凋亡细胞数/DAPI阳性细胞数×100%。
2.8 免疫荧光化学法检测Aβ和BACE1蛋白表达各组细胞进行药物干预24 h后,弃去上清液,以4%多聚甲醛固定30 min,0.1%的Triton X-100透化20 min,加入一抗稀释液(1 :100),4℃过夜,再加入Cy3标记的二抗稀释液(1 :100) 室温避光1 h,用PBS洗净,加入DAPI避光孵育15 min,再洗净加入抗荧光淬灭剂进行封片,倒置荧光显微镜下观察,并用Image J软件对各组细胞中Aβ及BACE1蛋白的荧光强度进行扫描和定量。
2.9 RT-PCR法检测APP和miRNA-107基因表达试剂盒法提取各组细胞总RNA,按Revert AidTMFirst Strand cDNA Synthesis Kit所示比例配制成RT反应体系,65℃ 5 min;42℃ 60 min,70℃ 5 min,合成cDNA,-80℃冻存备用。进行PCR反应(50 μL体系):按PCR Master Mix Kit所示比例配制成PCR反应体系,样品DNA用量为2.5 μL。反应条件为95℃ 2 min,95℃ 30 s,56℃ 30 s,72℃ 1 min,72℃ 10 min,35个循环后,进行琼脂糖凝胶电泳,Image J进行光密度扫描分析。各引物序列见Tab 1。
| Gene | Sequences of primers(5'-3') | Product/bp |
| APP | F:AAAACGAAGTTGAGCCTGTTGAT | 344 |
| R:GAACCTGGTCGAGTGGTCAGT | ||
| β-actin | F:TGCTGTCCCTGTATGCCTCT | 385 |
| R:TTTGATGTCACGCACGATTT | ||
| F:forward primer,R:reverse primer | ||
采用GraphPad Prism 5软件进行统计分析,数据以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。
3 结果 3.1 APP在转染APP595/596基因的神经元中高表达经免疫荧光法鉴别,培养的小鼠皮层神经元表达神经细胞标记物神经丝蛋白M(neurofilament M, NF-M)(Fig 1A)。转染APP595/596基因后,在荧光显微镜下观察GFP的表达情况。结果显示,感染了GFP-APP和感染了GFP的神经元都呈现绿色荧光(Fig 1A)。RT-PCR法与Western bolt结果显示,感染了GFP-APP的神经元中,APP呈现高表达(Fig 1B、1C),证明稳定表达APP595/596的转基因神经元构建成功。
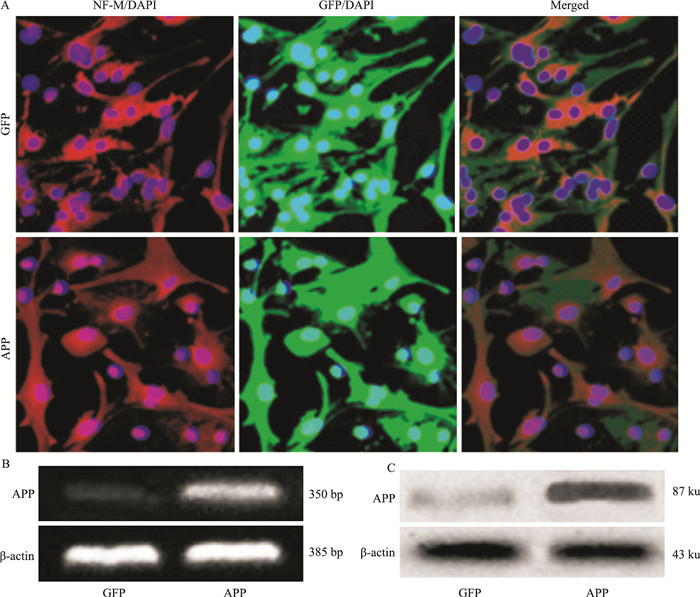
|
| Fig 1 Highly expressed APP in neurons transfected with APP595/596 gene A:Immunocytochemistry staining. NF-M is short for neurofilament M, NF-M+(Red), GFP+(green); B: The mRNA of APP assessed by RT-PCR; B: The protein of APP assessed by Western blot |
如Fig 2所示,转染APP595/596的神经元存活率为(57.9±4.6)%,明显低于正常对照组(100±4.4)%(P < 0.01),而给予Ost(终浓度50 μmol·L-1)后,神经元存活率升高至(79.5±3.6)%,与模型组(57.9±4.6)%比较,差异有显著性(P < 0.01),提示Ost能提高APP595/596转基因神经细胞的存活率。
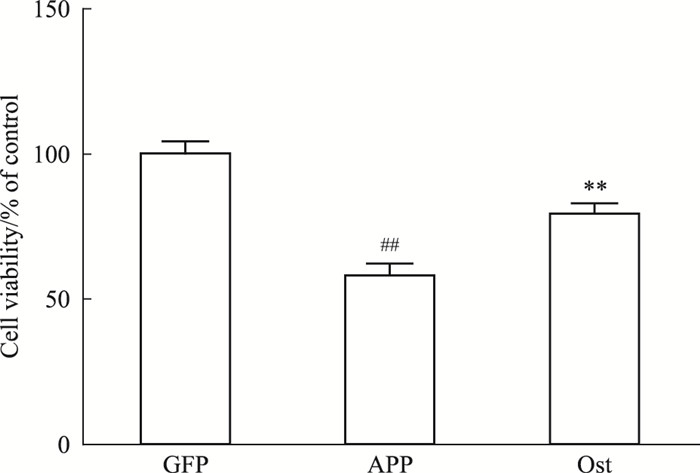
|
| Fig 2 Ost developed viability of neuronstransfected with APP595/596 gene(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
如Fig 3所示,转染APP595/596的神经元LDH的释放量明显升高,与正常对照组比较,差异有显著性(P < 0.01),给予50 μmol·L-1的Ost后,LDH水平与模型组比较明显降低(P < 0.01)。提示Ost可减少APP595/596转基因神经元的LDH释放量。
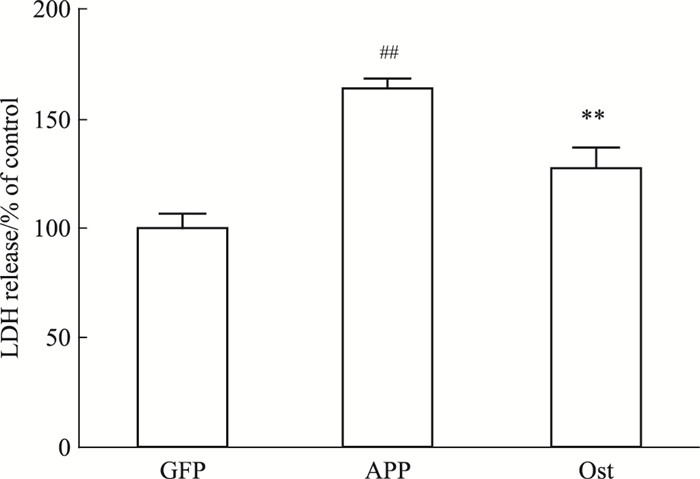
|
| Fig 3 Ost decreased LDH release of neuronstransfected with APP595/596 gene(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
如Fig 4所示,转染APP595/596基因的神经元红色斑点明显多于正常对照组(P < 0.01),说明模型组神经元发生了凋亡反应;给予Ost后,红色斑点减少,神经元凋亡率降低,与模型组比较,差异有统计学意义(P < 0.01)。提示Ost能够抑制APP595/596转基因神经元的凋亡。
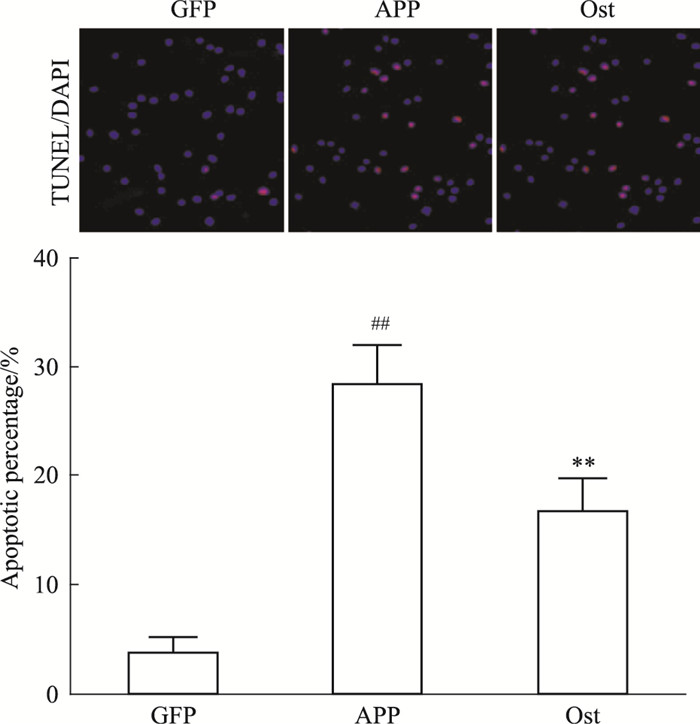
|
| Fig 4 Ost inhibited apoptosis of neurons transfected with APP595/596 gene(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
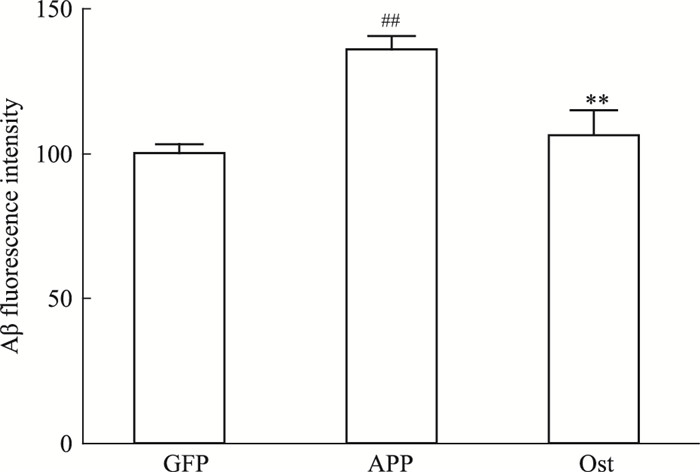
如Fig 5所示,转染APP595/596基因的神经元Aβ的表达明显高于正常对照组(P < 0.01);给予Ost后,Aβ的表达明显降低,与模型组比较,差异有显著性(P < 0.01)。提示Ost能够抑制Aβ的表达。
|
| Fig 5 Ost reduced expression of Aβ inneurons transfected with APP595/596 gene(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
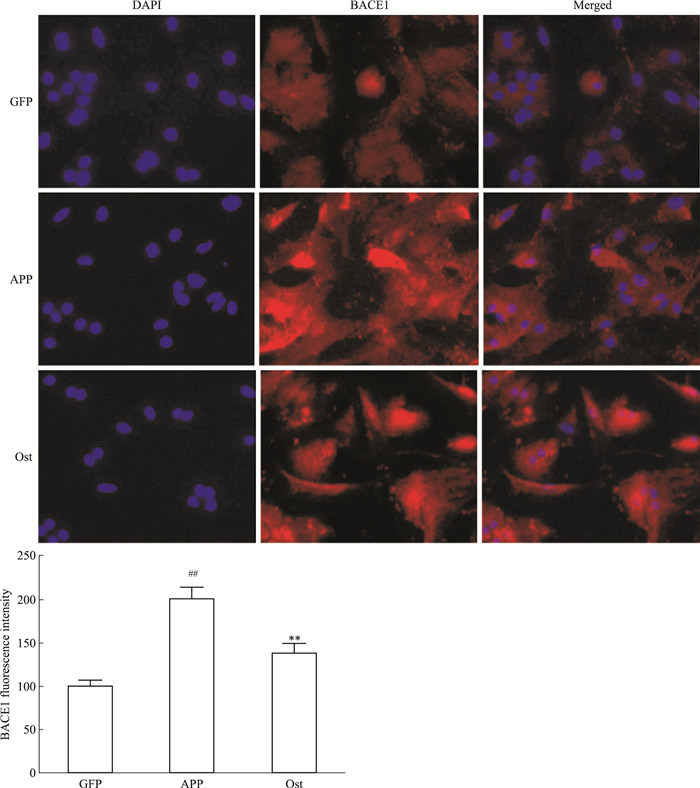
如Fig 6所示,转染GFP的对照组神经元BACE1的表达较弱,而转染APP595/596基因的模型组BACE1的表达明显增强(P < 0.01);给予Ost后,BACE1的表达明显降低,与模型组比较差异有显著性(P < 0.01)。提示Ost能够抑制BACE1的表达。
|
| Fig 6 Ost inhibited expression of BACE1 in neurons transfected with APP595/596 gene DAPI+(blue), BACE1+(red)(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
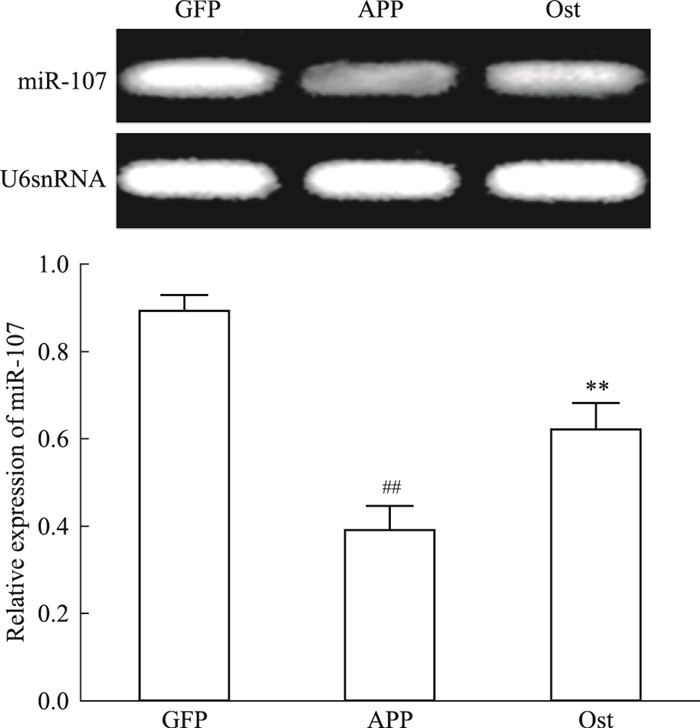
如Fig 7所示,模型组与对照组相比,miRNA-107的表达明显降低(P < 0.01),给药组miRNA-107的表达明显升高,与模型组比较差异有显著性(P < 0.01)。提示Ost能够上调APP595/596转基因神经元中miRNA-107的表达。
|
| Fig 7 Ost inhibited miRNA-107 inneurons transfected with APP595/596 gene(x±s, n=3) ##P < 0.01 vs GFP group; **P < 0.01 vs APP group |
AD的Aβ致病假说已被广泛接受,认为Aβ在脑组织中的积聚是各种原因诱发AD的共同通路,也是AD形成和发生的关键因素。研究发现,APP基因595/596位点发生突变,导致细胞及动物脑内具有神经毒性的Aβ分泌量明显升高,表现出与AD患者类似的病理和临床特征,如大脑内局限性Aβ沉积、行为障碍及痴呆症状出现的早晚与年龄相关等[13-15]。本实验采用APP595/596基因转染小鼠皮层神经元,在体外构建AD细胞模型,经RT-PCR及Western blot法鉴定,转基因神经细胞过表达APP595/596基因,说明AD细胞模型制备成功。
课题组前期实验[16],考察了终浓度为10、50、100 μmol·L-1的Ost作用24 h,对过表达APP595/596的神经细胞的保护作用,发现50 μmol·L-1作用最佳。本实验选取50 μmol·L-1的Ost进行机制研究。结果显示,Ost能够明显提高神经元存活率,减少LDH的释放,并有效抑制神经元凋亡,说明Ost对转染APP595/596基因的神经元具有良好的保护作用。
BACE1是裂解APP产生Aβ的第一限速酶,AD患者大脑中BACE1的蛋白量和酶活力明显高于正常水平,通过抑制BACE1的活性,可以抑制APP水解生成Aβ,从而减少Aβ淀粉样斑块,改善损伤神经元突触的可塑性,提高学习记忆能力[17-18]。BACE1作为miRNA-107(一种内源性非编码RNA,能够通过靶基因的互补配对,抑制靶蛋白的表达)的靶基因之一,其mRNA的3'UTR区存在miRNA-107的结合位点,两者表达呈负相关[19]。研究表明,上调miRNA-107的表达能够减少Aβ斑块沉积,从而减少脑组织中神经纤维缠结[20]。为进一步研究Ost保护神经元的作用机制,作者分别采用免疫荧光化学法和RT-PCR法,检测转染APP595/596基因的小鼠神经元在给予Ost前后BACE1和miRNA-107的表达情况。实验结果显示,Ost明显降低BACE1的蛋白表达,升高miRNA-107的表达,说明Ost有可能通过提高miRNA-107表达来降低BACE1的蛋白表达,从而抑制了APP向Aβ水解,减少Aβ产生,进而改善细胞损伤,提高细胞活力,减少细胞凋亡和损伤,发挥保护神经细胞的作用。
( 致谢: 本实验是在辽宁中医药大学药学院杨静娴教授实验室完成,感谢教亚男、李少恒、王玉莹等同学的帮助!)
| [1] | Wilcock D M, Gharkholonarehe N, Van Nostrand W E, et al. Amyloid reduction by amyloid-beta vaccination also reduces mouse tau pathology and protects from neuron loss in two mouse models of Alzheimer's disease[J]. J Neurosci, 2009, 29(25): 7957-65. doi:10.1523/JNEUROSCI.1339-09.2009 |
| [2] | Tanzi R E, Bertram L. Twenty years of the Alzheimer's disease amyloid hypothesis: a genetic perspective[J]. Cell, 2005, 120(4): 545-5. doi:10.1016/j.cell.2005.02.008 |
| [3] | Butterfield D A, Reed T, Newman S F, et al. Roles of amyloid beta-peptide-associated oxidative stress and brain protein modifications in the pathogenesis of Alzheimer's disease and mild cognitive impairment[J]. Free Radic Biol Med, 2007, 43(5): 658-77. doi:10.1016/j.freeradbiomed.2007.05.037 |
| [4] | Mayeux R, Stern Y. Epidemiology of Alzheimer disease[J]. Nat Rev Neurol, 2011, 2(8): 137-52. |
| [5] | 毕丹蕾, 文朗, 熊伟, 等. 阿尔茨海默病的可能药物靶点和临床治疗研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(4): 507-36. Bi D L, Wen L, Xiong W, et al. Development of potential therapeutic targets of and approaches to Alzheimer's disease[J]. Chin J Pharmacol Toxicol, 2015, 29(4): 507-36. |
| [6] | 李琳, 王晓良, 彭英. 抗阿尔茨海默病天然产物及其药理学研究进展[J]. 中国药理学通报, 2016, 32(2): 149-55. Li L, Wang X L, Peng Y. Pharmacological research of natural products in the treatment of Alzheimer' s disease[J]. Chin Pharmacol Bull, 2016, 32(2): 149-55. |
| [7] | 郑立卿, 张力, 董晓华, 等. 蛇床子素的药理作用研究进展[J]. 神经药理学报, 2013, 3(6): 33-9. Zheng L Q, Zhang L, Dong X H, et al. A review on the pharmacological effects and mechanismsof osthole[J]. Acta Neuropharmacol, 2013, 3(6): 33-9. |
| [8] | Hu Y, Wen Q, Liang W, et al. Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation[J]. Biol Pharm Bull, 2013, 36(12): 1950-8. doi:10.1248/bpb.b13-00561 |
| [9] | 教亚男, 姚璎珈, 孔亮, 等. 蛇床子素对转染APP595/596基因的SH-SY5Y细胞的保护作用[J]. 中国病理生理杂志, 2015, 31(11): 2053-8. Jiao Y N, Yao Y J, Kong L, et al. Protective effect of osthole on SH-SY5Y cells transfected with APP595/596 gene[J]. Chin J Pathophysiol, 2015, 31(11): 2053-8. doi:10.3969/j.issn.1000-4718.2015.11.021 |
| [10] | Li S, Yan Y, Jiao Y, et al. Neuroprotective effect of osthole on neuron synapses in an Alzheimer's disease cell model via upregulation of microRNA-9[J]. J Mol Neurosci, 2016, 60(1): 71-81. doi:10.1007/s12031-016-0793-9 |
| [11] | Kong L, Hu Y, Yao Y, et al. The coumarin derivative osthole stimulates adult neural stem cells, promotes neurogenesis in the hippocampus, and ameliorates cognitive impairment in APP/PS1 transgenic mice[J]. Biol Pharm Bull, 2015, 38(9): 1290-301. doi:10.1248/bpb.b15-00142 |
| [12] | Yao Y, Gao Z, Liang W, et al. Osthole promotes neuronal differentiation and inhibits apoptosis via Wnt/β-catenin signaling in an Alzheimer's disease model[J]. Toxicol Appl Pharmacol, 2015, 289(3): 474-81. doi:10.1016/j.taap.2015.10.013 |
| [13] | Kwok J B, Li Q X, Hallupp M, et al. Novel Leu723Pro amyloid precursor protein mutation increases amyloid beta42(43) peptide levels and induces apoptosis[J]. Ann Neurol, 2000, 47(2): 249-53. doi:10.1002/(ISSN)1531-8249 |
| [14] | Citron M, Oltersdorf T, Haass C, et al. Mutation of the β-amyloid precursor protein in familial Alzheimer's disease increases β-protein production[J]. Nature, 1992, 360(6405): 672-4. doi:10.1038/360672a0 |
| [15] | Reichwald J, Danner S, Wiederhold K H, et al. Expression of complement system components during aging and amyloid deposition in APP transgenic mice[J]. J Neuroinflammation, 2009, 6: 35. doi:10.1186/1742-2094-6-35 |
| [16] | 李少恒, 教亚男, 姚璎珈, 等. 蛇床子素对感染APP基因的神经元突触的保护作用[J]. 中国药理学通报, 2015, 31(10): 1383-8. Li S H, Jiao Y N, Yao Y J, et al. Neuroprotective effect of osthole on neuron synapses infected APP gene[J]. Chin Pharmacol Bull, 2015, 31(10): 1383-8. doi:10.3969/j.issn.1001-1978.2015.10.012 |
| [17] | Brodney M A, Barreiro G, Ogilvie K, et al. Spirocyclic sulfamides as β-secretase 1(BACE-1) inhibitors for the treatment of Alzheimer's disease: utilization of structure based drug design, watermap, and CNS penetration studies to identify centrally efficacious inhibitors[J]. J Med Chem, 2012, 55(21): 9224-39. doi:10.1021/jm3009426 |
| [18] | Kimura R, Devi L, Ohno M. Partial reduction of BACE1 improves synaptic plasticity, recent and remote memories in Alzheimer's disease transgenic mice[J]. J Neurochem, 2010, 113(1): 248-61. doi:10.1111/jnc.2010.113.issue-1 |
| [19] | Wang W X, Rajeev B W, Stromberg A J, et al. The expression of microRNA miR-107 decreases early in Alzheimer's disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme 1[J]. J Neurosci, 2008, 28(5): 1213-23. doi:10.1523/JNEUROSCI.5065-07.2008 |
| [20] | Nelson P T, Wang W X. MiR-107 is reduced in Alzheimer's disease brain neocortex: validation study[J]. J Alzheimers Dis, 2010, 21(1): 75-9. doi:10.3233/JAD-2010-091603 |

