


2. 贵州医科大学附属医院神经内科,贵州 贵阳 550004;
3. 贵州医科大学基础医学院机能学实验室,贵州 贵阳 550025
2. Dept of Neurology, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China;
3. The Functional Science Laboratory, Basic Medical College, Guizhou Medical University, Guiyang 550025, China
新生儿窒息,或称为新生儿缺血/缺氧性脑损伤(hypoxic-ischemic encephapathy, HIE)是指由围产期引起的窒息脑损伤。新生儿窒息有较高的发病率,导致每年全国有约92万新生儿死亡[1]。已有研究学者证实,诱导机体炎症反应和组织损伤的主要分子是Toll样受体(Toll-like receptor, TLR)。Toll样受体是一类重要模式识别受体(pattern recognition receptors, PRRs),能够有效地识别非己成分自身而被活化,是连接适应性免疫应答与细胞免疫应答的关键蛋白[2]。本课题选用CpG-ODN是Toll样受体9(Toll-like receptor-9,TLR9) 的激动剂,可活化TLR9受体;CpG-ODN具有一系列重要的生物活性,能减弱脑缺血/再灌注损伤,从理论上推测这些生物活性对抗缺血/缺氧损伤应该是十分有益的[3]。目前CpG-ODN已被作为免疫调节剂用于临床,以及国外已将CpG-ODN用于非霍奇金淋巴瘤、脓毒血症、黑热病、肿瘤等实验研究[4]。将来我们如能证实TLR9激动剂CpG-ODN在减轻缺血/缺氧性脑损伤(hypoxic-ischemic brain damage,HIBD)中也有极其重要作用,这无疑为缺血/缺氧脑损伤治疗药物的研究带来新的方向。在缺血/缺氧性脑损伤中,许多胞内外信号通路和细胞因子参与其中,p38丝裂原蛋白激酶(p38 MAPK)是MAPK主要家族成员,其信号通路是把细胞外刺激转导到胞内中起重要作用,可能参与了细胞增殖、细胞周期调控、炎症、肿瘤及其他多种疾病密切相关[5]。本研究拟观察TLR9激动剂CpG-ODN在大鼠缺血/缺氧性脑损伤中的作用,探讨其与p38 MAPK信号通路的关系及诱导肿瘤坏死因子α(tumor necrosis factor, TNF-α)的分泌,为明确其在脑中的作用机制提供依据。
1 材料与方法 1.1 动物清洁级7 d新生Wistar大鼠,购自贵州医科大学实验动物中心,许可证号: SCXK(黔) 2012-0001,♀♂不限,体质量12 g~17 g。随机分为5组,每组10只,假手术组只行颈部手术,暴露左侧颈总动脉,不结扎,不缺氧;HIBD组接受完整的缺血手术及缺氧过程;CpG-ODN低、中、高剂量组建立HIBD模型后1 h给药。
1.2 试剂与药品p-p38 MAPK兔多克隆抗体(美国Abcam, 批号GR43541-12);TLR9兔多克隆抗体(美国Abcam, 批号GR2718-10);GAPDH兔多克隆抗体(Proteintech公司,批号10494-1-AP);辣根酶标记山羊抗兔IgG(北京中杉金桥公司,批号109525));10%水合氯醛(天津市大茂化学试剂厂,批号20150725);TNF-α酶联免疫(ELISA)试剂盒(深圳达科为生物技术有限责任公司,批号E3730-1611-2);8%氧气和92%氮气混合气体(贵阳同辉气体公司,批号11298);C型CpG-ODN:ODN D-SL03(美国InvivoGen公司)。
1.3 仪器密闭缺氧箱(自制直径15 cm,高20 cm),ELx800-ΜV型酶标仪(美国Bio-Tek公司),KJ-210A型振荡器(姜堰市康健医疗器具有限公司),2001HY-6003型CO2培养箱(美国Thermo Forma公司),ChemiDocTMXRS+型凝胶成像仪和ImageLab图像分析系统(美国Bio-Rad公司),DYY-7C型电泳仪(北京市六一仪器厂),IX71型显微镜(日本Olympus公司)。
1.4 给药方案给药组采用CpG-ODN滴鼻液:将合成的CpG-ODN粉末用去离子水配制成浓度为100 μmol ·L-1的储备液,使用时用PBS稀释到所需浓度,混匀;假手术组和模型组用相同体积生理盐水代替。各组全部采用微量注射器吸取生理盐水或者药物准确滴于乳鼠双侧前鼻孔内,每侧鼻孔给药低、中、高剂量,分别为0.35、1.40、5.60 mL·kg-1,术后1 h给药。
1.5 建立缺血/缺氧脑损伤模型选取7 d Wistar大鼠称重,♀♂不限,术前12 h禁食,不禁水。然后用10%水合氯醛腹腔注射麻醉(5 mL·kg-1)后,行颈正中切口,分离左侧颈总动脉后双重结扎,并从双重结扎线中间剪断血管,缝合切口。整个手术在显微镜下操作,待恢复90 min又将乳鼠放入密闭、透明的37℃缺氧箱中,并向缺氧箱中持续通入8%氧气和92%氮气混合气体,气流量1 L·min-1,维持缺氧2 h,待幼鼠苏醒后放回母鼠身边继续喂养。以乳鼠苏醒后爬行过程向左转圈, 提起尾时左前肢屈曲为造模成功标志。
1.6 乳鼠神经功能缺陷评分各组大鼠脑缺血/缺氧48 h后,参照Longa 5分制评分标准对各组大鼠进行神经功能行为评分:0分,无任何神经功能损失症状;1分,轻微局灶性神经功能损失(缺血/缺氧区对侧前肢伸展不完全);2分,中度局灶性神经功能损失(行走过程中,向缺血/缺氧区对侧转圈);3分,重度局灶性神经功能损失(行走过程中向缺血/缺氧区对侧倾倒);4分,不能自发行走,存在意识水平障碍;5分,大鼠死亡。
1.7 HE染色每组取5只大鼠,于手术后48 h,深麻醉下断头取脑组织,经10%甲醛溶液固定3 d后,常规取材、脱水、石蜡包埋、切片、HE染色,光镜观察病理结果。
1.8 Western blot法检测相关蛋白表达模型复制成功48 h后,将各组大鼠麻醉处死,每组取5只大鼠损伤侧大脑(右脑),称量,用剪刀将组织尽量剪碎,以适量RIPA裂解液(含蛋白酶抑制剂)吹打混匀,在冰上放置30 min(每隔10 min涡旋1次),4 ℃ 12 000 r·min-1离心15 min,取上清(总蛋白),-80 ℃保存,然后参照BCA蛋白浓度测定试剂盒说明书,测定脑组织裂解液中蛋白浓度。接着进行SDS-PAGE凝胶电泳,用12%分离胶,5%浓缩胶,BCA法测定蛋白浓度,每孔总蛋白上样量为30 μg,90V电泳30 min,120 V电泳90 min。PVDF膜转膜90 min,用TBST洗膜5 min×3次,5%BSA室温封闭1.5 h,加入一抗TLR9(1 :2 000)、p-p38 MAPK(1 :1 000),4℃过夜,TBST洗5 min×3次,加入羊抗兔的二抗(1 :5 000),常温孵育2 h,TBST洗5 min×3次,最后用配制化学发光检测底物工作液A液、B液按1 :1混匀,取适量滴加在PVDF膜上后,吸去多余发光底物工作液,在凝胶成像仪上曝光显色,并测定灰度值。
1.9 ELISA法检测TNF-α含量模型复制成功48 h后处死大鼠,称取脑组织约40 mg置于盛有冰醋酸缓冲液的玻璃匀浆器中,匀浆后将组织粉碎的悬浮液转至试管内,静置并离心取上清液,测定蛋白浓度。ELISA法测定TNF-α含量(试剂盒购自美国Sigma公司),测定方法严格按照ELISA试剂盒说明操作,设置3个复孔。
1.10 统计学分析结果用x±s表示,采用SPSS17.0软件,进行单因素方差分析(One-Way ANOVA),组间比较采用Dunnett法。
2 结果 2.1 神经功能行为缺陷评分手术后48 h,各组大鼠除假手术组外,均出现不同程度的神经功能缺失,如行走向对侧倾倒或旋转,提尾时缺血/缺氧脑区对侧前肢不能伸直等。Longa评分结果见Tab 1。各组进行比较表明,模型组、CpG-ODN高剂量组Longa评分高于假手术组(P<0.01);CpG-ODN低、中剂量预处理组Longa评分低于模型组(P<0.05)。
| Group | Dose/mL·kg-1 | Neuro-behavioral score |
| Sham | - | 0 |
| HIBD | - | 2.70±0.82* |
| CpG-ODN | 0.35 | 2.60±0.56* |
| 1.40 | 1.90±0.74*# | |
| 5.60 | 3.10±0.62* | |
| *P<0.05 vs sham; #P<0.05 vs HIBD | ||
光镜×400倍视野下,伊红染胞质呈粉色,苏木精染胞核呈蓝色。假手术组大脑皮层组织结构可见,未见明显病理改变,神经元及胶质细胞大小、形态、数量及排列正常规则,细胞核圆而大,核仁清晰,无明显水肿,极少见凋亡征象。模型组灶性区域大脑组织结构破坏,神经元及胶质细胞变性坏死伴炎细胞浸润及胶质细胞增生,胞质水肿,细胞核深染,固缩,细胞脱失明显,镜下可见凋亡细胞。TLR9激动剂CpG-ODN低、中剂量组神经元形态和排列较模型组有所改善,与假手术组的形态和排列相似,其中以中剂量组改善最为明显,相反,高剂量组神经元形态和排列与模型组相似,不能改善大脑损伤(Fig 1)。
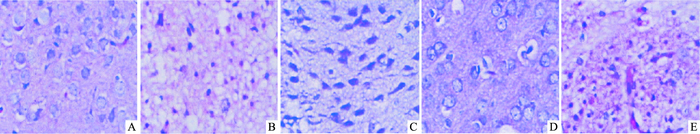
|
| Fig 1 The rat brain tissue (HE staining×400) A: Sham; B: HIBD group; C: CpG-ODN low group; D: CpG-ODN middle group; E: CpG-ODN high group |
MAPK蛋白表达如Fig 2所示,假手术组中大鼠脑组织中TLR9、p-p38 MAPK蛋白表达较少;与假手术组比较,模型组及CpG-ODN各剂量组大鼠脑组织中TLR9、p-p38 MAPK蛋白表达明显上调;与模型组比较,CpG-ODN中、高剂量组大鼠脑组织中TLR9、p-p38 MAPK蛋白表达明显上调;与CpG-ODN中剂量比较,CpG-ODN高剂量组大鼠脑组织中TLR9、p-p38 MAPK蛋白表达明显上调,差异具有统计学意义。
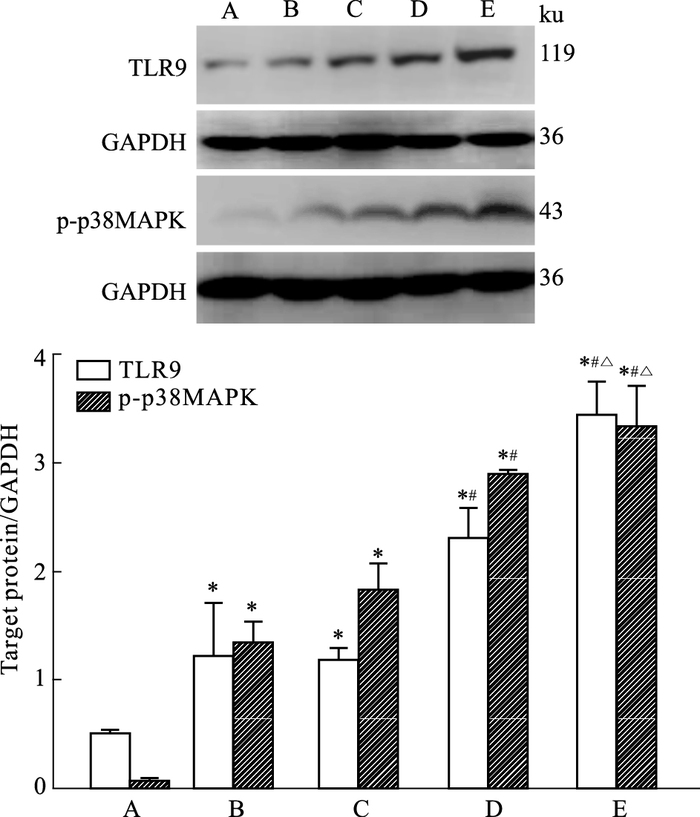
|
| Fig 2 Expression of target protein in rat brain A: Sham; B: HIBD group; C: CpG-ODN low group; D: CpG-ODN middle group; E: CpG-ODN high group.*P < 0.05 vs Sham group; #P < 0.05 vs HIBD group; △P < 0.05 vs CPG-ODN middle group. |
CpG-ODN低、中、高剂量组大鼠脑组织TNF-α表达高于假手术组和模型组,CpG-ODN高剂量组大鼠脑组织TNF-α表达高于低剂量组,差异具有统计学意义(Tab 2)。
| Group | Dose/mL·kg-1 | TNF-α/ng·L-1 |
| Sham | - | 96.83±6.34 |
| HIBD | - | 115.58±4.05* |
| CpG-ODN | 0.35 | 118.73±1.39* |
| 1.40 | 134.59±8.57*# | |
| 5.60 | 216.10±13.76*#△ | |
| *P<0.05 vs sham;#P<0.05 vs HIBD;△P<0.05 vs CpG-ODN middle | ||
HIE是指由于围产期缺氧窒息而导致的脑缺血缺氧性损伤,病死率高,即使存活可遗留不同程度的神经系统后遗症,包括脑瘫、癫痫、精神发育迟缓、注意力不集中、记忆力减退以及学习能力丧失等。基于其严重的临床后果,迫切需要对缺血/缺氧性脑损伤的机制进行深入的研究,进而发现有效的干预措施[6]。治疗HIE的手段通常有亚低温治疗、常规药物治疗、高压氧治疗等,但未见报道采用免疫剂进行治疗,本课题试图采用免疫刺激剂适度激活脑内p38 MAPK信号通路来减轻缺血/缺氧性脑损伤[7]。
TLR9属于TLRs家族之一,主要识别细菌DNA的CpG基序, 识别外源病原微生物的侵入,便可启动一系列信号传导,作为自身免疫系统的重要组成部分在炎症反应中扮演着不可或缺的角色。本课题选用TLR9激动剂CpG-ODN是人工模拟细菌DNA合成的寡聚核苷酸分子,具有细菌DNA的活性,能刺激免疫系统的活化并诱导哺乳动物产生免疫反应的寡核苷酸片段,其活化TLR9,然后通过信号传导激活B细胞、树突状细胞以及产生各种细胞因子,最终导致免疫网络自身抗体产生和自身抗体产生的失衡;同时也发现,把CpG换成CpG基序甲基化或者GpC均可使免疫模拟细菌DNA刺激作用消失[8]。在中枢神经系统中,胶质细胞尤其是小胶质细胞形成了中枢神经系统防御反应的第一防线。TLR9主要分布于小胶质细胞,还分布于星形胶质细胞和神经元上[9]。在此研究中,采用滴鼻剂给予外源配体CpG-ODN方式,主要刺激TLR9活化,清除病原体,此过程参与中枢神经系统免疫调节;由于血脑屏障是由内皮细胞紧密连接形成物理屏障,是中枢神经系统与外界组织交换的主要场所,所以可以阻挡大分子物质进入大脑内,限制脑与血之间的物质的交换,并在大脑微环境的稳定中起到重要作用;虽然新生大鼠大脑发育不完全,血脑屏障通透性相对较高,但此药是否能够通过血脑屏障还不能确定,所以本研究采用鼻式给药,使药物避开血脑脊液屏障到达中枢神经系统,提高药物在中枢神经系统的有效浓度[10]。
丝裂原活化蛋白激酶(MAPK)是细胞内的一类丝/苏氨酸蛋白激酶,广泛存在与大多数哺乳动物中,可以被一系列的细胞外信号刺激,例如生长因子、物理应激、炎性细胞因子、生长因子、细菌复合物等所激活,MAPK激活后进入细胞核发挥作用,并引起细胞生物学反应,调节细胞的增殖、分化、发育和凋亡,所以MAPK信号通路在细胞生长分裂、分化及凋亡的调节中起到重要的作用。MAPK家族主要包括3个成员:细胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 MAPK。ERK主要参与细胞增殖、分化、发育等;JNK和p38则更多地参与应激反应、炎症反应、纤维化、细胞的凋亡等,属于应激激活蛋白激酶[11]。p38 MAPK是MAPK家族中的重要成员,激活p38 MAPK通路,诱导p38 MAPK的磷酸化可使胰腺癌的细胞凋亡,还可以保护心脏缺血/再灌注损伤脑缺血/缺氧损伤,但如果过度活化将反而促进炎症反应,加快心肌细胞凋亡[12]。本实验研究表明,缺血/缺氧性脑损伤新生大鼠在免疫刺激剂CpG-ODN作用下,TLR9受体被激活,受体与药物相结合,空间结构发生变化,通过胞内TIR区域招募衔接蛋白MyD88依赖途径进行信号传导,其中信号传导环节会涉及到MAPK的激活,于是我们通过Western blot检测发现p-p38 MAPK蛋白随之上调,说明p38 MAPK信号通路在此过程也被激活,此结果与文献报道一致[13]。
同时研究表明,p38 MAPK激活后磷酸化的p38 MAPK会分泌炎症因子诱发免疫反应[14]。我们通过ELISA实验检测,其下游的TNF-α随给药剂量的增加而逐渐上调。TNF-α是一种生物作用非常广泛的细胞因子,由单巨噬细胞产生,有免疫调节作用,参与发热和炎症反应等功能,具有很强的抗炎和抗肿瘤作用。TNF-α的水平和许多疾病的诊断、分期及预后都有很密切的关系,在体内,TNF-α起到双刃剑的作用,一方面,若其适度表达,则可以激活机体的抗感染免疫,增强免疫细胞吞噬和清除外界微生物的能力,还能诱导肿瘤细胞的凋亡。相反,如果TNF-α过度表达,便会造成机体免疫系统的紊乱,导致机体免疫平衡的破坏,产生机体组织的损伤,导致多种疾病的发生[15]。
实验发现,TLR9激动剂CpG-ODN低、中剂量可能通过刺激TLR9的表达,进一步适度激活p38 MAPK信号传导通路,使p38 MAPK磷酸化,分泌适量炎症细胞因子发挥抗炎症反应,从而减轻大脑缺血/缺氧性脑损伤,与CpG-ODN中剂量相比,高剂量组由于过度激活了p38 MAPK信号传导通路,分泌大量炎症细胞因子加重炎症反应的进行。本研究从7日龄大鼠的角度证实了TLR9激动剂CpG-ODN中剂量对损伤大脑具有明显的保护作用,并探讨了p38 MAPK信号通路在CpG-ODN干预大脑缺血/缺氧损伤中的作用,从而筛选出最佳治疗剂量组,为缺血/缺氧性脑损伤治疗提供了可能的实验依据。
| [1] | Lai M C, Yang S N. Perinatal hypoxic-ischemic encephalopathy[J]. J Biomed Biotechnol, 2011, 2011: 609813. |
| [2] | 潘一菲, 陈克研, 张铁铮, 等. TLR9信号通路介导缺血性脑损伤的研究进展[J]. 现代生物医学进展, 2015, 15(15): 2985-8. Pan Y F, Chen K Y, Zhang T Z, et al. Toll-like receptor 9 signaling pathways mediating ischemic brain injury[J]. Prog Mod Biomed Dalian Med, 2015, 15(15): 2985-8. |
| [3] | Lu C, Ha T, Wang X, et al. The TLR9 ligand, CpG-ODN, induces protection against cerebral ischemia/reperfusion injury via activation of PI3K/Akt signaling[J]. J Am Heart Assoc, 2014, 187(3): 1458. |
| [4] | Das S, Rani M, Rabidas V, et al. TLR9 and MyD88 are crucial for the maturation and activation of dendritic cells by paromomycin-miltefosine combination therapy in visceral leishmaniasis[J]. Br J Pharmacol, 2014, 171(5): 1260-74. doi:10.1111/bph.12530 |
| [5] | 谢丽萍, 代志刚, 王胜, 等. 舒芬太尼预处理在大鼠肝缺血/再灌注损伤中的作用及其与p38 MAPK关系的研究[J]. 重庆医学, 2014, 43(23): 3037-9. Xie L P, Dai Z G, Wang S, et al. Protective effect and mechanism of sufentanii prec0nditioning on hepatic ischemia/reperfusion injury:by activating p38 mitogen-activated protein kinases signal pathway[J]. Chongqing Med, 2014, 43(23): 3037-9. doi:10.3969/j.issn.1671-8348.2014.23.022 |
| [6] | Perlman J M. Intervention strategies for neonatal hypoxic-ischemic cerebral injury[J]. Clin Ther, 2006, 28(9): 1353-65. doi:10.1016/j.clinthera.2006.09.005 |
| [7] | 郭秀春, 赵世刚. 缺血/缺氧性脑病治疗研究进展[J]. 内蒙古医学杂志, 2015, 47(7): 813-5. Guo X C, Zhao S G. Hypoxic/ischemia encephalopathy treatment is reviewed[J]. Inner Mongolia Med J, 2015, 47(7): 813-5. |
| [8] | Chockalingam A, Brooks J C, Cameron J L, et al. TLR9 traffics through the Golgi complex to localize to endolysosomes and respond to CpG DNA[J]. Immunol Cell Biol, 2008, 87(3): 209. |
| [9] | Jack C S, Arbour N, Manusow J, et al. TLR signaling tailors innate immune responses in human microglia and astrocytes[J]. J Immunol, 2005, 175(7): 4320. doi:10.4049/jimmunol.175.7.4320 |
| [10] | 卢保霞. 血管内皮生长因子不同时间段经鼻给予新生大鼠缺血/缺氧性脑损伤模型后对神经系统恢复效果的研究[D]. 蚌埠: 蚌埠医学院, 2012. Lu B X. Research on effect of the nervous system after exogenous VEGF given to the newborn rats of HIBD through the nose at different times[D]. Bengbu:Bengbu Medical College, 2012. |
| [11] | 茆家定. MAPK信号转导通路在胃泌素调节大肠癌生长中的作用及其分子机制研究[D]. 苏州: 苏州大学, 2013. Mao J D. Role of MAPK signaling pathway in gastrin-regulated growth of large intestinal cancer and molecular mechanisms study[D]. Suzhou:Suzhou University, 2013 |
| [12] | 刘丹, 尹东, 廖章萍, 等. p38 MAPK/14-3-3γ通路在LPS预处理对抗心肌细胞缺氧/复氧损伤中的作用[J]. 中国药理学通报, 2012, 28(9): 1239-43. Liu D, Yun D, Liao Z P, et al. P38 MAPK / 14-3-3γ pathways in LPS pretreatment against the role of myocardial cell hypoxia/reoxygenation injury[J]. Chin Pharmacol Bull, 2012, 28(9): 1239-43. |
| [13] | 费广茹, 任涛. 肿瘤细胞固有Toll样受体9信号通路的研究进展[J]. 国际肿瘤学杂志, 2012, 39(11): 834-7. Fei G R, Ren T. Research progress of TLR9 inherent signaling pathways in tumor cells[J]. Int J Oncol, 2012, 39(11): 834-7. doi:10.3760/cma.j.issn.1673-422X.2012.011.011 |
| [14] | 段志敏, 杜蕾蕾, 曾荣, 等. 白念珠菌对人急性单核细胞白血病细胞系产生肿瘤坏死因子α、活化信号分子p38 MAPK的影响[J]. 中华皮肤科杂志, 2015, 48(8): 535-8. Duan Z M, Du L L, Zeng R, et al. Effects of Candida albicans on the expression of tumor necrosis factor-α and activation of the intracellular signaling molecule p38 MAPK in a human acute monocytie cell line THP-1[J]. Chin J Dermatol, 2015, 48(8): 535-8. |
| [15] | 王爱忠. 急性肾衰发病机制及肾保护研究新进展[J]. 国外医学麻醉学与复苏分册, 2000, 21(2): 86. Wang A Z. The pathogenesis of acute renal failure and renal protection and research progress[J]. Arch Foreign Med Anesthesiol Recover, 2000, 21(2): 86. |

