


缺血性脑卒中可导致脑损伤,是引起死亡和残疾的主要原因[1]。急性脑缺血半暗带损伤的机制很多,但这些分子机制之间的相互作用目前尚不十分清楚[2]。溶栓及时恢复血供是治疗缺血性脑卒中的一种有效的治疗方式。然而,溶栓再灌注疗法通常会带来细胞生化及代谢等问题,包括活性氧过量产生、钙超载、线粒体损伤和细胞死亡,最终导致不可逆性的再灌注损伤[3]。而过量的活性氧作为细胞凋亡的一种刺激,可触发线粒体凋亡途径,致cyto C等凋亡因子的释放[4]。一旦释放入胞质中,cyto C会激活下游caspase家族。其中,caspase-9是重要的启动器,参与cyto C依赖性的caspase级联反应,而caspase-3则参与凋亡信号的转导。
《本草纲目》记载:胡黄连味苦性寒,具有“清热燥湿”作用。《本草经疏》曰:胡黄连“大寒至苦,极清之性,能清热,一切湿热、邪热、阴分伏热所生诸病,莫不消除”。现代医学研究表明,西藏胡黄连提取物含有胡黄连苷Ⅰ、Ⅱ、Ⅲ 3种环烯醚萜苷,其中胡黄连苷Ⅱ为主要有效成分,含有邻苯二酚基结构,具有较好的抗氧化作用。本课题组前期研究探讨胡黄连苷Ⅱ时间效应窗[5],在脑缺血半暗带损伤中具有抗炎[6-7]、抗氧化[8]、抑制神经凋亡的作用[9-10],然而,其保护神经细胞的机制还有待研究。由于cyto C/caspase-9/caspase-3信号通路在神经细胞的凋亡中起重要作用,本实验以此为切入点,进一步探讨胡黄连苷Ⅱ对脑缺血/再灌注半暗带损伤的保护作用机制。
1 材料与方法 1.1 缺血/再灌注模型制备健康成年Wistar ♂大鼠120只,体质量240~270 g,SPF级,青岛市药品检验所实验动物中心[SCXK (鲁)20100010]提供。大鼠术前禁食12 h,水合氯醛溶液 (100 g·L-1) 麻醉后固定于手术台。用牙科钻定位 (前囟左旁开5 mm、向后3 mm) 钻孔至硬脑膜,将激光多普勒血流检测仪 (PE-5001,Swedan) 探头经孔固定在硬脑膜上,记录左侧大脑中动脉供血区的血流变化,应用线栓法[11]制备缺血/再灌注 (I/R) 模型,缺血2 h时后,拔出线栓实现24 h再灌注。模型成功标准:插入线栓后,局部脑血流量峰值降到插线前的30%及以下,拔出线栓后,rCBF恢复至插线前的80%及以上为模型成功的标准。造模成功的96只大鼠随机分为假手术组 (Sham)、模型组 (Model)、治疗组Ⅱ组 (Treatment)、阳性对照药组 (Positive)、阳性对照药+治疗组 (Positive+Treatment)、阴性对照药组 (Negative)、阴性对照药+治疗组 (Negative+Treatment)、溶媒组 (DMSO),每组12只。
1.2 干预措施假手术组线栓进入颈内动脉10 mm后即刻退出。模型组建立模型,缺血2 h拔线栓后,腹腔注射生理盐水0.5 mL。治疗组将胡黄连苷Ⅱ(天津奎青有限公司) 配制为10 g·L-1的溶液,在缺血2 h拔线栓时,腹腔注射胡黄连苷Ⅱ溶液 (20 mg·kg-1)。阳性对照药组将环孢素A (CsA,Selleck公司) 用DMSO配制成2 μmol·L-1的溶液,再灌注前15 min侧脑室注射5 μL (脑立体定向仪,江湾Ⅰ型C,上海第二军医大学修配厂)。阳性对照药+治疗组与阳性对照药组相同,CsA溶液注射结束后,给予胡黄连苷Ⅱ溶液。阴性对照药组苍术苷 (Atr,上海同田生物技术有限公司) 用生理盐水配制成2 mmol·L-1的溶液,再灌注前15 min侧脑室注射5 μL。阴性对照药+治疗组与阴性对照药组相同,Atr溶液注射结束后,给予胡黄连苷Ⅱ溶液。溶媒组,再灌注前15 min侧脑室注射DMSO溶液5 μL。
1.3 脑梗死体积测量 (TTC)每组取4只动物,脑缺血/再灌注24 h后,水合氯醛溶液 (100 g·L-1) 腹腔注射麻醉,断头取脑。生理盐水将脑冲洗干净,置于脑模具中。-20℃冷冻10 min后,自前向后连续冠状切面切片 (每片2 mm),每个脑切5片,置于20 g·L-1的TTC磷酸盐溶液中,37℃孵育10 min。数码相机拍照,采用Adobe PhotoShop CS测量脑梗死体积。脑梗死体积 (cerebral infract volume,CIV)=经过视交叉平面的脑梗死面积/该层对侧半球面积。
1.4 免疫组化每组取4只动物,于缺血2 h再灌注24 h后,水合氯醛溶液 (100 g·L-1) 麻醉后,心脏灌注生理盐水和多聚甲醛溶液 (40 g·L-1) 各200 mL,取缺血部位脑组织。将组织置于多聚甲醛溶液 (40 g·L-1) 中固定2 h,蒸馏水浸泡4 h。常规脱水、透明、浸蜡、包埋。石蜡切片机连续冠状切片,每片厚5 μm,贴于载玻片上,常温保存。石蜡切片常规脱蜡、水化后,按二步法免疫组化试剂盒 (北京中杉金桥生物公司) 进行染色。胞质出现棕黄色颗粒者为阳性细胞,阴性对照以PBS替代抗体,不出现阳性细胞。在400倍显微镜下进行观察,每张切片随机观察5个不重叠视野,计数阳性细胞数 (PCI=阳性细胞数/细胞总数),取其均值。
1.5 浆蛋白提取每组取4只动物,缺血2 h再灌注24 h后,水合氯醛溶液腹腔注射麻醉,经心脏灌注生理盐水200 mL。每组取新鲜缺血脑组织100 mg,剩余冻存,用于总蛋白提取。根据线粒体/胞质制备试剂盒 (C3606,碧云天生物公司) 提取浆蛋白。将100 mg新鲜缺血脑组织剪碎,放入小容量玻璃匀浆器内,按1 :10(重量:体积) 加入添加蛋白酶抑制剂的分离液A,600×g,4℃离心10 min。取上清,11 000×g,4℃离心15 min。将上清再次12 000×g,4℃离心15 min,取上清为浆蛋白。取少量BCA检测蛋白浓度,剩余加入SDS-PAGE Sample Loading Buffer (5×) 混匀,置于97℃水浴8 min,冷却后-20℃保存。
1.6 总蛋白提取和Western blot分析取上述脑组织各100 mg,按组织与细胞裂解液10 mg :100 μL的比例加入细胞裂解液 (碧云天生物公司),置于冰上研磨。10 949×g,4℃离心15 min后取上清,BCA检测蛋白浓度,剩余加入SDS-PAGE Sample Loading Buffer (5×) 混匀,置于97℃水浴8 min,冷却后-20℃保存。各组均取样品20 μg,10% SDS-PAGE凝胶电泳分离,湿转法转至NC膜 (66485,Pall Corporation,USA),5% BSA室温封闭2 h,加入cyto C (1 :5 000)、caspase-9(1 :2 000)、caspase-3(1 :2 000)、β-actin (1 :3 000) 一抗,4℃过夜。HRP标记的山羊抗兔二抗 (1 :2 000) 室温孵育1.5 h,凝胶成像分析系统 (Biospectrum 810 Imaging system,UVP,USA) 测定各条带的灰度值。计算各目的蛋白的相对灰度值 (relative value of protein,RVP)。
1.7 统计学处理所有数据均采用SPSS11.0软件进行统计学分析。实验结果以x±s表示,多组间比较采用单因素方差分析,两两之间比较采用最小显著差数法 (LSD)。
2 结果 2.1 脑梗死体积方差分析显示,不同处理组之间对I/R大鼠的脑梗死体积差异有统计学意义 (F=33.87,P<0.05),I/R组、阴性对照药组、溶媒组梗死体积明显高于其他处理组。LSD两两比较显示 (Fig 1):假手术组大鼠未见脑梗死;模型组大鼠可见明显梗死灶,与假手术组相比差异有统计学意义 (t=12.21,P<0.05);治疗组大鼠脑梗死体积明显缩小,与模型组相比差异有统计学意义 (t=4.61,P<0.05);阴性对照药组大鼠梗死灶明显,阴性对照药+治疗组与阴性对照药组相比,梗死体积明显缩小 (t=4.01,P<0.05)。

|
| Fig 1 Effect of picroside Ⅱ on the infarct area A: TTC staining showed the effect of picroside Ⅱ on cerebral infarct area; B: The quantification results of TTC staining. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
方差分析示不同组别之间差异有统计学意义 (F=22.86,P<0.05)。LSD显示 (Fig 2):假手术组大鼠神经细胞胞质cyto C蛋白表达微弱,着色较浅。模型组大鼠胞质cyto C蛋白表达明显增多,阳性细胞数多于假手术组 (t=9.80,P<0.05)。治疗组大鼠胞质cyto C蛋白表达明显低于模型组 (t=4.06,P<0.05)。阴性对照组大鼠阳性细胞较多,阴性对照+治疗组与阴性对照组相比阳性细胞数减少,差异有有统计学意义 (t=3.90,P<0.05)。
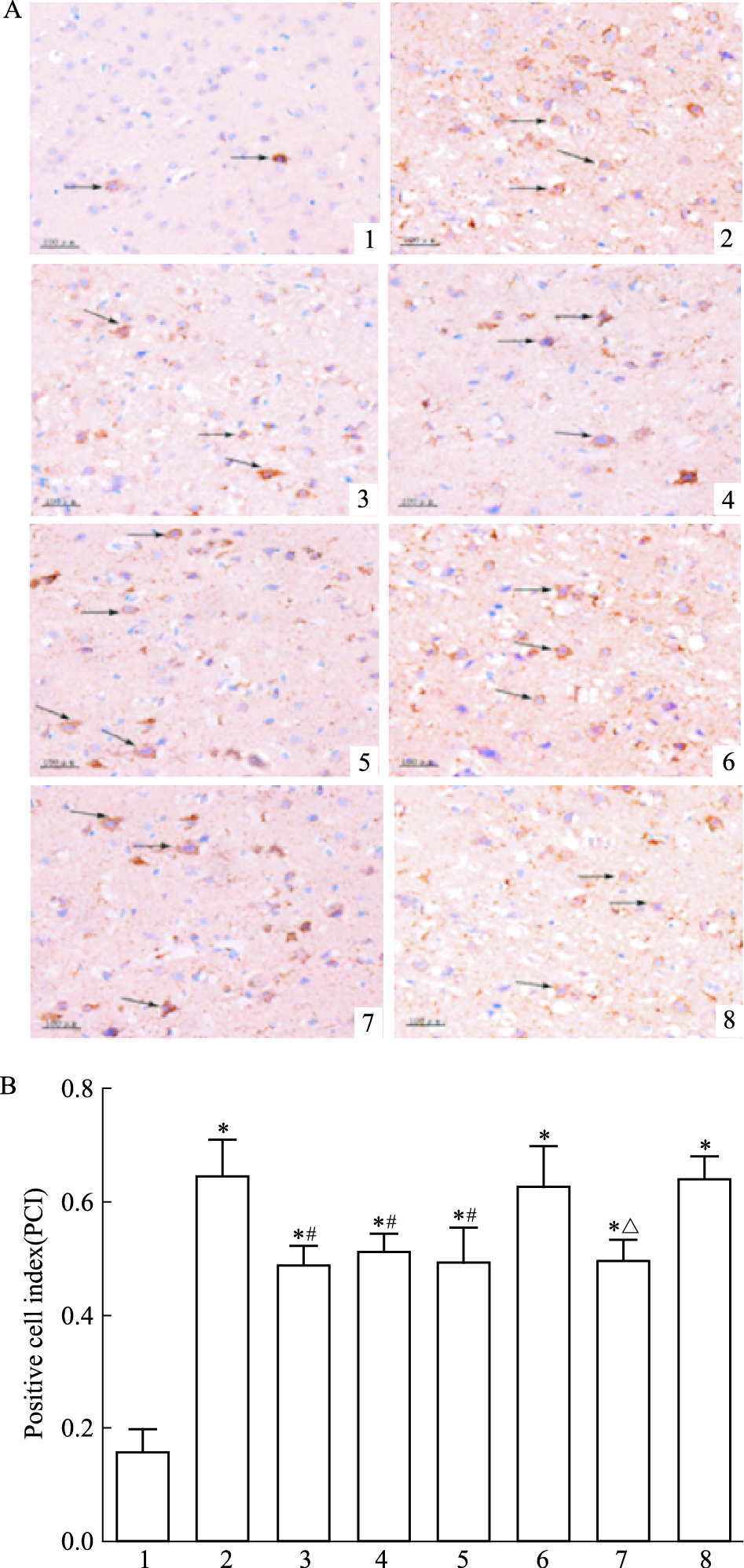
|
| Fig 2 Effect of picroside Ⅱ on cyto C expression in I/R rats (×400) A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on cyto C expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
方差分析可见不同处理组之间存在差异 (F=15.55,P<0.05)。LSD两两比较显示 (Fig 3):假手术组大鼠神经细胞caspase-9蛋白表达较弱,着色不明显;模型组大脑皮层可见明显棕黄色颗粒的caspase-9阳性细胞,数目较多,蛋白表达较假手术组明显增强 (t=7.95,P<0.05);治疗组脑组织中caspase-9阳性细胞数量减少,表达减弱,与模型组相比差异有统计学意义 (t=4.08,P<0.05);阴性对照组大鼠皮质区细胞大量神经细胞固缩深染,空洞较多,可见明显棕黄色颗粒的caspase-9阳性细胞;阴性对照+治疗组阳性细胞数量下降,与阴性对照组相比差异有统计学意义 (t=4.08,P<0.05)。
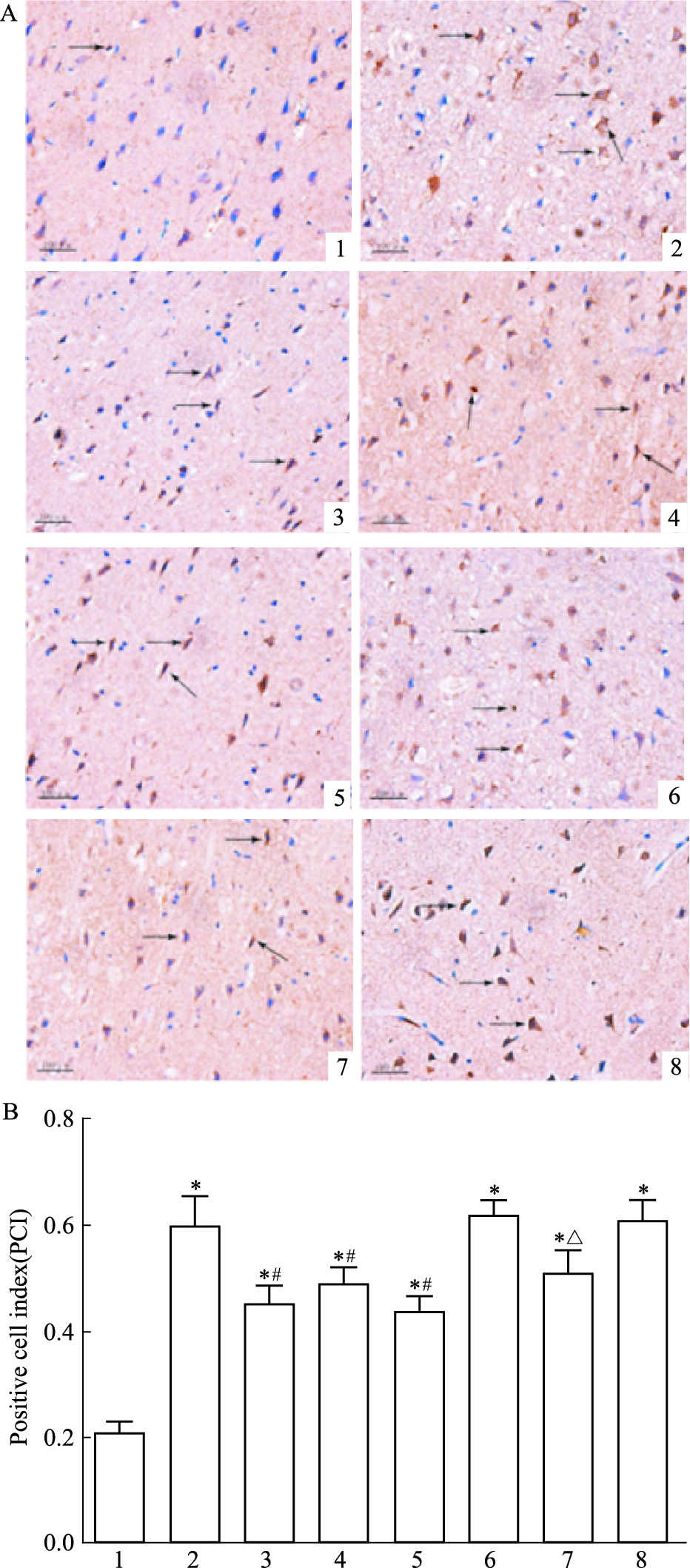
|
| Fig 3 Effect of picroside Ⅱ on caspase-9 expression in I/R rats (×400) A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on caspase-9 expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
方差分析可见不同处理组之间存在差异 (F=21.92,P<0.05)。LSD两两比较显示 (Fig 4):假手术组大鼠皮质区神经细胞见少量阳性caspase-3蛋白表达;模型组大鼠皮层可见明显增多的caspase-3蛋白,表达量较多,明显高于假手术组 (t=9.83,P<0.05);治疗组阳性细胞表达量变弱,与模型组相比差异有统计学意义 (t=4.59,P<0.05);阴性对照组蛋白表达量明显升高,阴性对照+治疗组与阴性对照组相比差异有统计学意义 (t=3.89,P<0.05)。
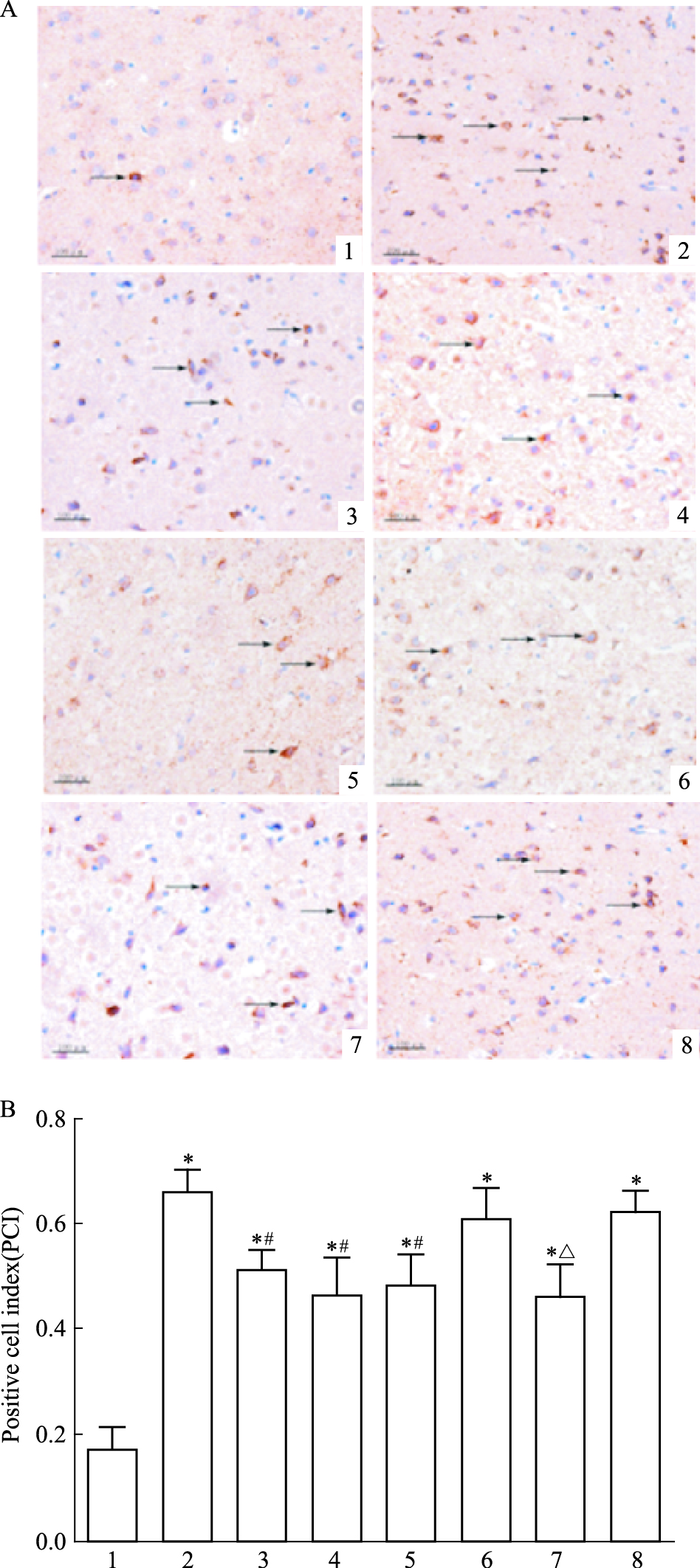
|
| Fig 4 Effect of picroside Ⅱ on caspase-3 expression in I/R rats (×400) A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on caspase-3 expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
Cyto C蛋白表达采用胞质细胞提取法。方差分析可见不同处理组之间存在差异 (F=17.20,P<0.05)。LSD两两比较显示 (Fig 5):假手术组大鼠可见少量cyto C表达。模型组大鼠cyto C蛋白表达量明显上升,与假手术组相比差异有统计学意义 (t=8.53,P<0.05)。治疗组cyto C表达量下降,与模型组相比差异有统计学意义 (t=4.39,P<0.05)。阴性对照组cyto C含量明显增多;阴性对照+治疗组cyto C表达量明显下降,与阴性对照组相比差异有统计学意义 (t=3.93,P<0.05)。
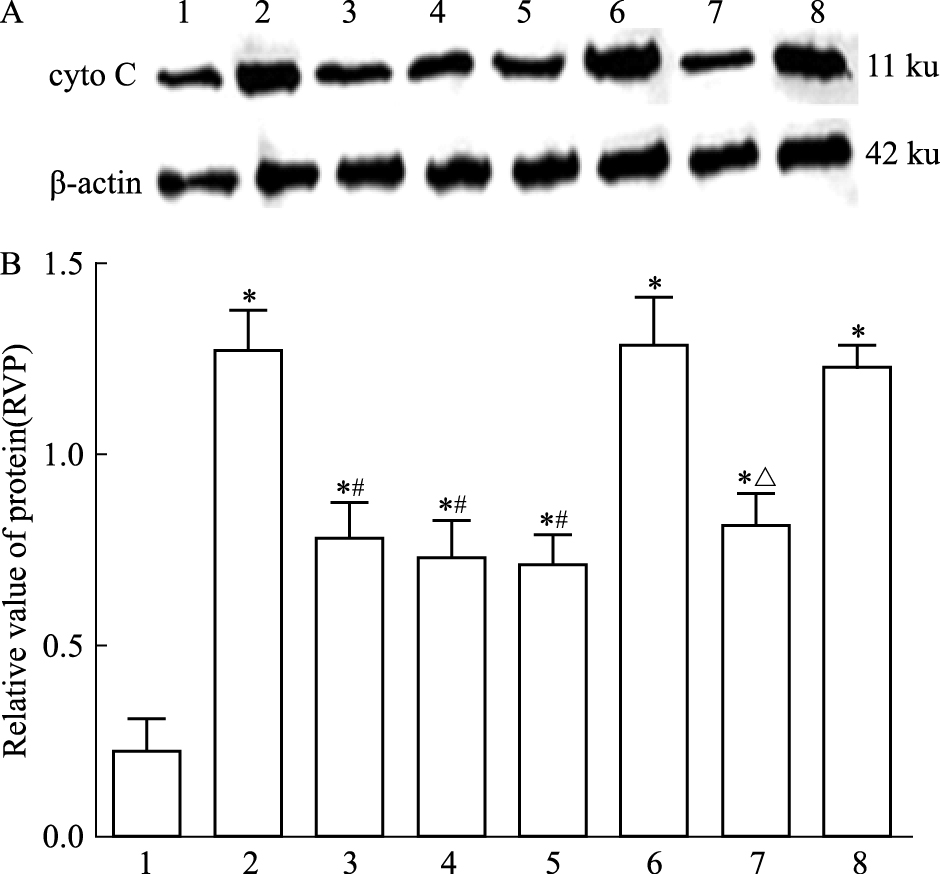
|
| Fig 5 Cytosol cyto C expression in I/R rats by Western blot A: Western blot assay of cytosol cyto C expression; B: Bar graph showed the relative amounts of cytosol cyto C normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
方差分析可见不同处理组之间差异有统计学意义 (F=20.34,P<0.05)。LSD两两比较显示 (Fig 6):假手术组caspase-9蛋白表达量低;模型组大鼠caspase-9蛋白表达量较高,与假手术组相比差异有统计学意义 (t=8.91,P<0.05);治疗组caspase-9表达量下降明显,与模型组相比差异有统计学意义 (t=5.11,P<0.05);阴性对照+治疗组caspase-9表达量明显下降,与阴性组相比差异有统计学意义 (t=4.40,P<0.05)。
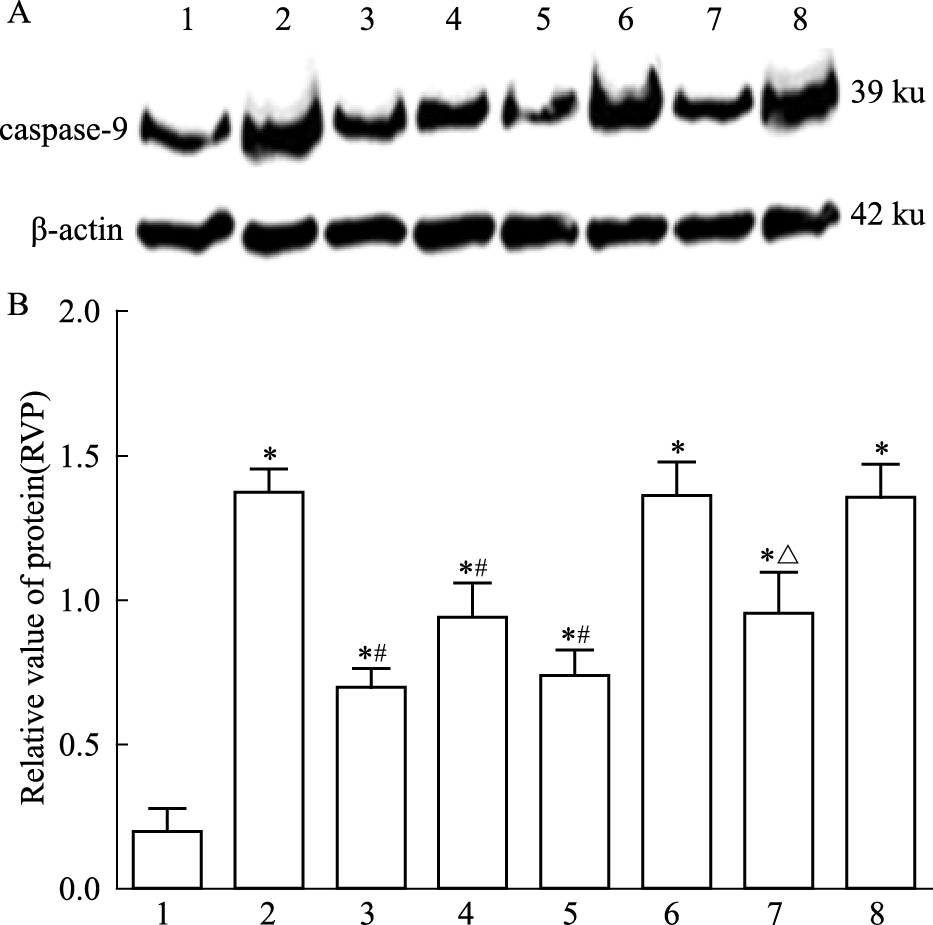
|
| Fig 6 Caspase-9 expression in I/R rats by Western blot A: Western blot assay of caspase-9 expression; B: Bar graph showed the relative amounts of caspase-9 normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
方差分析可见不同处理组之间存在差异 (F=16.34,P<0.05)。LSD两两比较显示 (Fig 7):假手术组大鼠caspase-3表达量较少。模型组蛋白表达上升,与假手术组相比差异有统计学意义 (t=8.18,P<0.05)。治疗组表达明显降低,与模型组相比差异有统计学意义 (t=4.14,P<0.05)。阴性对照+治疗组蛋白表达量明显降低,与阴性对照组相比差异有统计学意义 (t=4.81,P<0.05)。
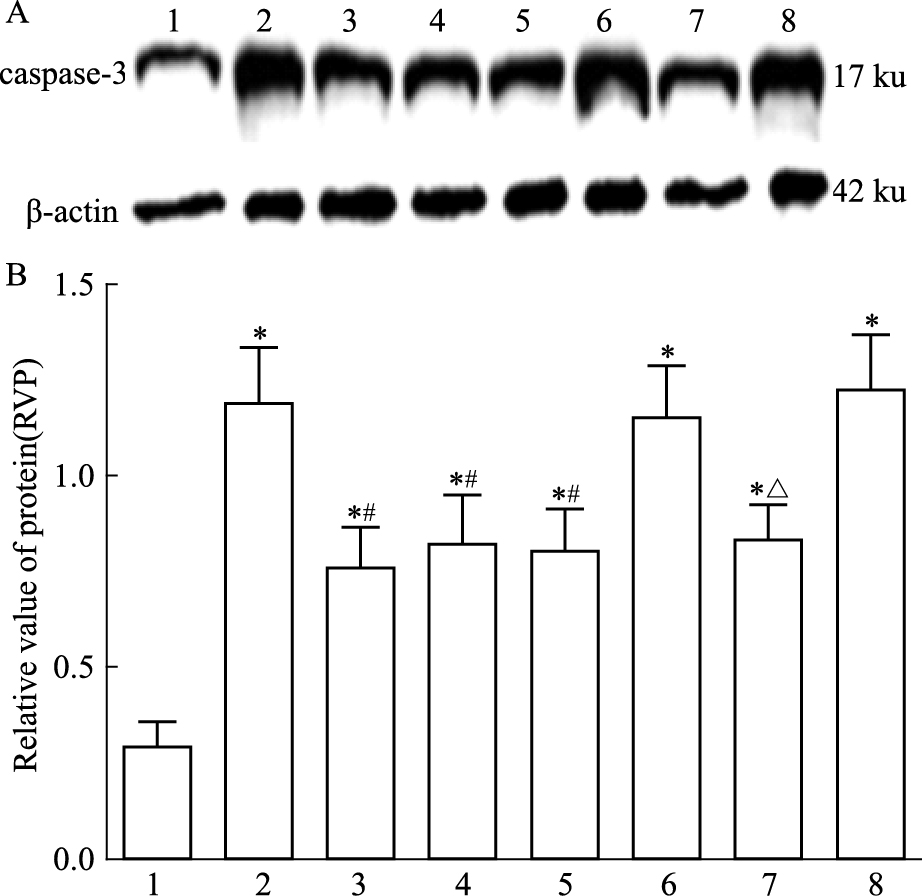
|
| Fig 7 Caspase-3 expression in I/R rats by Western blot A: Western blot assay of caspase-3 expression; B: Bar graph showed the relative amounts of caspase-3 normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs Atr group |
脑缺血/再灌注时,cyto C从线粒体释放入胞质引起caspase级联反应是启动凋亡程序的关键。cyto C一旦释放入胞质,即可与Apaf-1和pro-caspase-9结合形成凋亡体,激活caspase-3, 这对于缺血后神经细胞凋亡极其重要。Xing等[12]的研究表明,对于MCAO模型,缺血后处理会降低线粒体cyto C释放入胞质和caspase-3的活性,这与本实验结果一致。崔耀梅等[13]研究表明,在脑缺血/再灌注中,cyto C的释放及其下游因子的激活与MPTP的开放有关。于丽等[14]研究表明,抑制NADPH氧化酶,减少ROS的产生,对脑缺血/再灌注损伤起保护作用。以上研究说明,减少ROS及抑制MPTP的开放及cyto C的释放,对脑缺血/再灌注损伤具有保护作用。
由于caspases可自我活化并能相互激活,因此凋亡过程一旦激活,即呈级联放大作用。许多研究着力于caspases家族,以抑制caspases级联式反应作为开发治疗脑缺血药物的重点[15-16]。Caspase-9是线粒体凋亡途径中的一个必须始动子,而caspase-3是调节凋亡的关键蛋白。然而,仅通过抑制caspases来保护神经细胞是暂时的,因为线粒体通透性一旦不可逆增加,细胞凋亡将不依赖于caspases继续发生。cyto C的释放从侧面反映出线粒体通透性程度,胞质中cyto C的减少,会对凋亡体产生影响,从而使caspase-3激活受到影响,发挥保护神经细胞的作用。
环孢素A可特异性抑制cyto C的释放,故选为阳性对照药。苍术苷为cyto C的选择性激动剂,故选为阴性对照药。本实验证实,在大鼠脑缺血/再灌注模型中,环孢素A可明显抑制cyto C的表达,而苍术苷对cyto C的表达则未见明显作用。
本实验结果示,脑缺血/再灌注中,胡黄连苷Ⅱ能明显减小脑梗死体积,由此推测其对脑缺血半暗带有一定的保护作用。胡黄连苷Ⅱ对cyto C的抑制作用明显,与环孢素A相比未见明显统计学差异,这从侧面反映胡黄连苷Ⅱ对于凋亡体形成的抑制作用,其机制尚待进一步研究。胡黄连苷Ⅱ可下调caspase-9和caspase-3的表达水平,这可能与其抑制上游cyto C有关。环孢素A作为cyto C的特异性抑制剂,与胡黄连苷Ⅱ联合应用未见协同作用,其原因可能与胡黄连苷Ⅱ受体竞争性更强和胡黄连苷Ⅱ的药物浓度适中有关。苍术苷是cyto C的激动剂,与环孢素A和胡黄连苷Ⅱ的保护作用相反。本文CsA与Atr的结果与Sun等[17]结果相一致。
本研究尚存在不足之处,例如Atr组与模型组相比,脑梗死体积等不具有统计学意义;CsA组与胡黄连苷Ⅱ+CsA组比较,其梗死体积等无统计学意义。上述情况可能与以下因素有关:① 造模过程中,再灌注时间较长,不需要加激动剂通路已完全激活;② 受体饱和性,胡黄连苷Ⅱ与受体结合强,当联合用药时未发挥协同作用,尚需进一步研究。
| [1] | Go A S, Mozaffarian D, Roger V L, et al. Executive summary: heart disease and stroke statistics—2014 update: a report from the American Heart Association[J]. Circulation, 2014, 129(3): 399-410. doi:10.1161/01.cir.0000442015.53336.12 |
| [2] | Hinzman J M, Thomas T C, Quintero J E, et al. Disruptions in the regulation of extracellular glutamate by neurons and glia in the rat striatum two days after diffuse brain injury[J]. J Neurotrauma, 2012, 29(6): 1197-2208. doi:10.1089/neu.2011.2261 |
| [3] | Palencia G, Ortizplata A, Sotelo J. Anti-apoptotic, anti-oxidant, and anti-inflammatory effects of thalidomide on cerebral ischemia/reperfusion injury in rats[J]. J Neurol Sci, 2015, 351(1-2): 78-87. doi:10.1016/j.jns.2015.02.043 |
| [4] | Drse S, Brandt U, Wittig I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation[J]. Biochim Biophys Acta, 2014, 1844(8): 1344-54. doi:10.1016/j.bbapap.2014.02.006 |
| [5] | 李红云, 赵丽, 宿希, 等. 胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨[J]. 中国药理学通报, 2012, 28(4): 549-53. Li H Y, Zhao L, Su X, et al. Primary study on the therapeutic dose and time window of picroside Ⅱ in cerebral ischemic injury in rats[J]. Chin Pharmacol Bull, 2012, 28(4): 549-53. |
| [6] | Wang T T, Zhai L, Guo Y L, et al. Picroside Ⅱ has a neuroprotective effect by inhibiting ERK1/2 activation after cerebral ischemic injury in rats[J]. Clin Exp Pharmacol Physiol, 2015, 42(7): 930-9. |
| [7] | Wang T T, Zhai L, Zhang H Y, et al. Picroside Ⅱ inhibits the MEK-ERK1/2-COX2 signal pathway to prevent cerebral ischemic injury in rats[J]. J Mol Neurosci, 2015, 57(3): 335-51. doi:10.1007/s12031-015-0623-5 |
| [8] | Wang L, Liu X H, Chen H, et al. Picroside Ⅱ protects rat kidney against ischemia/ reperfusion-induced oxidative stress and inflammation by the TLR4/NF-κB pathway[J]. Exp Ther Med, 2015, 9(4): 1253-8. |
| [9] | Wang T T, Zhao L, Guo Y L, et al. Picroside Ⅱ inhibits neuronal apoptosis and improves the morphology and structure of brain tissue following cerebral ischemic injury in rats[J]. PLoS One, 2015, 10(4): e0124099. doi:10.1371/journal.pone.0124099 |
| [10] | 王婷婷, 赵丽, 李晓丹, 等. 胡黄连苷Ⅱ对脑缺血损伤后神经细胞凋亡和超微结构的影响[J]. 中国药理学通报, 2015, 31(3): 400-6. Wang T T, Zhao L, Li X D, et al. Effect of picroside Ⅱ on neuronal apoptosis and ultrastructure in cerebral ischemic injury in rats[J]. Chin Pharmacol Bull, 2015, 31(3): 400-6. |
| [11] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [12] | Xing B, Chen H, Zhang M, et al. Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J]. Stroke, 2008, 39(8): 2362-9. doi:10.1161/STROKEAHA.107.507939 |
| [13] | 崔耀梅, 程慧娴, 曾宪明, 等. 富氢液对大鼠脑缺血/再灌注损伤后海马线粒体通透性转换孔及细胞凋亡的影响[J]. 中国药理学通报, 2012, 28(6): 853-8. Cui Y M, Chen H X, Zeng X M, et al. Effects of hydrogen-rich saline on hippocampus mitochondrial permeability transition pore and apoptosis of rats with global cerebral ischemia-reperfusion injury[J]. Chin Pharmacol Bull, 2012, 28(6): 853-8. |
| [14] | 于丽, 童旭辉, 樊宗兵, 等. 抑制NADPH氧化酶对脑缺血/再灌注损伤的保护作用[J]. 中国药理学通报, 2015, 31(8): 1126-31. Yu L, Tong X H, Fan Z B, et al. Protective effect of NADPH oxdase against cerebral ischemia/reperfusion injury[J]. Chin Pharmacol Bull, 2015, 31(8): 1126-31. |
| [15] | Garcia de la Cadena S, Massieu L. Caspases and their role in inflammation and ischemic neuronal death. Focus on caspase-12[J]. Apoptosis, 2016, 21(7): 763-77. doi:10.1007/s10495-016-1247-0 |
| [16] | Min H M, Wang Y, Ren D Y, et al. Protective effect of 2-deoxy-D-glucose on the brain tissue in rat cerebral ischemia/reperfusion models by inhibiting caspase-apoptotic pathway[J]. Histol Histopathol, 2017, 32(1): 57-67. |
| [17] | Sun J, Luan Q, Dong H, et al. Inhibition of mitochondrial permeability transition pore opening contributes to the neuroprotective effects of ischemic postconditioning in rats[J]. Brain Res, 2012, 1436(2): 101-10. |

