


阿霉素 (Adriamycin,ADR) 是一种显效的广谱蒽环类化疗药物[1],其抗肿瘤治疗同时产生的急性和慢性心脏毒性效应[2],在一定程度上限制了其临床应用。研究表明,ADR急性暴露期造成的心脏毒性表现为可逆性心肌收缩功能障碍,心脏明显萎缩,并伴随较轻心肌纤维化和凋亡。ADR撤离后的恢复期,尽管心脏收缩功能有所恢复,心肌细胞凋亡率和纤维化程度却不断升高[1, 3]。β-肾上腺素受体 (β-adrenoceptor,β-AR) 作为重要的G蛋白偶联受体,具有下游通路的多向调控作用,其在心脏功能障碍、心脏重塑、心肌细胞凋亡、心衰的发展进程中起关键调控作用[4-5]。研究显示[4, 6-7],β-AR的持续刺激引起β-AR/PKA/CaMK Ⅱ信号通路的激活,从而促进心肌细胞凋亡等改变,进一步加速心衰的进程。在ADR造成心肌细胞不可逆损伤并最终导致心衰的动态过程中,β-AR/PKA/CaMK Ⅱ信号是否参与了ADR导致心肌凋亡未见报道。因此,本研究通过注射ADR观察心肌组织β-AR、PKA和CaMK Ⅱ蛋白表达的变化与心肌细胞凋亡变化的关系,拟从分子角度探讨ADR诱导心肌细胞凋亡的可能机制。
1 材料与方法 1.1 实验动物70只SPF级♂ Sprague Dawley (SD) 大鼠,体质量 (250±10) g,购于中国人民解放军军事医学科学院卫生学环境医学研究所 (天津),许可证号:SCXK-(军)2014-0001。
1.2 主要药品试剂和仪器盐酸ADR (Adriamycin hydrochloride/ Adriamycin),批号:P1141635,购自上海阿达玛斯试剂有限公司;超高分辨率小动物超声实时影像系统,VisualSonics Vevo@2100维胜 (中国) 有限公司;德国Sigma 3K15高速 (冷冻) 离心机;BNP ELISA试剂盒,批号:L09032840,cTn-T ELISA试剂盒,批号:L09032841,均购自武汉华美生物工程有限公司 (CUSABIO);Masson三色染色试剂盒,批号:20150908,北京索莱宝科技有限公司 (Solarbio);原位细胞凋亡POD标记 (TUNEL) 检测试剂盒,批号:10768100,德国罗氏公司 (Roche);瑞士Tecan Infinite M200 Pro多功能酶标仪;德国Leica DM4000B LED荧光显微镜;抗tubulin抗体购自Santa Cruz (SC-91C4);抗β1-AR、抗β2-AR抗体均购自Abcam (ab3442,ab137494);抗PKA抗体购自Millipore (#06-903);抗CaMK Ⅱ抗体购自Cell Signaling Technology (#3362);羊抗兔IgG-HRP二抗购自北京中杉金桥生物技术有限公司。
1.3 动物模型建立及分组70只SD ♂大鼠随机分为两组:对照组 (CON,n=30) 和阿霉素组 (ADR,n=40)。ADR组参照文献方法[8-10]构建大鼠心肌损伤模型:ADR粉末用无菌生理盐水配制成1 g·L-1溶液,每3 d腹腔注射1次ADR (3 mg·kg-1),连续5次,累积总量为15 mg·kg-1,于两周内注射完成。CON组注射等量生理盐水。分别于实验第2、4和6周动态监测一般状况和心功能,并获取血清和心脏组织进行心衰标志物、病理学指标以及β-AR通路信号分子测定。
1.4 超声心动图对大鼠进行超声心动图检测,动态观察心脏功能及结构的变化。采用Vevo@2100小动物超声仪,MS250线阵探头,探头频率为21 MHz。大鼠吸入3%~4%异氟烷诱导麻醉后,刮去胸前体毛,仰卧位固定于37℃恒温加热板上,1%~2%异氟烷维持麻醉,获取胸骨旁左心室乳头肌水平长轴M型图像,求3个心动周期的平均值,并计算左心室质量 (left ventricular Mass, LV mass)=1.04×[(LVIDd+LVPWd+IVSd)3-LVIDd3]-13.6,计算左心室射血分数 (ejection fraction, EF%)=(LVEDV-LVESV)/LVEDV×100%和每搏输出量 (stroke volume, SV)=LVEDV-LVESV。
1.5 血清BNP和cTn-T水平测定腹主动脉取血液标本,冷冻高速离心机3 000 r·min-1离心10 min,-80℃冰箱保存。用酶联免疫吸附 (ELISA) 法检测血清中BNP和cTn-T浓度,具体操作步骤参照试剂盒说明书进行。
1.6 心脏组织切片及染色大鼠行腹主动脉取血后立即处死,取出心脏,用生理盐水冲洗残血。4%的中性多聚甲醛固定,在相当于左心室横切面乳头肌水平切取环形心肌标本,常规石蜡包埋固定切片,进行HE染色后观察其组织病理性损伤改变。Masson染色后在400倍显微镜下随机摄取左心室区8个视野,Image J图像软件分析胶原纤维面积,胶原容积/%=胶原面积/总面积。采用原位细胞凋亡POD标记法检测各组心肌组织中的凋亡细胞数,严格按照Roche公司说明书进行操作。在400倍显微镜下随机摄取左心室区8个视野,计算TUNEL阳性细胞数。
1.7 Western blot检测12 000×g离心5 min,取上清,采用BCA法进行蛋白定量,并将各组单位体积所含总蛋白含量调整至同一水平。总蛋白经聚丙烯酰胺凝胶电泳分离后,转移到PVDF膜上,用5%脱脂奶粉封闭1 h,加入一抗 (β1-AR、β2-AR、PKA、CaMK Ⅱ,均1 :1 000稀释;tubulin 1 :500稀释) 孵育过夜后,TBST清洗并加入二抗 (兔IgG,1 :5 000) 孵育。ECL发光试剂显色后,自动凝胶成像系统成像分析。
1.8 统计学方法全部数据应用SPSS17.0统计软件分析,计量资料以x±s表示,采用单因素方差分析和两样本均数比较的t检验。
2 结果 2.1 一般状况ADR组在ADR注射期间大鼠出现精神萎靡、蜷缩、活动减少、毛发脱落、生长缓慢等现象;ADR组大鼠体质量明显低于CON组。注射完成后ADR组大鼠体质量开始增长,但仍低于CON组,见Tab 1。4周和6周取材时观察到ADR组大鼠的肝脏边缘圆钝、腹腔大量腹水,个别大鼠出现血性腹水;正常对照组则无此类现象。
| Group | Body weight/g | |||
| 0 wk | 2 wk | 4 wk | 6 wk | |
| CON | 262.17±9.77 | 349.27±21.50 | 361.20±43.45 | 372.29±35.77 |
| ADR | 266.63±13.12 | 256.82±43.57** | 298.53±53.23** | 322.29±54.73 |
| **P < 0.01 vs CON group | ||||
Tab 2所示,ADR末次注射后,即第2周时,ADR组大鼠EF、SV、LV Mass明显下降,差异有统计学意义;停止ADR干预后,ADR组观察到EF、SV与第2周比存在回升趋势,但始终低于CON组。与CON组比,SV在6周时明显下降。4周和6周时,LV Mass与CON组比较无差异。
| Time/wk | Group | EF/% | LV Mass/g | SV/μL |
| 2 | CON (n=10) | 79.8±7.5 | 0.81±0.13 | 212.7±49.4 |
| ADR (n=10) | 63.3±18.4* | 0.59±0.15** | 128.5±38.8** | |
| 4 | CON (n=10) | 76.5±9.4 | 0.78±0.15 | 182.9±37.5 |
| ADR (n=10) | 69.7±10.3 | 0.82±0.19 | 157.0±32.8 | |
| 6 | CON (n=10) | 76.3±4.1 | 0.66±0.14 | 195.6±44.4 |
| ADR (n=6) | 69.6±12.9 | 0.59±0.09 | 154.8±23.8* | |
| EF:ejection fraction; LV Mass:left ventricular mass; SV:stroke volume.*P < 0.05, **P < 0.01 vs CON group | ||||
Tab 3所示,ADR组BNP和cTn-T从第2周开始明显上升,第4周和第6周均继续升高。
| Group | Time | n | BNP/μg·L-1 | cTn-T/ng·L-1 |
| CON | 10 | 0.75±0.23 | 75.4±24.7 | |
| ADR | 2 wk | 10 | 1.16±0.43* | 130.8±49.9* |
| 4 wk | 7 | 1.24±0.45** | 165.9±62.6** | |
| 6 wk | 6 | 1.39±0.49** | 149.3±57.3** | |
| BNP:brain natriuretic peptide; cTn-T:cardiac troponin-T.*P < 0.05, **P < 0.01 vs CON group | ||||
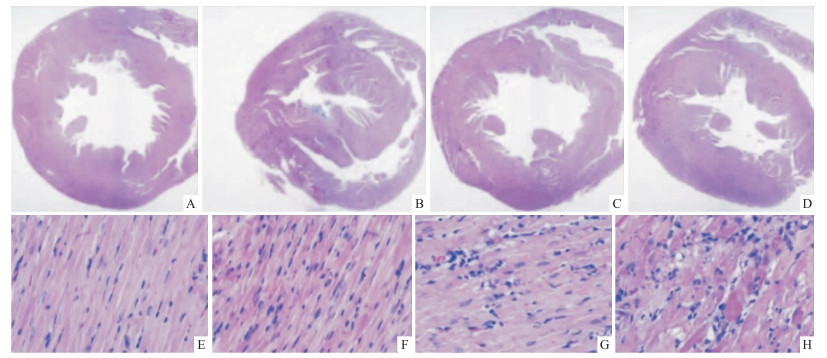
HE染色低倍镜观察可见Fig 1,与CON组比较,第2周时ADR组大鼠心脏体积变小,左室壁明显变薄,第4和第6周,心脏体积和左室壁厚度又恢复正常水平,见Fig 1A~1D。高倍镜下可观察到正常心肌组织肌纤维排列整齐。ADR组第2周时心肌细胞出现萎缩,第4周时,广泛心肌细胞胞质稀疏,炎细胞浸润,可见心肌细胞空泡样变,且随着时间延长到第6周时,病变进一步加重,见Fig 1E~1H。Masson染色显色,心肌纤维呈红色,胶原纤维呈蓝色,见Fig 2A~2D。与CON组比,ADR组胶原纤维第2周明显增加,且随着时间延长到第4和6周,胶原纤维沉积更多。TUNEL染色结果显色,棕色为阳性细胞,蓝色为细胞核,见Fig 2F~2I。与CON组比较,ADR组第2周心肌组织可见心肌细胞凋亡率明显增加,且随着时间延长到第4和6周细胞凋亡率更高。
|
| Fig 1 Effects of ADR on pathological changes in heart tissues by HE staining (HE×12.5, A~D; HE×400, E~H) A:CON group; B:ADR 2 wk group; C:ADR 4 wk group; D:ADR 6 wk group; E:CON group; F:ADR 2 wk group; G:ADR 4 wk group; H:ADR 6 wk group |

|
| Fig 2 Effects of ADR on collagen content and apoptosis in rats by Masson and TUNEL staining (Masson×400, A~D; TUNEL×400, F~I) A: CON group; B: ADR 2 wk group; C: ADR 4 wk group; D: ADR 6 wk group; E: Quantitation of collagen volume fraction; F: CON group; G: ADR 2 wk group; H: ADR 4 wk group; I: ADR 6 wk group; J: TUNEL-positive cells ratio.*P < 0.05, **P < 0.01 vs CON group |
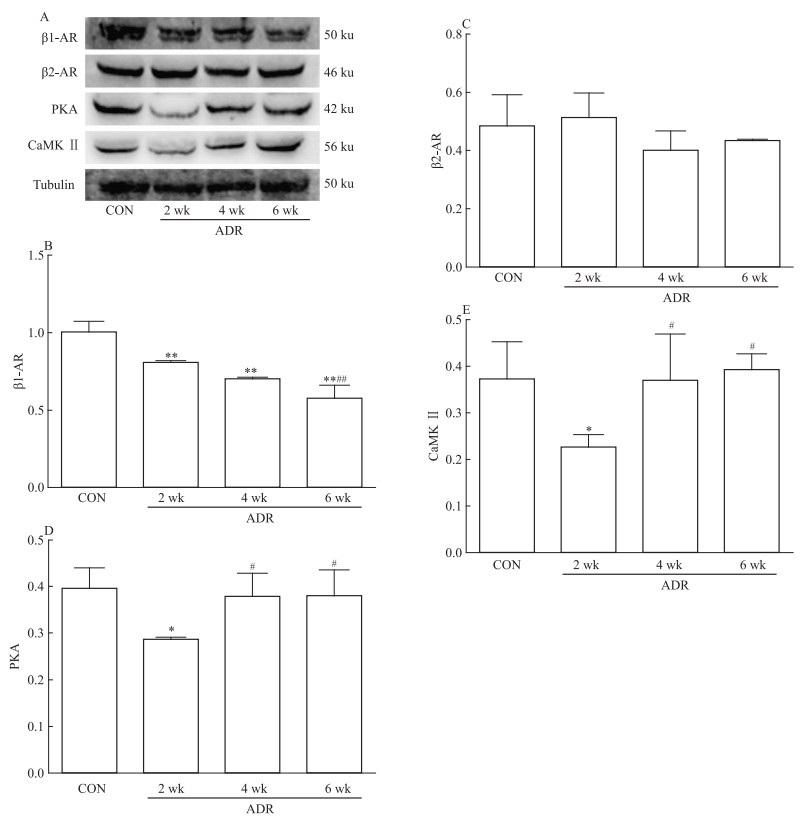
Fig 3所示,ADR组β1-AR表达从第2周开始明显下降,第4和6周继续下降,β2-AR表达水平无明显变化。PKA、CaMK Ⅱ蛋白表达第2周时明显下降,第4周和第6周时逐渐上升。
|
| Fig 3 Expression of β1-AR, β2-AR, PKA and CaMK Ⅱ proteins in left ventricular by Western blot *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs ADR 2 wk group |
本研究结果发现ADR累积注射暴露期的急性心脏毒性与停药后的恢复期的慢性心脏毒性存在不同表征和机制。第2周时 (急性期),ADR可以通过诱导β1-AR及其下游分子PKA表达降低而导致心功能明显降低,并伴随CaMK Ⅱ蛋白表达的降低,心肌细胞明显萎缩,并伴随较轻的心肌纤维化和凋亡率。第4周时 (恢复期),β1-AR表达进一步降低,β2-AR-cAMP-PKA信号激活引起心功能部分恢复[11-12],并且伴随CaMK Ⅱ表达增加,心肌细胞纤维化加重,凋亡率升高。且随着时间延长 (第6周时),PKA、CaMK Ⅱ蛋白表达进一步增加,心肌凋亡继续升高,心室病理重塑加重。结果提示,ADR导致的心功能障碍、心肌重塑和凋亡动态改变过程可能与β-AR/PKA/CaMK Ⅱ信号通路改变有关。
β-AR亚型可通过不同信号通路调控心肌收缩功能和心室重构[4-5]。正常心肌以β1-AR为主,其与β2-AR数量之比约为75% :20%,儿茶酚胺主要通过刺激β1-Gs-adenylyl cyclase (AC)-cAMP-PKA信号通路来发挥正性肌力作用;而β1-AR的持续刺激会进一步引起下游CaMKⅡ的过度表达,促进心肌细胞凋亡,加速心衰表型[4, 6-7]。心力衰竭时,儿茶酚胺作用于β2亚型受体引起的效应发挥主导调节作用,这可能与β1-AR下调 (β1由正常的75%左右下降至约50%) 以及β2-AR重新分布改变胞内cAMP信号的传播有关。生理状态下,β1-AR激活产生的cAMP信号弥散分布于整个胞质,β2-AR激活后cAMP信号只局限于受体周围。在发生衰竭的心肌细胞内,部分T管区β2-AR可能重分布于细胞脊区,且PKA对β2-cAMP信号的限制作用减弱,β2激活产生的效应与β1-AR类似[11-12]。这些改变可能会促进β-AR信号通路激活引起的心肌毒性作用,加重心衰表型。
β-AR亚型信号通路的多向调控在ADR诱导心脏功能损伤和结构重塑的动态改变过程中起重要调控作用。第2周时,心功能明显下降,心肌萎缩,血清BNP和cTn-T升高,较轻的心肌细胞凋亡率和纤维化对心功能减弱影响相对较小[3];而心功能障碍的机制可能与β1-AR/PKA/CaMK Ⅱ信号下调有关。与之相比,第4周时心功能在一定程度上有所恢复,但是血清BNP和cTn-T浓度进一步升高,心肌细胞凋亡率和纤维化程度大量增加,结果与文献报道一致[13]。这种病理重塑和凋亡加重可能与β-AR信号传导通路的改变有关。随着心衰的发生发展 (第4周时),β2-AR对儿茶酚胺的反应性增强,产生与β1-AR类似的效应。β2-AR-Gs-PKA信号激活,一方面增强心肌收缩力,另一方面促进其下游信号分子CaMK Ⅱ蛋白表达升高,诱导心肌细胞凋亡[11-12]而发挥毒害作用。随着时间的延长 (第6周时),β-AR信号引起的不利影响更占主导作用,心肌细胞凋亡率继续升高,加重心肌病理重塑,促进心衰的发生发展。
本实验结果表明,ADR连续注射导致的急性心脏毒性表现为心脏收缩功能障碍,心肌萎缩,并伴随较轻心肌纤维化和凋亡;慢性恢复期心脏毒性表现为心功能有所恢复,但心肌纤维化程度和凋亡率不断升高,且随着时间延长,凋亡率不断增加。ADR注射大鼠急性期心肌PKA和CaMK Ⅱ蛋白表达均下调,而恢复期这两种蛋白表达均上调,提示ADR导致的心功能障碍、心肌重塑和凋亡动态改变过程可能与β-AR/PKA/CaMK Ⅱ信号通路改变有关。
( 致谢: 本实验主要在天津中医药大学天津市中药药理重点实验室完成,在此特别感谢参与本实验的所有老师和同学。 )
| [1] | Volkova M, Russell R. Anthracycline cardiotoxicity: prevalence, pathogenesis and treatment[J]. Curr Cardiol Rev, 2011, 7 (4): 214-20. |
| [2] | Saltiel E, McGuire W. Doxorubicin (Doxorubicin) cardiomyopathy-A critical review[J]. West J Med, 1983, 139 (3): 332-41. |
| [3] | Zhu W Q, Shou W N, Payne R M, et al. A mouse model for juvenile doxorubicin-induced cardiac dysfunction[J]. Pediatr Res, 2008, 64 (5): 488-94. doi:10.1203/PDR.0b013e318184d732 |
| [4] | Zhang X Y, Szeto C, Gao E, et al. Cardiotoxic and cardioprotective features of chronic β-adrenergic signaling[J]. Circ Res, 2013, 112 (3): 498-509. doi:10.1161/CIRCRESAHA.112.273896 |
| [5] | Lymperopoulos A, Rengo G, Koch W J. The adrenergic nervous system in heart failure pathophysiology and therapy[J]. Circ Res, 2013, 113 (6): 739-53. doi:10.1161/CIRCRESAHA.113.300308 |
| [6] | Communal C, Singh K, Pimentel D R, et al. Norepinephrine stimulates apoptosis in adult rat ventricular myocytes by activation of the β-adrenergic pathway[J]. Circulation, 1998, 98 (13): 1329-34. doi:10.1161/01.CIR.98.13.1329 |
| [7] | Iwai-Kanai E, Hasegawa K, Araki M, et al. α-and β-Adrenergic pathways differentially regulate cell type-specific apoptosis in rat cardiac myocytes[J]. Circulation, 1999, 100 (3): 305-11. doi:10.1161/01.CIR.100.3.305 |
| [8] | Merlet N, Piriou N, Rozec B, et al. Increased beta2-adrenoceptors in doxorubicin-induced cardiomyopathy in rat[J]. PLoS One, 2013, 8 (5): e64711. doi:10.1371/journal.pone.0064711 |
| [9] | 彭琳, 唐小海, 严伟, 等. 果胶阿霉素对大鼠心脏毒性的研究[J]. 中国药理学通报, 2016, 32 (8): 1075-80. Peng L, Tang X H, Yan W, et al. Study of pectin-adriamycin conjugate to cardiac toxicity in rats[J]. Chin Pharmacol Bull, 2016, 32 (8): 1075-80. |
| [10] | 李杰, 胡超, 许龙龙, 等. 参麦方对于大鼠心肌损伤保护作用的代谢组学研究[J]. 中国药理学通报, 2016, 32 (11): 1559-65. Li J, Hu C, Xu L L, et al. A metabolomics study on Shen-Mai decoction' s protection of myocardial injured rats[J]. Chin Pharmacol Bull, 2016, 32 (11): 1559-65. |
| [11] | Woo A Y H, Song Y, Xiao R P, et al. Biased β2-adrenoceptor signalling in heart failure: pathophysiology and drug discovery[J]. Br J Pharmacol, 2015, 172 (23): 5444-56. doi:10.1111/bph.12965 |
| [12] | Nikolaev V O, Moshkov A, Lyon A R, et al. β2-adrenergic receptor redistribution in heart failure changes cAMP compartmentation[J]. Science, 2010, 327 (5973): 1653-7. doi:10.1126/science.1185988 |
| [13] | 吴运香, 张野, 谢春林, 等. SD大鼠阿霉素慢性心力衰竭模型的建立与评价[J]. 中国药理学通报, 2011, 27 (8): 1170-3. Wu Y X, Zhang Y, Xie C L, et al. Establishment and evaluation of adriamycin-induced chronic heart failure model in SD rats[J]. Chin Pharmacol Bull, 2011, 27 (8): 1170-3. |

