


心肌肥大是一个非常重要的病理进程,它是心脏在病理状态下维持适当收缩功能的代偿反应,主要表现为心肌细胞体积增大、重量增加、间质细胞增生以及心肌重构等。长期的心肌肥大可导致冠心病、心律失常、心力衰竭,是心功能恶化及心源性死亡的独立危险因素,因此,研究心肌肥大的分子机制具有十分重要的意义[1-3]。
尼克酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,Nampt),又名内脏脂肪素visfatin,或前B细胞克隆增强因子PBEF,是哺乳动物生命活动中不可或缺的蛋白[4]。在哺乳动物细胞中,Nampt是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)生物合成过程中的限速酶,广泛表达于心、脑、肺、骨髓、肝脏、肌肉等机体各组织和器官中,与糖尿病、肥胖、动脉粥样硬化、血管内皮炎性损伤等密切相关[5-7],提示Nampt在心血管疾病的发生发展过程中发挥重要作用。然而,Nampt在心肌细胞肥大中的作用国内外少有报道,值得进一步研究。本实验以新生大鼠心肌细胞作为主要研究对象,通过检测过表达Nampt对心肌细胞肥大的影响,并初步探索NF-κBB依赖的信号通路在其中的作用。
1 材料与方法 1.1 主要材料出生1~3 d的SD大鼠,♀♂不限,购自广东省医学实验动物中心。DMEM高糖培养基、胰蛋白酶和胎牛血清均购自Gibco BRL公司;苯肾上腺素(PE)购自Sigma-Aldrich公司,用无菌超纯水配成0.1 mol·L-1储存液,并于-80℃保存;Nampt兔多抗购自Sigma-Aldrich公司;β-actin小鼠单抗、辣根过氧化物酶标记的羊抗兔二抗均购自广州市洁利生物医学有限公司;Opti-MEMI培养基和Lipofectamine 2000转染试剂购自Invitrogen公司;含有NF-κBB结合位点的PGL4.32-NF-κBB-RE-luc2P和作为内参使用的PRL-TK质粒均购自Promega公司。
1.2 方法 1.2.1 心肌细胞培养与处理取1~3 d新生SD大鼠,用75%酒精擦净胸部及腹部皮肤后,开胸,取出心脏,放入预冷的PBS缓冲液中。剔除心脏上的结缔组织,并剪成1 mm3的碎块。连同PBS吸入离心管,瞬时离心后去上清。将心肌组织移入锥形瓶,加入15 mL 0.08%的胰蛋白酶于磁力搅拌器上37℃水浴消化。5 min后收集细胞上清至5 mL含10%胎牛血清的DMEM培养液中,1000 r·min-1离心5 min,弃上清,重悬细胞沉淀,剩余组织继续消化,直到组织块消化完全为止。收集各次消化细胞悬液,1000 r·min-1离心5 min,用DMEM培养基重悬细胞,接种于培养瓶中,置于37℃,5%CO2培养箱中孵育1 h后,收集上清,并加入0.1 mmol·L-1 Brdu以抑制心肌成纤维细胞生长。培养24h之后,换新鲜含10%胎牛血清的DMEM高糖培养基继续培养,此时部分细胞开始出现搏动。在处理细胞之前换含0.1%胎牛血清的DMEM培养基处理细胞24 h,使细胞同步化[8]。再给予PE(100 μmol·L-1)或转染Nampt及空载体处理细胞24 h,并进行后续实验。
1.2.2 Real-time PCR检测mRNA表达乳鼠心肌细胞给予不同浓度PE处理不同时间或给予过表达Nampt及其空载体处理之后,弃培养基,采用TRIzol一步法提取心肌细胞中的总RNA,RNA 定量后逆转录合成cDNA,用BIO-RAD荧光定量PCR系统进行实时荧光定量PCR反应,反应条件为:95℃ 10 s;95℃ 5 s,60℃ 30 s,循环50次;95℃ 15s,60℃ 1 h;65℃ 30 s,循环61次。每组样品设3个复孔,以保证实验数据的有效性。各目的基因及内参引物以Primer premier 5.0 软件设计,由上海生工生物工程技术服务有限公司合成,引物序列见Tab 1。
| Primer | Sequence |
| Nampt | Forward: 5'-ATAAACAATACCCACCCA-3′ |
| Reverse: 5′-TGTACTGCAACCCATAAA-3′ | |
| ANP | Forward: 5′-GGAAGTCAACCCGTCTCA-3′ |
| Reverse: 5′-AGCCCTCAGTTTGCTTTT-3′ | |
| BNP | Forward: 5′-TTTGGGCAGAAGATAGACCG-3′ |
| Reverse: 5′-AGAAGAGCCGCAGGCAGAG-3′ | |
| GAPDH | Forward: 5′-AGGAGTAAGAAACCCTGGAC-3′ |
| Reverse: 5′-CTGGGATGGAATTGTGAG-3′ |
乳鼠心肌细胞分别过表达空载体质粒或EGFP-Nampt质粒24 h之后,弃培养基,加入三去污裂解液提取细胞总蛋白,依次进行 SDS-PAGE凝胶电泳、转膜、封闭,并加入待测一抗Nampt(稀释比: 1 ∶1 000)和内参抗体β-actin(稀释比:1 ∶1 500),于4 ℃孵育过夜,次日加入相应的二抗,化学发光法检测目的蛋白表达水平,采用Image J软件对显影的条带进行灰度分析。
1.2.4 免疫荧光检测心肌细胞表面积在细胞培养皿中放入玻片,将心肌细胞接种在玻片上,心肌细胞分别给予PE(100 μmol·L-1)处理或过表达Nampt 24 h之后,弃培养基,冷PBS缓冲液洗3次,并用4%多聚甲醛室温固定15~30 min,在PBS缓冲液中加入0.1%罗丹明标记的鬼笔环肽(Rhodamine-phalloidin)和0.1% saponin,充分混匀后加入培养皿中,室温静置1 h(避光);用含有0.1% saponin的PBS缓冲液洗细胞3次,每次5 min,在载玻片上滴加一小滴含DAPI的封片剂,取出盖玻片,并吸干水分使其倒扣在载玻片上,当封片剂分布均匀后,在盖玻片四周涂上指甲油,4℃过夜,用激光共聚焦显微镜对其进行观察,每次实验过程中,各组随机选取7个视野,每个视野包含5~10个心肌细胞,该实验重复3次,测量35~70个细胞的表面积,利用Image J图像分析软件计算细胞表面积,并分析计算结果。
1.2.5 双荧光素酶报告基因检测NF-κBB依赖的转录活性心肌细胞按5×104/cm2 密度接种于96孔板中,使用Lipofectamine 2000转染PGL4.32-NF-κBB-RE-luc2P质粒和作为内参使用的PRL-TK载体,细胞于培养箱中继续孵育6 h后换入新鲜的含10%胎牛血清的DMEM培养基培养12 h。按照Promega公司Dual-Luciferase Reporter Assay System说明书进行操作,加入 luciferase reagent充分混合均匀后,将待测液转移入白色不透光的96孔板中,用Varioskan Flash型全波长扫描式多功能读数仪(美国Thermo公司)测量可见光强度10 s(此时的荧光为PGL4.32-NF-κBB-RE-luc2P载体转录翻译产生的萤火虫luciferase发出),在96孔板中加入Stop & Glo Reagent,混合均匀,用Varioskan Flash型全波长扫描式多功能读数仪进一步测量可见光强度10 s(此时的荧光为内参载体PRL-TK转录翻译产生的海肾luciferase发出),将所得的数值,以海肾luciferase为参照进行标准化,计算均值,统计分析。
1.2.6 统计分析采用SPSS 13.0 软件进行统计学分析,各组数据以x±s表示,多组间比较采用单因素方差分析(One-way ANOVA)。
2 结果 2.1 过表达Nampt对Nampt mRNA和蛋白水平的影响为了验证过表达EGFP-Nampt是否成功,我们分别利用Real-time PCR和Western blot的方法检测转染EGFP-Nampt和空载体质粒之后Nampt的mRNA和蛋白表达变化。如Fig 1所示,与转染空载体组(Vector)相比,EGFP-Nampt组Nampt的mRNA和蛋白水平明显升高。
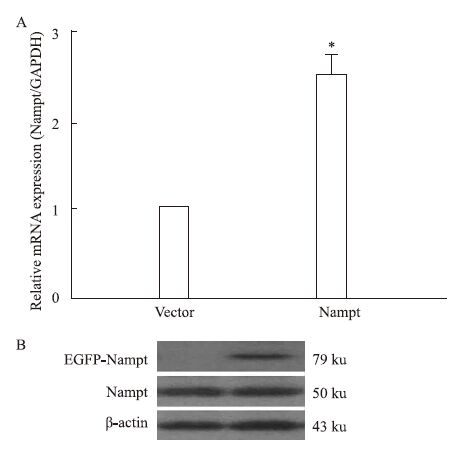
|
| Fig 1 EGFP-Nampt transientlyoverexpressed in cardiomyocytes (x±s,n=3) Cardiomyocytes were transfected with Nampt. A: the mRNA expression of Nampt was detected by Real-time PCR; B: the protein expression of Nampt was measured by Western blot. *P<0.05 vs vector group |
为了探讨过表达Nampt对心肌细胞肥大的影响,我们在原代培养的新生大鼠心肌细胞中分别转染了EGFP-Nampt和空载体质粒或给予PE(100 μmol·L-1)处理,24 h之后分别检测了ANP和BNP的表达情况。如Fig 2所示,我们发现PE处理心肌细胞24 h可明显增加ANP和BNP的表达,而过表达EGFP-Nampt能够模拟PE的作用诱导心肌细胞肥大,过表达空载体质粒则无此效应。
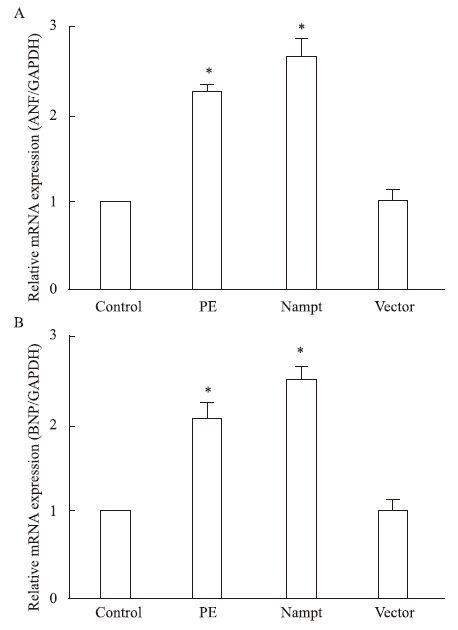
|
| Fig 2 The mRNA expression of ANP and BNP incardiomyocytes transfected with EGFP-Nampt (x±s,n=3) The cardiomyocytes were transfected with EGFP-Nampt or treated with 100 μmol·L-1 PE for 24 h. A,B: the mRNA expression of ANP and BNP were detected by Real-time PCR. *P<0.05 vs control group |
为了进一步明确Nampt在心肌细胞肥大中的功能,我们在转染了EGFP-Nampt和空载体质粒或给予PE处理24 h之后进一步检测了心肌细胞表面积。如Fig 3所示,在心肌细胞中PE可明显增大心肌细胞表面积,而过表达EGFP-Nampt能够模拟PE的作用增加心肌细胞表面积,过表达空载体质粒则无此效应。
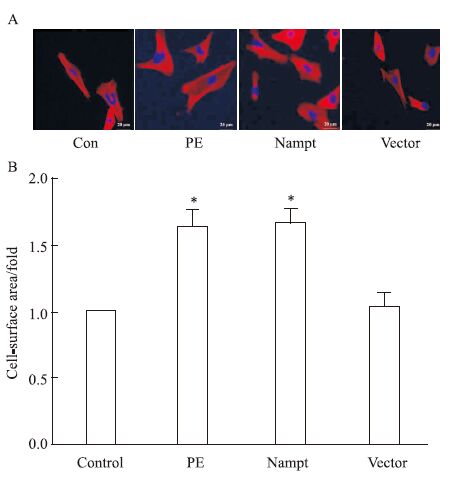
|
| Fig 3 The cell-surface area in cardiomyocytestransfected with EGFP-Nampt (x±s,n=3) The cardiomyocytes were transfected with EGFP-Nampt or treated with 100 μmol·L-1 PE for 24 h. A-B: the cell-surface area was measured. *P<0.05 vs control group |
NF-κBB作为一个重要的转录因子,激活后能够调控下游与心肌肥大相关靶基因的转录[9]。为了研究过表达Nampt诱导心肌细胞肥大的分子机制,我们将含有NF-κBB结合位点的PGL4.32-NF-κBB-RE-luc2P质粒和内参质粒PRL-TK共转染入心肌细胞,如Fig 4所示,给予心肌细胞PE处理24 h后NF-κBB依赖性转录活性明显增加,过表达EGFP-Nampt质粒也能够增加NF-κBB依赖性转录活性,而过表达空载体质粒则无此效应。
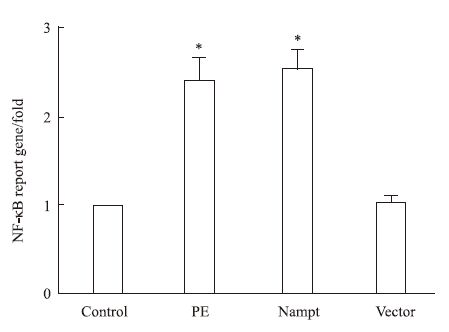
|
| Fig 4 The NF-κBB-dependent transcription activity in cardiomyocytes transfected with EGFP-Nampt (x±s,n=3) The cardiomyocytes were transfected with EGFP-Nampt or treated with 100 μmol·L-1 PE for 24 h. The NF-κBB-dependent transcription activity was measured by luciferase reporter gene assays. *P<0.05 vs control group |
为了进一步探讨NF-κBB在Nampt调控心肌肥大中的作用,我们在心肌细胞中,检测特异性沉默NF-κBB的p65亚基之后,过表达Nampt对肥大基因表达和心肌细胞表面积的影响。结果如Fig 5所示,在心肌细胞中沉默NF-κBB的p65亚基能够取消Nampt对肥大基因和心肌细胞表面积的影响。
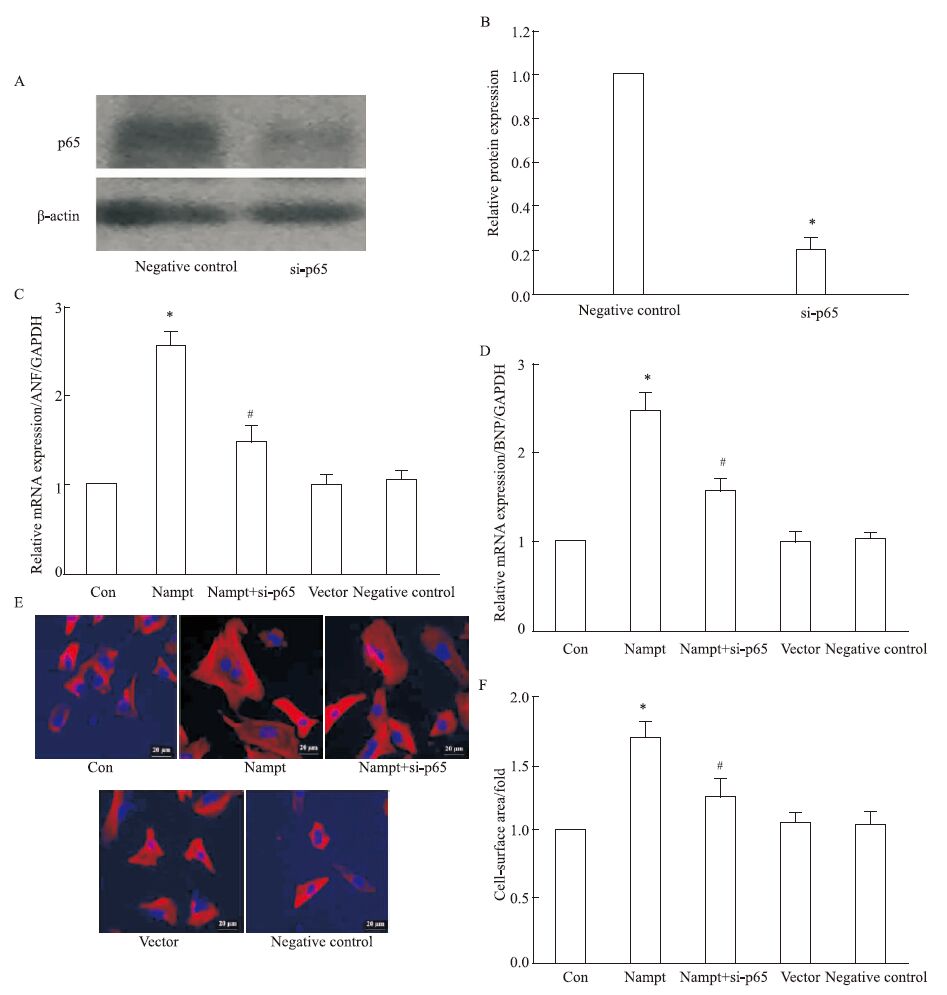
|
| Fig 5 Nampt induced cardiac hypertrophy via activation of NF-κBB (x±s,n=3) Cardiomyocytes overexpressed with Nampt after transfection with si-p65 were treated with PE for 24 h. A-B: the protein expression of p65 was measured by Western blot; C-D: the mRNA expression of ANP and BNP were detected by Real-time PCR; E-F: the cell-surface area was measured. *P<0.05 vs control group,#P<0.05 vs Nampt group. |
Nampt是NAD生物合成的限速酶,研究表明Nampt具有促血管新生、抗细胞凋亡、参与机体炎症应答、促进多种细胞增殖分化成熟等生理功能,对许多疾病如糖尿病、癌症、自身免疫性疾病等有潜在的作用[10-11]。近年来,大量研究证明Nampt与心血管疾病的发生发展密切相关。在冠状动脉不稳定粥样硬化患者的颈动脉斑块和急性心肌梗死病人破裂斑块中Nampt表达明显增加[11-12]。研究发现Nampt能够增强MMP-2和MMP-9的酶活性,而MMP可以降解细胞外基质,使纤维帽变薄,导致斑块破裂,提示Nampt在动脉粥样硬化斑块不稳定中起重要作用[13]。此外,Nampt抑制剂APO866治疗心肌梗死可以减少梗死面积、中性粒细胞浸润和在心肌缺血再灌注损伤中小鼠模型体内活性氧的产生[14]。因此,Nampt 药理抑制剂作为一种有效的治疗药物,可以减少心肌梗死氧化介导的组织损伤。柴雅琴等[15]的研究还发现Nampt在妊娠高血压综合征产妇胎盘组织中高表达,且二者的表达水平呈明显正相关,提示其与妊娠期高血压密切相关。Schutte 等[16]认为Nampt可能通过炎症反应、血管收缩等作用于心血管系统疾病。以上结果提示Nampt对动脉粥样硬化、心肌梗死、妊娠高血压等心血管疾病具有重要的调节作用,但Nampt能否影响心肌细胞肥大,目前国内外少有报道。在本课题中,我们发现过表达Nampt能够模拟PE的作用诱导心肌细胞肥大,提示Nampt可能是一个潜在的防治心肌肥大的药物作用靶点。
Nampt调控心肌细胞肥大的分子机制尚不清楚,值得进一步研究。临床研究显示Nampt的浓度在慢性炎症性疾病中明显增加[17],提示Nampt与炎症反应密切相关。NF-κBB是细胞内非常重要的核转录因子,不仅直接调控参与免疫炎症相关基因的表达,而且也调节与促炎性细胞因子、趋化因子的产生、细胞增殖和细胞凋亡相关基因的转录[18]。近年来的研究提示,心肌细胞肥大的过程中需要NF-κBB的激活,抑制心肌细胞肥大性反应与降低NF-κBB活性呈正相关[19-20]。在心肌组织中,NF-κBB可被多种引起心肌肥厚的刺激因子活化引起心肌细胞肥大,它的过表达还可启动 ANP、BNP的表达[21]。此外,NF-κBB还可以与MAPK等其他导致肥厚的信号转导通路之间交互作用,共同促进心肌肥厚的发生发展[22]。以上结果提示NF-κBB在心肌肥大的发生发展过程中具有重要作用。那么NF-κBB是否参与了Nampt对心肌肥大的调控作用呢?为了解决这个问题,我们检测了过表达Nampt对NF-κBB依赖性转录活性的影响,发现过表达Nampt能够增加NF-κBB依赖性转录活性,进一步的研究表明沉默NF-κBB的p65亚基能够明显逆转过表达Nampt诱导心肌肥大的效应,提示NF-κBB信号通路参与了Nampt对心肌细胞肥大的调控作用。然而,在本文中我们也发现沉默NF-κBB并不能完全阻断Nampt的作用,Nampt还可能通过其它途径发挥调控心肌细胞肥大的作用。研究表明作为NAD合成的关键酶,Nampt与酶活性依赖于NAD的沉默信息调节因子2(silent information regulator 2,Sir2)家族成员关系密切,Nampt可通过调控NAD的合成影响SIRT1的活性进而调节SIRT1下游通路[23]。此外,Nampt还被报道参与调控AKT及MAPK等信号通路[24],这些通路在Nampt调控心肌肥大中的作用尚需我们进一步探讨。
综上所述,在本课题中我们发现过表达Nampt能够模拟PE的作用诱导心肌细胞肥大,且其机制与NF-κBB依赖性转录激活有关。今后的工作中,我们将通过腺病毒心室壁注射的方式在整体动物水平干预Nampt,进一步在体内明确Nampt对心肌肥大的调控作用,并深入探索Nampt调控NF-κBB的具体分子机制以及Nampt调控心肌肥大的其它信号通路,为确定心肌肥大治疗的新靶点提供初步的实验数据。
( 致谢: 本实验在广州医科大学药物研发中心和医学实验中心完成,非常感谢药物研发中心和医学实验中心的各位老师在实验技术上的帮助。 )
| [1] | Cai Y, Yu S S, Chen S R, et al. Nmnat2 protects cardiomyocytes from hypertrophy via activation of SIRT6[J]. FEBS Lett, 2012, 586 (6): 866-74. doi:10.1016/j.febslet.2012.02.014 |
| [2] | Tsuruda T, Sekita-Hatakeyama Y, Hao Y, et al. Angiotensin Ⅱ Stimulation of Cardiac Hypertrophy and Functional Decompensation in Osteoprotegerin-Deficient Mice[J]. Hypertension, 2016, 67 (5): 848-56. doi:10.1161/HYPERTENSIONAHA.115.06689 |
| [3] | 黄波, 江芬, 薛莱, 等. PPARβ在虎杖苷抗高糖高胰岛素诱导心肌肥大中的作用[J]. 中国药理学通报, 2015, 31 (9) : 1264-9. Huang B, Jiang F, Xue L, et al. PPARβ-related signal pathway involves in the effect of polydatin on high glucose-and insulin-induced cardiomyocyte hypertrophy[J]. Chin Pharmacol Bull, 2015, 31 (9): 1264-9. |
| [4] | Chen H, Wang S, Zhang H, et al. Nicotinamide phosphoribosyltransferase (Nampt) in carcinogenesis: new clinical opportunities[J]. Expert Rev Anticancer Ther, 2016, 16 (8): 827-8. doi:10.1080/14737140.2016.1190649 |
| [5] | Wang P, Li W L, Liu J M, et al. NAMPT and NAMPT-controlled NAD Metabolism in Vascular Repair[J]. J Cardiovasc Pharmacol, 2016, 67 (6): 474-81. doi:10.1097/FJC.0000000000000332 |
| [6] | Li S, Wang C, Li K, et al. NAMPT knockdown attenuates atherosclerosis and promotes reverse cholesterol transport in ApoE KO mice with high-fat-induced insulin resistance[J]. Sci Rep, 2016, 6 : 26746. doi:10.1038/srep26746 |
| [7] | Luizon M R, Palei A C, Belo V A, et al. Gene-gene interactions in the NAMPT pathway, plasma visfatin/NAMPT levels, and antihypertensive therapy responsiveness in hypertensive disorders of pregnancy[J]. Pharmacogenomics J, 2016 . |
| [8] | Geng B, Cai Y, Gao S, et al. PARP-2 knockdown protects cardiomyocytes from hypertrophy via activation of SIRT1[J]. Biochem Biophys Res Commun, 2013, 430 (3): 944-50. doi:10.1016/j.bbrc.2012.11.132 |
| [9] | Yuan Z, Matias F B, Wu J, et al. Koumine attenuates lipopolysaccaride-stimulated inflammation in RAW264.7 macrophages, coincidentally associated with inhibition of NF-kappaB, ERK and p38 pathways[J]. nt J Mol Sci, 2016, 17 (3): 430. doi:10.3390/ijms17030430 |
| [10] | Ju H Q, Zhuang Z N, Li H, et al. Regulation of the Nampt-mediated NAD salvage pathway and its therapeutic implications in pancreatic cancer[J]. Cancer Lett, 2016, 379 (1): 1-11. doi:10.1016/j.canlet.2016.05.024 |
| [11] | Kadoglou N P, Sailer N, Moumtzouoglou A, et al. Visfatin (nampt) and ghrelin as novel markers of carotid atherosclerosis in patients with type 2 diabetes[J]. Exp Clin Endocrinol Diabetes, 2010, 118 (2): 75-80. doi:10.1055/s-0029-1237360 |
| [12] | Kadoglou N P, Sailer N, Kapelouzou A, et al. Effects of atorvastatin on apelin, visfatin (nampt), ghrelin and early carotid atherosclerosis in patients with type 2 diabetes[J]. Acta Diabetol, 2012, 49 (4): 269-76. doi:10.1007/s00592-011-0310-0 |
| [13] | 黄芬, 熊晓昉, 游莎, 等. 内脂素经核因子κB途径诱导人单核细胞基质金属蛋白酶-2和9表达的实验研究[J]. 中华心血管病杂志, 2010, 38 (5) : 455-9. Huang F, Xiong X F, You S, et al. Visfatin upregulates MMP-2 and MMP-9 expresstom in human monocytes through activating NF-κBB[J]. Chin J Cardiol, 2010, 38 (5): 455-9. |
| [14] | Montecucco F, Bauer I, Braunersreuther V, et al. Inhibition of nicotinamide phosphoribosyltransferase reduces neutrophil-mediated injury in myocardial infarction[J]. Antioxid Redox Signal, 2013, 18 (6): 630-41. doi:10.1089/ars.2011.4487 |
| [15] | 柴雅琴, 杨艳花, 黄桂香. MCP-1和Visfantin/PBEF在妊高症患者胎盘中的表达及意义[J]. 医学信息, 2014, 27 (4) : 126-7. Chai Y Q, Yang Y H, Huang G X. Expression and significance of MCP-1and Visfantin/PBEF in the placenta of pregnancy-induce hypertension syndreome patients[J]. Med Inform, 2014, 27 (4): 126-7. |
| [16] | Schutte A E, Huisman H W, Schutte R, et al. Adipokines and cardiometabolic function: How are they interlinked?[J]. Regul Pept, 2010, 164 (2-3): 133-8. doi:10.1016/j.regpep.2010.06.008 |
| [17] | Yarar-Fisher C, Bickel C S, Kelly N A, et al. Heightened TWEAK-NF-kappaB signaling and inflammation-associated fibrosis in paralyzed muscles of men with chronic spinal cord injury[J]. Am J Physiol Endocrinol Metab, 2016, 310 (9): E754-61. doi:10.1152/ajpendo.00240.2015 |
| [18] | Jones W K, Brown M, Wilhide M, et al. NF-kappaB in cardiovascular disease: diverse and specific effects of a “general” transcription factor?[J]. Cardiovasc Toxicol, 2005, 5 (2): 182-202. |
| [19] | Zelarayan L, Renger A, Noack C, et al. NF-kappaB activation is required for adaptive cardiac hypertrophy[J]. Cardiovasc Res, 2009, 84 (3): 416-24. doi:10.1093/cvr/cvp237 |
| [20] | Gupta S, Young D, Maitra R K, et al. Prevention of cardiac hypertrophy and heart failure by silencing of NF-kappaB[J]. J Mol Biol, 2008, 375 (3): 637-49. doi:10.1016/j.jmb.2007.10.006 |
| [21] | Gaspar-Pereira S, Fullard N, Townsend PA, et al. The NF-kappaB subunit c-Rel stimulates cardiac hypertrophy and fibrosis[J]. Am J Pathol, 2012, 180 (3): 929-39. doi:10.1016/j.ajpath.2011.11.007 |
| [22] | Chen G, Pan SQ, Shen C, et al. Puerarin inhibits angiotensin Ⅱ-induced cardiac hypertrophy via the redox-sensitive ERK1/2, p38 and NF-kappaB pathways[J]. Acta Pharmacol Sin, 2014, 35 (4): 463-75. doi:10.1038/aps.2013.185 |
| [23] | Ming G F, Wu K, Hu K, et al. NAMPT regulates senescence, proliferation, and migration of endothelial progenitor cells through the SIRT1 AS lncRNA/miR-22/SIRT1 pathway[J]. Biochem Biophys Res Commun, 2016, 478 (3): 1382-8. doi:10.1016/j.bbrc.2016.08.133 |
| [24] | Yu X Y, Qiao S B, Guan H S, et al. Effects of visfatin on proliferation and collagen synthesis in rat cardiac fibroblasts[J]. Horm Metab Res, 2010, 42 (7): 507-13. doi:10.1055/s-0030-1249059 |

