


吉非替尼(gefitinib)是第1代EGFR抑制剂,它对具有 EGFR 19 位外显子E746-A750缺失突变和21位外显子L858R点突变这两种敏感突变,以及 EGFR 扩增的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者具有较好的疗效,是治疗这类患者的常规用药[1]。然而,大部分使用gefitinib的 患者在用药后会产生耐受,其中,约20%的患者耐药的原因是c-Met基因扩增[2]。
c-Met是一种原癌基因,c-Met蛋白是肝细胞生长因子(hepatocyte growth factor,HGF)的唯一已知受体,它除了可导致抗肿瘤药物耐药以外,与肿瘤的进展、转移,以及肿瘤干细胞的自更新也密切相关,被认为是有效的肿瘤治疗靶点[3-5]。因此,建立一种c-Met过表达、且生长高度依赖c-Met蛋白活性的细胞株,无论是在相关的耐药和转移机制的研究,还是在以c-Met为靶点的药物筛选和发现中均有十分重要的用途。本研究即以NSCLC细胞株HCC827为亲本细胞,采用gefitinib和HGF共同处理此细胞,快速诱导产生了c-Met高表达的对gefitinib耐受的HCC827GR细胞,并对其药理学特性进行了探讨。
1 材料与方法 1.1 材料 1.1.1 细胞和试剂NSCLC细胞株购自美国模式培养物集存库(ATCC);HGF购自美国Peprotech公司;RPMI 1640培养基、胰酶、DMSO、MTT和结晶紫均购自Sigma公司;胎牛血清购自草原绿野生物工程材料有限公司;p-Met Tyr1234/1235和c-Met抗体购自美国Cell Signaling Technology公司;β-actin和辣根过氧化酶标记的二抗购自北京中杉金桥生物技术有限公司;RIPA裂解液、G250蛋白定量试剂和蛋白酶抑制剂均购自Roche公司;Edu增殖检测试剂盒购自广州市锐博生物科技有限公司;RNA提取试剂盒购自天根生化科技有限公司;cDNA合成试剂盒和qRT-PCR试剂盒均购自美国BIO-RAD公司;gefitinib、Crizotinib、PHA-665752和PF-04217903等药物购自美国Selleck公司。
1.1.2 主要仪器BHC-1000IIA/B3型生物安全柜,苏净安泰生物技术有限公司;IX50型倒置显微镜,日本Olympus公司;Heraeus BB15型细胞培养箱、Multiscan MK3酶标仪、Sorvall ST16型低速离心机,美国Thermo Fisher公司;JY300C型电泳仪,北京君意东方电泳仪器有限公司;ABI7500型荧光定量PCR仪,美国Applied Biosystems公司。
1.2 方法 1.2.1 HCC827GR细胞的诱导向生长状态良好且处于对数生长期的HCC827细胞中加入50 μg·L-1 HGF和0.1 μmol·L-1 gefitinib,随后,每3 d更换1次含细胞因子和药物的培养基,待细胞对该浓度药物耐受后再依次将药物浓度提升至0.2、0.5、1和10 μmol·L-1,且当药物浓度增加至1 μmol·L-1时不再添加HGF。在药物处理过程中,细胞长满后正常传代,细胞贴壁后再加药处理。以此法处理细胞4周左右即可得到对gefitinib耐受的HCC827GR细胞。
1.2.2 MTT细胞活力检测收集对数生长期的HCC827和HCC827GR细胞,每孔接种6 000个细胞,接种体积100 μL。次日,采用不同浓度的药物处理细胞,每个浓度3个复孔,并设置溶剂对照组。药物处理72 h后,向每孔加入20 μL MTT溶液(5 g·L-1),在37 ℃孵育2~4 h,再加入50 μL质量浓度为200 g·L-1的酸性SDS溶液,于37 ℃溶解甲臜过夜,最后采用酶标仪检测570 nm波长下的吸光度值,并用Graphpad Prism软件分析测试结果,绘制细胞存活率-浓度曲线。
1.2.3 克隆形成实验收集对数生长期的HCC827和HCC827GR细胞,以每孔2 000个细胞的量接种于6孔板中。次日细胞贴壁后,向每孔加入不同浓度的gefitinib处理细胞,并设置溶剂对照组。此后,每3 d更换1次含药培养基,连续作用12 d后,弃去培养基,用甲醇固定细胞,并用2.5 g·L-1的结晶紫染液对细胞克隆进行染色并拍照。
1.2.4 Edu细胞增殖检测收集对数生长期的HCC827和HCC827GR细胞,以每孔8 000个细胞的量接种于96孔板中,次日细胞贴壁后,向每孔加入适宜浓度的gefitinib,作用24 h,再进行Edu细胞增殖检测,检测方法按照Cell-LightTM Edu Apollo 567 In Vitro Kit(广州锐博生物)说明书进行。
1.2.5 实时荧光定量PCR收集HCC827和HCC827GR细胞,按试剂盒操作说明提取两种细胞的总RNA,逆转录成cDNA,再进行荧光定量PCR检测c-Met表达。使用的引物序列如下:c-Met(forward):5′-GAGGCAGTGCAGCATGTAGT-3′,c-Met(reverse):5′-GATGATTCCCTCGGTCAGAA -3′;GAPDH(forward):5′-CAGGTGGTCTCCTCTGACTT -3′,GAPDH(reverse):5′-CCAAATTCGTTGTCATACCA-3′。
按以下参数进行荧光定量PCR反应:95℃×30 s → 95℃×5 s,60℃×30 s(35个循环)→ 95℃×5 s。以GAPDH mRNA表达水平作为内参,通过检测目的基因相对于内参基因的表达变化来定量。
1.2.6 Western blot实验收集HCC827和HCC827GR等NSCLC细胞,裂解,超声,提取总蛋白。采用SDS-PAGE分离蛋白,并转至PVDF膜,使用质量浓度为50 g·L-1的脱脂奶粉封闭2 h,再分别加入1 ∶1 000稀释的p-Met、c-Met或β-actin抗体,于4 ℃孵育过夜。次日,再加入1 ∶5 000稀释的辣根过氧化物酶标记的二抗,在37 ℃ 孵育1 h,随后用TBS/T洗脱除去过量抗体,在暗室中加入显影液显影曝光。
1.2.7 数据的统计与分析实验数据采用x±s表示,结果采用GraphPad 5.0软件进行统计分析,两组样本均数比较采用t检验。
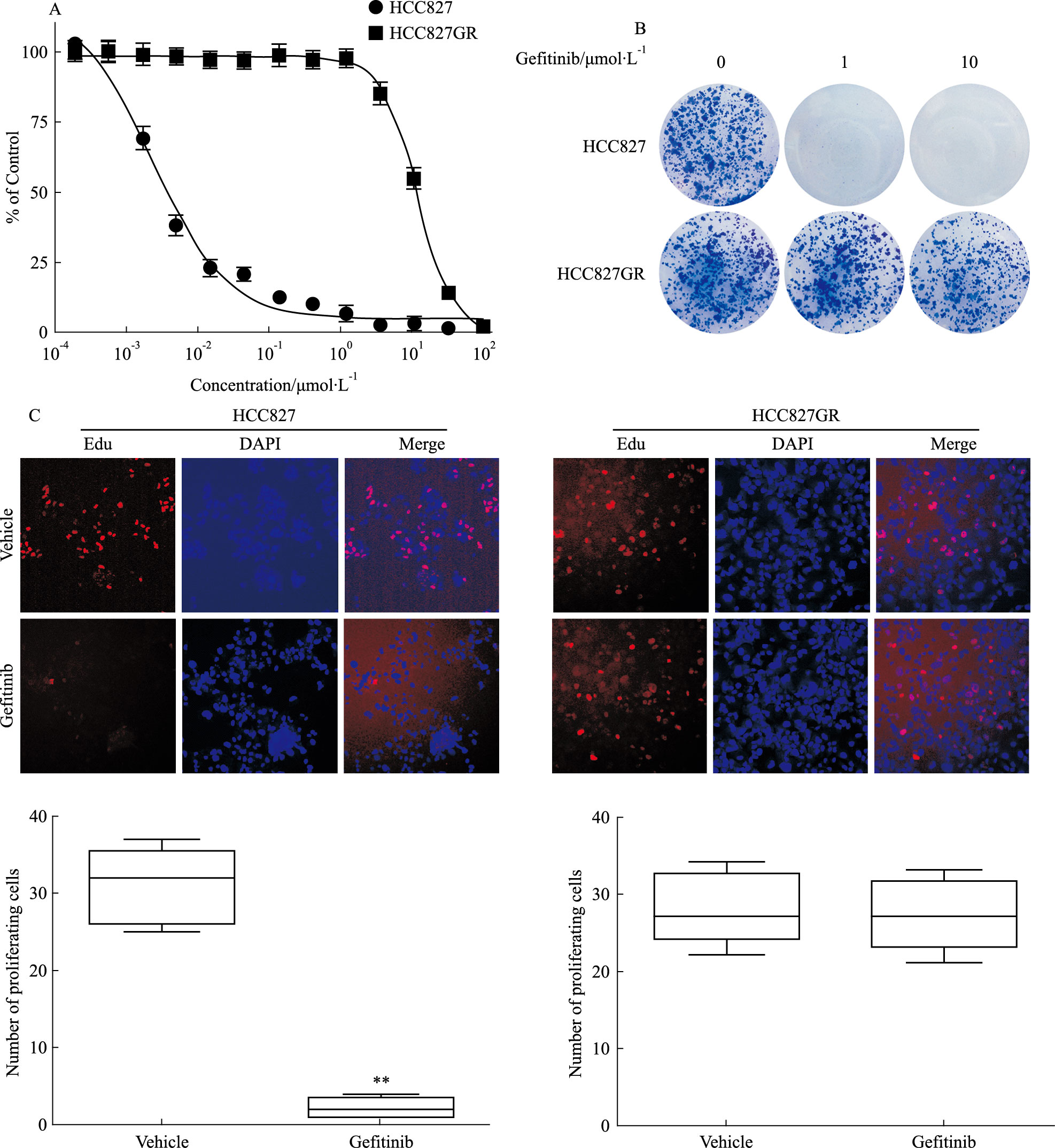
2 结果 2.1 HCC827GR耐药细胞的验证 2.1.1 gefitinib对HCC827和HCC827GR细胞活力的影响我们采用MTT法对HCC827GR的耐药性进行了检测,并以HCC827亲本细胞作为对照,结果显示,gefitinib对19位外显子E746-A750缺失突变的HCC827亲本细胞的IC50值为(2.3±0.16)nmol·L-1,而对HCC827GR细胞的IC50值为(12.4±0.48)μmol·L-1(Fig 1A),两者相差约5 000倍,表明HCC827GR细胞对gefitinib产生了耐受。
2.1.2 gefitinib对HCC827和HCC827GR克隆形成的影响我们进一步采用克隆形成实验检测了gefitinib对HCC827和HCC827GR细胞的生长抑制作用,结果如Fig 1B所示,gefitinib在1 μmol·L-1浓度时几乎已完全抑制了HCC827细胞的克隆形成,但是对HCC827GR的生长无影响,且在10 μmol·L-1浓度时,gefitinib也未能完全抑制HCC827GR细胞形成细胞克隆。
2.1.3 gefitinib对HCC827和HCC827GR细胞增殖的影响Edu细胞增殖检测的实验结果如Fig 1C显示,Edu(红色荧光)标记增殖的细胞,Hochest(蓝色荧光)标记肿瘤细胞核,在1 μmol·L-1浓度时,gefitinib可有效抑制HCC827细胞的增殖,而对HCC827GR细胞增殖无影响,gefitinib对两种细胞的增殖抑制作用差异有显著性。
|
| Fig 1 Growth inhibition of gefitinib against HCC827 and HCC827GR cells A:Cells were treated with gefitinib or vehicle for 72 h,and cell viability was determined by MTT assay;B:Cells were treated with gefitinib or vehicle for 12 days,and clonies were stained with crystal violet and photographed;C:Cells were treated with gefitinib for 24 h,followed by Edu cell incorporation assay.**P<0.01 vs Vehicle |
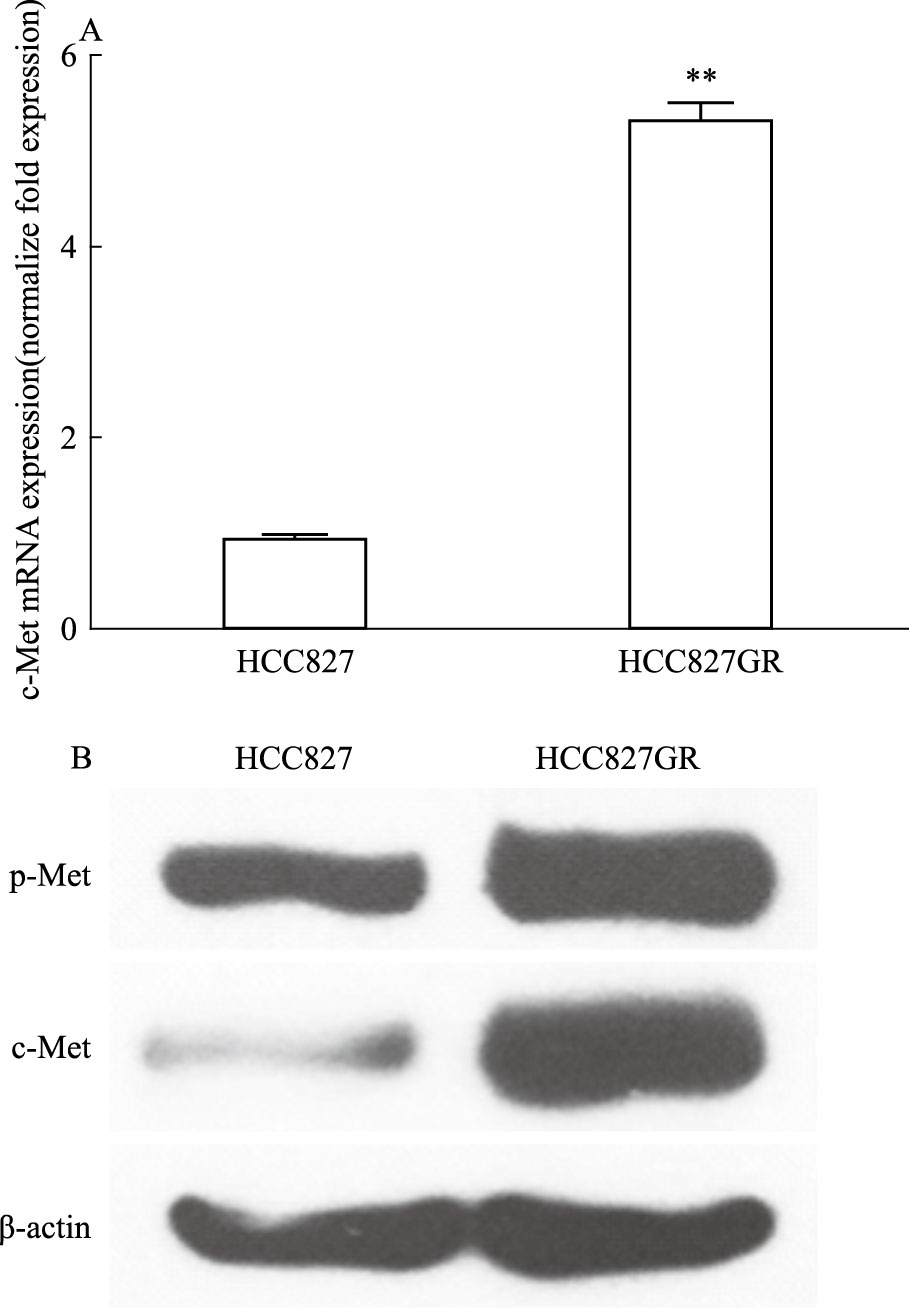
为验证HCC827GR是否具有c-Met基因扩增的特性,我们对两种细胞的c-Met表达水平进行了对比研究。RT-PCR的实验结果显示,HCC827GR细胞中c-Met mRNA表达水平明显高于HCC827细胞(Fig 2A)。Western blot的实验结果进一步证明,在蛋白水平上,HCC827GR细胞中总c-Met和活性c-Met的表达也明显高于HCC827亲本细胞(Fig 2B),表明诱导产生的HCC827GR细胞c-Met高表达。
|
| Fig 2 c-Met expression in HCC827 and HCC827GR cells A:c-Met mRNA expression was determined by quantitative RT-PCR;B:Expression of c-Met protein was determined by Western blot. **P<0.01 vs HCC827 |
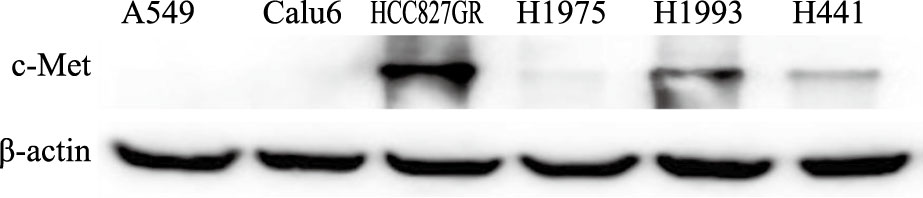
我们收集了6种NSCLC细胞株,并对其c-Met蛋白表达水平进行了检测。结果如Fig 3所示,A549、Calu6和H1975 3种细胞中c-Met表达水平较低;H1993和H441是已知的NSCLC细胞中c-Met高表达的细胞[6],它们的c-Met蛋白表达量较上述3种细胞略高;而HCC827GR细胞的c-Met表达水平又明显高于H1993和H441。
|
| Fig 3 Expression level of c-Met protein in several NSCLC cells |
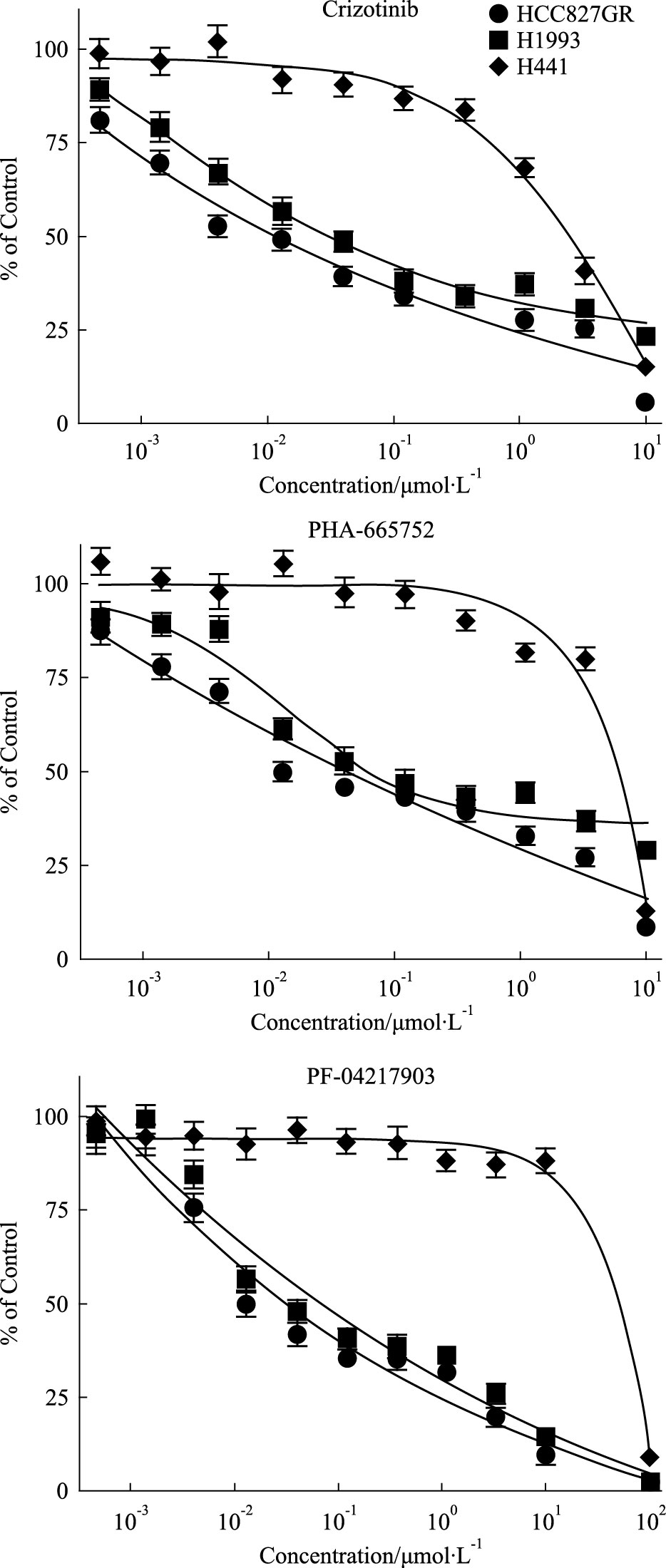
我们进一步采用c-Met抑制剂crizotinib、PHA-665752和PF-04217903处理c-Met表达水平较高的3种细胞HCC827GR、H1993和H441,以评估它们对c-Met抑制剂的敏感性。结果显示,药物对细胞的生长抑制作用与细胞中c-Met表达水平有较高的相关性,c-Met表达量越高的细胞,药物对其抑制作用越明显,3种细胞中HCC827GR c-Met表达水平较高,对3种c-Met抑制剂均更为敏感(Fig 4)。
|
| Fig 4 Sensitivity of HCC827GR, H1993 and H441 to c-Met inhibitors |
HCC827细胞是具有EGFR 19位外显子E746-A750缺失突变的NSCLC细胞,对gefitinib高度敏感,采用常规的浓度递增式诱导方法,要获得对gefitinib耐受的HCC827GR细胞,需要约6个月时间[7-8]。而本研究在诱导过程中加入了HGF,使耐药细胞的诱导时间缩短至1个月,其理论依据即在于,HCC827细胞本身就含有少量c-Met基因扩增的细胞克隆[7]。采用gefitinib和HGF共同处理的方法,一方面大量杀灭了敏感细胞,另一方面刺激了c-Met基因扩增的细胞克隆快速增殖,从而达到高效筛选并富集这类耐药克隆的目的。采用此种方法诱导产生的HCC827GR细胞与文献报道的单纯采用gefitinib诱导的耐药细胞一样,细胞活力、克隆形成和细胞增殖不再受gefitinib影响,且在撤掉HGF以后传代数次,耐药性仍持续存在。进一步的基因和蛋白水平的检测结果证实,HCC827GR细胞中c-Met高表达。
基于靶点的筛选和基于表型的筛选是新药研发常用的研究手段,前者通过靶点甄选和针对该靶点的酶水平测试筛选药物,得到的化合物往往达不到预期的疗效;后者利用疾病相关表型直接筛选,得到的化合物有效率高,但是在药物靶点鉴定和作用机制研究中难度较大。本研究中我们成功诱导了c-Met高表达的HCC827GR细胞,该细胞生长依赖于c-Met活性,对c-Met抑制剂高度敏感。采用该细胞进行药物筛选,比一般的表型筛选模型更具优势,可通过观察细胞活力这一表型直接筛选到潜在的c-Met抑制剂,在c-Met抑制剂筛选和药物靶点鉴定中具有重要用途。
综上所述,本研究高效诱导了对gefitinib耐受的HCC827GR细胞,该细胞生长高度依赖于c-Met蛋白活性,对c-Met抑制剂敏感,可作为c-Met抑制剂的表型筛选模型。
| [1] | Kreamer K, Riordan D. Targeted therapies for non-small cell lung cancer: an update on epidermal growth factor receptor and anaplastic lymphoma kinase inhibitors[J]. Clin J Oncol Nurs, 2015, 19 (6) : 734-42 doi:10.1188/15.CJON.734-742. |
| [2] | Pérez-Ramírez C, Cañadas-Garre M, Molina M Á, et al. MET/HGF targeted drugs as potential therapeutic strategies in non-small cell lung cancer[J]. Pharmacol Res, 2015, 102 : 90-106 doi:10.1016/j.phrs.2015.09.016. |
| [3] | 权修权, 朴惠顺, 康琳, 等. 抗肿瘤靶向药物研究现状[J]. 中国药理学通报, 2015, 31 (5) : 610-4 . Quan X Q, Piao H S, Kang L, et al. Research status of anti-tumor targeted drugs[J]. Chin Pharmacol Bull, 2015, 31 (5) : 610-4 . |
| [4] | Hage C, Rausch V, Giese N, et al. The novel c-Met inhibitor cabozantinib overcomes gemcitabine resistance and stem cell signaling in pancreatic cancer[J]. Cell Death Dis, 2013, 4 : e627 doi:10.1038/cddis.2013.158. |
| [5] | Surriga O, Rajasekhar V K, Ambrosini G, et al. Crizotinib, a c-Met inhibitor, prevents metastasis in a metastatic uveal melanoma model[J]. Mol Cancer Ther, 2013, 12 (12) : 2817-26 doi:10.1158/1535-7163.MCT-13-0499. |
| [6] | Wu W, Bi C, Credille K M, et al. Inhibition of tumor growth and metastasis in non-small cell lung cancer by LY2801653, an inhibitor of several oncokinases, including MET[J]. Clin Cancer Res, 2013, 19 (20) : 5699-710 doi:10.1158/1078-0432.CCR-13-1758. |
| [7] | Turke A B, Zejnullahu K, Wu Y L, et al. Preexistence and clonal selection of MET amplification in EGFR mutant NSCLC[J]. Cancer Cell, 2010, 17 (1) : 77-88 doi:10.1016/j.ccr.2009.11.022. |
| [8] | Shien K, Toyooka S, Yamamoto H, et al. Acquired resistance to EGFR inhibitors is associated with a manifestation of stem cell-like properties in cancer cells[J]. Cancer Res, 2013, 73 (10) : 3051-61 doi:10.1158/0008-5472.CAN-12-4136. |

