


2. 内蒙古精神卫生中心,内蒙古 呼和浩特 010010;
3. 鄂尔多斯市中心医院药剂科,内蒙古 鄂尔多斯 017000
2. Inner Mongolia Mental Health Center, Hohhot 010010,China ;
3. Dept of Pharmacy, Erdos Central Hospital,Ordos Inner Mongolia 017000,China
阿尔茨海默病(Alzheimer’s disease,AD)是多病因诱发的中枢神经退行性疾病,细胞外β-淀粉样蛋白(amyloid beta,Aβ)聚集形成老年斑(senile plaque,SP)是AD的明显病理特征[1]。β-淀粉样蛋白是一种神经毒性物质,被认为是神经元凋亡的诱导因素,在AD的发病中起着重要的作用。近年研究表明,Aβ可通过诱导凋亡相关基因,如Bcl-2、Bax、p53等表达改变,从而导致神经元缺失[2]。Bcl-2蛋白家族及其家族成员共同构成一个异常复杂的相互作用网络,调控细胞凋亡。其调节细胞凋亡的机制可能与Bcl-2蛋白家族与线粒体、Bcl-2蛋白的相互作用、细胞内Ca2+及氧自由基有关。然而,在表观遗传学方向的研究鲜有报道。
DNA甲基化修饰是最早发现的基因修饰方式之一,是人类表观遗传学研究的一项非常重要的内容。DNA的甲基化修饰主要是发生在CpG 二核苷酸中的胞嘧啶上,其主要过程是在CpG甲基化结合蛋白(methyl-CpG binding proteins,MBDs)和DNA甲基转移酶(DNA methyltransferases,DNMTs)的作用下,将甲基从S-腺苷蛋氨酸(SAM)转移到胞嘧啶的5’端,使CpG 二核苷酸的胞嘧啶转变成为5’甲基胞嘧啶。DNA 甲基化可使基因发生沉默,降低其表达水平,而去甲基化改变则与之相反,可使已甲基化沉默的基因重新获得表达[3]。DNA甲基化调控致病基因的表达在AD中的研究已有一些报道,主要集中在DNA甲基化在Aβ生成、清除及毒性相关基因的调控[4-5]。一方面,AD 发病的相关基因β-淀粉样前体蛋白(β-APP)裂解酶(BACE)等低甲基化,表达增加;另一方面,抑制AD发病的基因(如NEP)高度甲基化,表达减少,最终导致β-淀粉样肽过量产生和沉积。然而,Aβ下游靶基因的表观遗传学调控鲜有报道。因此,对Aβ调控凋亡相关基因表达的表观遗传学机制的研究,可以为阐明AD的发病机制提供理论依据,为治疗和预防AD提供新的思路和方法。
1 材料与方法 1.1 仪器细胞培养箱(150i,Thermo);酶标仪(Bio-Rad Model680,美国);倒置显微镜(SN-CJ-αFD,Leica);低温高速离心机(3-18K,Sigma);电泳仪(DYCZ-40D,北京市六一仪器厂);Real-time RT-PCR仪(PikoReal 96,Thermo Scientific);全自动凝胶成像系统 (Upland CA,美国);Odyssey双色红外荧光成像系统(Odyssey clx LI-COR,美国)。
1.2 试剂人神经母细胞瘤SH-SY5Y细胞株(北京协和细胞资源中心);MTT试剂(Sigma);Aβ25-35(吉尔生化有限公司);改良型RPMI 1640培养基(Hyclone);FBS(Gibco);引物(上海生工生物工程股份有限公司);单克隆抗体Bax(ab32503,Abacm);Bcl-2(ab32124,Abacm);二抗β-actin(TA-09,ZSGB-BIO);RNAsimple Total RNA Kit(Tiangen,China);RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific,USA);QuantiFast SYBR Green PCR Kit(Quigen,Germany);TIANnmp Genomic DNA Kit(DP304-02,Tiangen);EZ DNA Methylation Kit(Zymo Research)。
1.3 细胞培养SH-SY5Y细胞株培养于Hyclone混合培养基(含体积分数为15%的新生牛血清),于37℃、5%的CO2培养箱中培养,每2~3 d以胰蛋白酶消化1 ∶2传代。取对数生长期细胞进行实验。空白对照组加入正常培养基,实验组分别加入含10 μmol·L-1 和25 μmol·L-1的Aβ25-35的工作液。
1.4 MTT法检测细胞活性取对数生长期细胞,计数并接种于96孔板,分组给药孵育72 h以后,每孔加入5 g·L-1 MTT 10 μL,37℃孵育4 h,弃上清,每孔加入150 μL DMSO,低速振荡10 min后,酶标仪测定490 nm处各孔的吸光度,实验重复3次。
1.5 Westernblot检测SH-SY5Y细胞凋亡相关蛋白Bcl-2、Bax表达 RIAP缓冲液裂解细胞,考马斯亮蓝结合法进行蛋白质含量定量。加上样缓冲液调到各组蛋白量一致,10% SDS-PAGE电泳直至溴酚蓝到达分离胶底部,转移至PVDF膜(100 V,2 h),预染蛋白marker确定蛋白分子量标准位置。含5%脱脂奶粉TTBS液封闭1 h,抗体Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、β-actin(1 ∶1 500)分别用封闭液按比例稀释后,4℃孵育过夜。TBST脱色3次,每次10 min;再用TBS脱色3次,每次10 min。荧光二抗(1 ∶10 000) 室温孵育1 h。TBST脱色步骤同上。Odyssey双色红外荧光成像系统摄片。ChemiScope analysis软件分析Bcl-2、Bax与β-actin条带的灰度比值,计算蛋白相对表达量。
1.6 Real-timePCR检测SH-SY5Y细胞DNMTs mRNA表达 根据Total RNA Kit 试剂盒操作说明分别抽提各种细胞的总RNA。取各组RNA各1 μg,进行逆转录反应生成cDNA。以cDNA为模板进行PCR扩增。具体操作根据QuantiFast SYBR Green PCR Kit试剂盒说明书和PikoReal 96 Real-time RT-PCR仪器操作说明书。PCR反应体系(10 μL):cDNA 1 μL,primer R(10 μmol·L-1) 0.5 μL,primer F(10 μmol·L-1) 0.5 μL,2×Taq PCR MasterMix 5 μL,RNase Free water 3 μL。PCR引物分别为DNMT1:上游 5′-GGTTCTTCCTCCTGGAGAATGTC-3′,下游5′-GTCTGGGCCACGCCGTACTG-3′; DNMT3A:上游 5′-ACCACGACCAGGAATTTGAC-3′,下游 5′-ATGTAGCGGTCCACCTGAAT-3′; DNMT3B:上游 5′-CGACCTCACAGACGACACAG-3′,下游 5′-CAAACTCCTTCCCATCCTGA-3′; MeCP2:上游5′-CCCCACCCTGCCTGAA-3′,下游
5′-GATGTGTCGCCTACCTTTTCG-3′; GAPDH:上游5′-CATCTAGGAGGGCTATGCTC-3′,下游5′-ATGTCACGCACGATTTCC-3′。 PCR反应条件为DNMT1: 预变性,95 ℃ 7 min,变性95 ℃5 s,退火60 ℃ 30 s,延伸60 ℃ 30s,循环45 次。以GAPDH为内参基因,目的基因的相对表达量=2-△△Ct,其中,ΔΔCt=(Ct靶基因-Ct内参)实验组-(Ct靶基因-Ct内参)对照组。每个目的基因进行3次重复实验,以Ct值做统计分析。
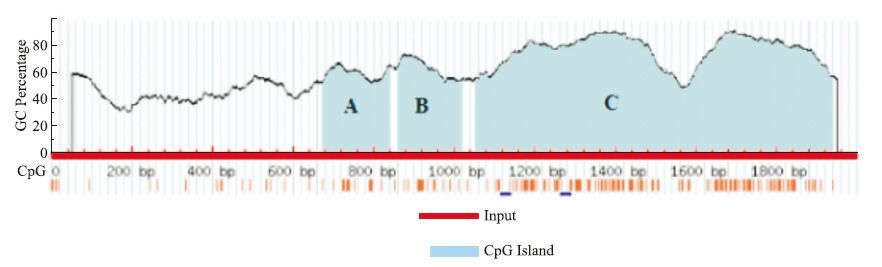
1.7 甲基化特异性PCR 1.7.1 引物设计通过Gene database online获得目的基因Bcl-2(NC_000018.10)的基因序列(http://www.ncbi.nlm.nih.gov/gene/),NCBI寻找目的基因启动子区(http://www.ncbi.nlm.nih.gov/),MethPrimer(http://www.urogene.org/methprimer/)预测CpG岛并筛选合适的引物,见Fig 1。Bax引物来自于参考文献。
|
| Fig 1 CpG islands prediction and sequence of promoter of Bcl-2 Three CpG islands were predicted with blue.A: Island 1 167 bp(674~840); B: Island 2 155 bp(865~1 019); C: Island 3 884 bp(1 054~1 937) |
依据试剂盒操作提取各组细胞的DNA,取每组DNA 500 ng,采用EZ DNA甲基化试剂盒进行亚硫酸盐修饰,以修饰后的DNA为模板进行PCR扩增(20 μL反应体系) :模板DNA 200 ng,dNTP(2.5 mmol·L-1)1.6 μL,上
游和下游引物(10 mmol·L-1) 1 μL(见Tab 1),MSP DNA Polymerase 2.5 U·μL-1和ddH2O补至20 μL。循环参数:95 ℃预变性5 min;94℃ 20 s,退火温度65℃ 30 s,72 ℃ 20 s,共35个循环;最后72 ℃延伸5 min。取5 μL扩增产物于2%琼脂糖凝胶电泳(120 V,40 min),在凝胶图像显像仪下观察结果。
| Gene | Up primer(5′-3′) | Down primer(5′-3′) | Size/bp |
| Bcl-2 methylation | TTTTTTTAGTTTTTGTTTTTATGGC | AAACCTTCTACTCAAACCTACGAC | 171 |
| Bcl-2 unmethylation | TTTTTAGTTTTTGTTTTTATGGTGT | AACCTTCTACTCAAACCTACAAC | 168 |
| Bax methylation | ACGTGACGGGATTAAATTTTTC | AAAAACCCCGCTAAACGT | 102 |
| Bax unmethylation | GTTATGTGATGGGATTAAATTTTTT | AAAAACCCCACTAAACATACA | 118 |
采用SPSS 13.0数据处理软件包处理,数据用x±s表示。两组及多组样本均数比较进行单因素方差分析。方差齐时,两两比较采用T检验法;方差不齐时,两两比较采用卡方检验法。
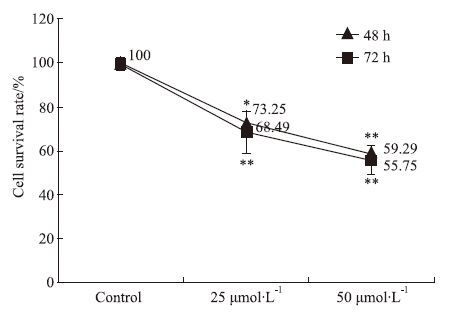
2 结果 2.1 Aβ25-35降低SH-SY5Y细胞存活率25 μmol·L-1 Aβ25-35作用细胞48 h和72 h以后,细胞存活率分别为(73.25±5.74)%和(68.49±9.83)%;50 μmol·L-1 Aβ25-35作用细胞48 h和72 h以后细胞存活率降低为(59.29±2.84)%和(55.75±6.19)%,与对照组比较差异均具有统计学意义(P<0.05)。结果显示随着时间和浓度的增加,细胞存活率逐渐降低,见Fig 2。因此,我们确定Aβ25-35诱导SH-SY5Y细胞凋亡的最佳浓度和时间为25 μmol·L-1和72 h。
|
| Fig 2 Effect of Aβ25-35 on cell viability in SH-SY5Y cells by MTT assay Cells were treated with various concentration of Aβ25-35 for 48 h or 72 h.*P<0.05,**P<0.01 vs control |
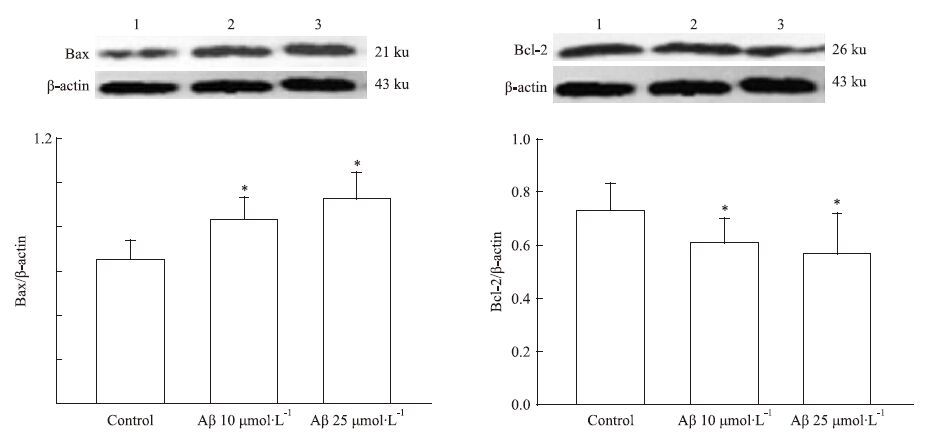
经10、25 μmol·L-1 Aβ25-35处理SH-SY5Y细胞72 h后,Western blot结果显示,Aβ25-35药物组Bax 表达明显增加,条带灰度值明显上升;Bcl-2蛋白表达减少,条带灰度值明显减少,与空白组比较差异具有统计学意义(P<0.05),见Fig 3。
|
| Fig 3 Western blot analysis of Bcl-2,Bax protein relative expression levels after incubation with Aβ25-35 for 72 h in SH-SY5Y cells The data were expressed as x±s from three independent experiments.*P<0.05 vs control. |
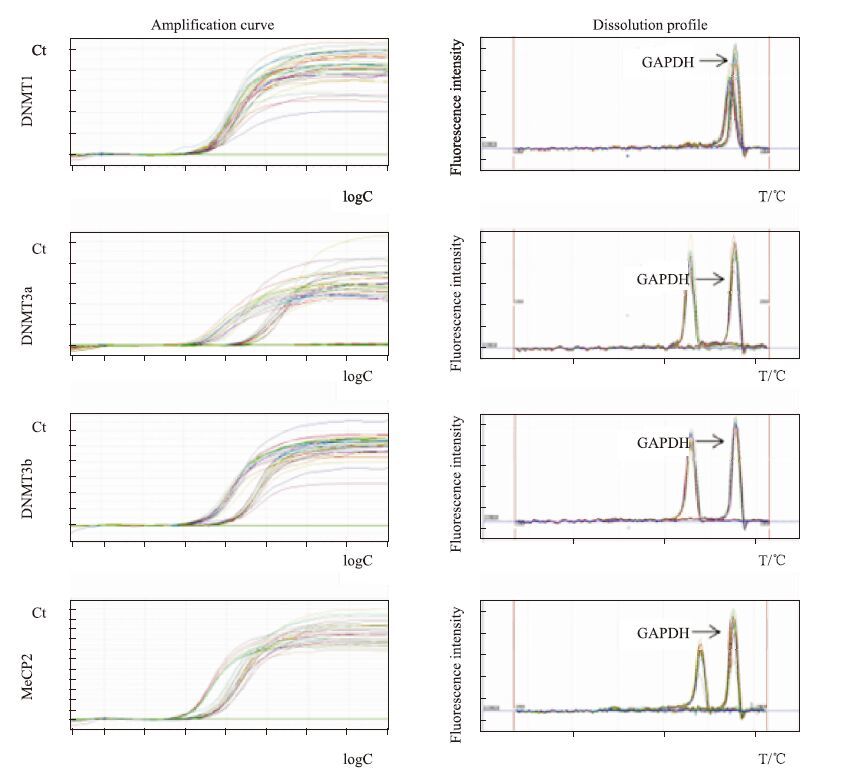
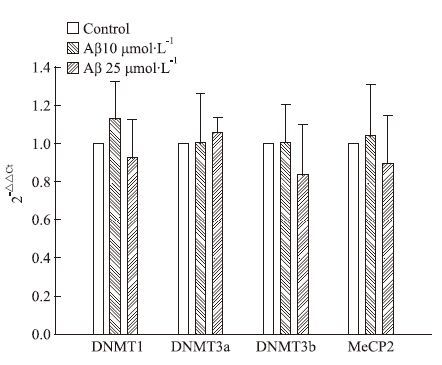
采用Real-time PCR技术检测各组细胞DNMT1、DNMT3a、DNMT3b、MeCP2基因表达水平,反应均获得满意的扩增曲线、熔解曲线,见Fig 4。随着Aβ25-35药物浓度的增加,DNMT1、DNMT3b、MeCP2的基因表达均有降低趋势,DNMT3a有增加的趋势,但与空白组比较差异均不具有统计学意义(P>0.05,n=3),见Tab 2、Fig 5。
|
| Fig 4 DNMT1,DNMT3a,DNMT3b,MeCP2 and GAPDH amplification curve and dissolution profile |
| Group | DNMT1 | DNMT3a | DNMT3b | MeCP2 |
| Control | 1.00 | 1.00 | 1.00 | 1.00 |
| Aβ 10 μmol·L-1 | 1.232±0.192 | 1.006±0.257 | 1.007±0.198 | 1.041±0.270 |
| Aβ 25 μmol·L-1 | 0.925±0.200 | 1.059±0.078 | 0.839±0.262 | 0.897±0.249 |
|
| Fig 5 DNMT1,DNMT3a,DNMT3b and MeCP2 expressions in SH-SY5Y cell by qRT-PCR analysis DNMT1,DNMT3a,DNMT3b and MeCP2 mRNA transcript levels in SH-SY5Y cells were normalized against GAPDH |
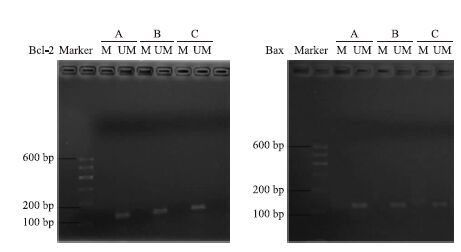
MSP结果显示,正常对照组SH-SY5Y细胞Bcl-2基因启动子区甲基化引物扩增阴性,非甲基化引物扩增阳性;10、25 μmol·L-1 Aβ25-35药物组Bcl-2基因启动子区甲基化引物扩增阴性,非甲基化引物扩增阳性,见Fig 6。MSP检测Bax启动子区甲基化结果显示,正常对照组SH-SY5Y细胞Bax 基因启动子区甲基化引物扩增阴性,非甲基化引物扩增阳性;10、25 μmol·L-1 Aβ25-35药物组Bax 基因启动子区甲基化引物扩增阴性,非甲基化引物扩增阳性,见Fig 6。
|
| 图 6 中文标题 Fig 6 Methylation-specific PCR analysis of methylation of Bcl-2 and Bax genes promoter A:Control;B:10 μmol·L-1 Aβ25-35;C:25 μmol·L-1 Aβ25-35.Methylation was detected by the presence of PCR product amplified by methylation-specific primers in the Meth lane; demethylation was detected using PCR products amplified with unmethylated-specific primers in the Ume lane.UM:unmethylated; M:methylation |
DNA的甲基化修饰在调控基因的表达、个体的发育和各种疾病中扮演着重要的角色。邓钰双等[6]研究发现,AD患者全脑基因的甲基化水平较同龄非AD患者降低,并且这种异常修饰与AD致病基因的表达相关。特定基因启动子区甲基化程度异常及全基因组甲基化程度减低均与AD的发生有着密切关系[7]。在凋亡通路的组成成分中,部分是基因产物,受DNA甲基化表观遗传修饰的影响[8]。项梦琦等[9]研究结果表明,腺苷(adenosine,ADO)联合同型半胱氨酸(homocysteine,HCY)可通过抑制甲基转移酶、降低细胞内甲基化代谢作用而活化抑癌基因p53,并诱导肝癌细胞凋亡。
Bcl-2 是第一个被发现与凋亡相关的基因,它编码26 ku的蛋白定位于线粒体膜、核膜和内质网,它的过度表达能抑制细胞凋亡。Bax是Bcl-2家族的一个成员,在决定细胞死亡或生存扮演着关键的角色。特别是,Bax和Bcl-2蛋白质含量之间的平衡对细胞凋亡的调节很重要。本实验结果显示,Aβ25-35引起的细胞凋亡伴随着Bcl-2蛋白表达减少,Bax 蛋白表达增加。目前有研究证实,在疾病状况下Bcl-2启动子区甲基化程度升高引起表达下调[10]。曾慧卉[11]研究发现,慢性阻塞性疾病患者肺组织中Bcl-2基因启动子区存在异常甲基化,且该异常甲基化与吸烟指数、肺血管内皮细胞凋亡均相关。此外,在结直肠癌和晚期前列腺癌组织中Bcl-2基因启动子是低甲基化的,Bcl-2甲基化与组织中 Bcl-2蛋白表达呈负相关[12],说明Bcl-2基因表达可以受到DNA甲基化的调控。然而,Aβ 介导的细胞Bcl-2、Bax基因甲基化依赖的表观遗传调控在AD的研究中尚无报道。本实验旨在研究细胞凋亡相关基因Bcl-2、Bax是否存在异常表观遗传调控,从而加速了AD的恶性进展。
DNA甲基化所导致的基因失活与基因突变或缺失不同,它不改变DNA序列,且CpG岛去甲基化可直接恢复抑癌基因的表达和功能。由于DNMTs活性的高低是DNA甲基化模式的主要决定因素,抑制DNMTs的活性将会导致甲基化模式的改变,因甲基化而沉默的基因可以重新获得表达,恢复正常的调控功能。迄今为止,哺乳动物细胞DNA 甲基化转移酶主要分为3 个家族:DNMT1、DNMT2 和DNMT3[13]。其中,DNMT1主要在DNA复制和修复过程中维持甲基位点的稳定性[14]。DNMT3a和DNMT3b蛋白是催化从头甲基化形成新的甲基化位点,对未甲基化和半甲基化DNA显示类似的活性[15]。此外,DNMT2几乎没有DNA甲基化催化活性,目前研究较少。MeCP2蛋白质作为转录抑制剂,具有去甲基化活动,它将甲基化胞嘧啶转变为胞嘧啶碱基,从而抑制基因转录[16]。为了研究Aβ是否影响目的基因启动子区甲基化,我们首先通过Real-time PCR技术检测不同浓度Aβ25-35处理组SH-SY5Y细胞中DNMTs的表达。目前结果显示,Aβ25-35对于SH-SY5Y细胞中DNMT1、DNMT3a、DNMT3b、MeCP2基因mRNA水平没有明显影响(P>0.05)。由此,我们推测Aβ介导SH-SY5Y细胞Bcl-2表达下调、Bax表达上调并非通过启动子区甲基化的变化。为了进一步验证我们的假设,我们通过在线软件设计了Bcl-2、Bax甲基化引物和非甲基化引物。采用MSP方法检测不同浓度的Aβ25-35作用SH-SY5Y细胞72 h以后,Bcl-2和Bax基因启动该区甲基化状态。MSP结果显示,Aβ25-35药物组与空白组的变化趋势相一致,即 Bcl-2、Bax基因甲基化引物扩增阴性,非甲基化引物扩增阳性。该结果表明,Aβ25-35介导凋亡未改变Bcl-2、Bax基因启动子区甲基化。这与先前的研究相一致,即Aβ介导细胞凋亡的过程中并未改变DNA甲基化酶的表达。
然而,鉴于MSP方法存在一定的局限性,只能定性分析目的基因启动子区的甲基化,而事实上,基因的甲基化状态改变与某些特定的CpG部位是有关的。Bcl-2基因启动子区的甲基化可能具有不同的易感性,本实验只局限于Bcl-2、Bax基因某一特定启动子区的CpG岛,其他CpG岛甲基化是否影响基因的表达还有待于进一步的验证。针对位点的研究可能带来靶向治疗的进展,未来我们将通过BSP(亚硫酸氢钠处理后测序法)的方法进一步分析CpG区域的甲基化频率来验证我们的实验结果。并通过微阵列技术检测待测的目的基因的每个CpG,以更详细地了解DNA甲基化的CpG区域,这将是我们未来的研究方向。未来还需要通过微阵列技术筛选出受到Aβ影响的启动子区甲基化差异的基因,进而对于某些低甲基化、高表达的AD相关基因可以采用靶向诱导DNA甲基化的方法促进其甲基化过程,抑制基因的表达对于AD的诊断和治疗将产生深远影响。
( 致谢: 所有实验内容于内蒙古医科大学药理实验室完成。特别感谢内蒙古医科大学常福厚教授提供GLP实验仪器的帮助。 )
| [1] | Hama E, Saido T C. Etiology of sporadic Alzheimer′s disease: somatostatin, neprilysin, and amyloid beta peptide[J]. Med Hypotheses, 2005, 65 : 498-50 doi:10.1016/j.mehy.2005.02.045. |
| [2] | Nestheide S, Bridge J A, Barnes M, et al. Pharmacologic inhibition of epigenetic modification reveals targets of aberrant promoter methylation in Ewing sarcoma[J]. Pediatr Blood Cancer, 2013, 60 (9) : 1437-46 doi:10.1002/pbc.v60.9. |
| [3] | Tahera N, McKenziea C, Garretta R, et al. Amyloid-β alters the DNA methylation status of cell-fate genes in an Alzheimer′s disease model[J]. J Alzheimers Dis, 2014, 38 (4) : 831-44 . |
| [4] | Mani S T, Thakur M K. In the cerebral cortex of female and male mice, amyloid precursor protein(APP) promoter methylation is higher in females and differentially regulated by sex steroids[J]. Brain Res, 2006, 1067 (1) : 43-7 doi:10.1016/j.brainres.2005.10.006. |
| [5] | Fuso A, Seminara L, Cavallaro R A, et al. Sadenosylmethionine/homocysteine cycle alterations modify DNA methylatio status with consequent deregulation of PSl and BACE andbeta-amyloid production[J]. Mol Cell Neurosci, 2005, 28 (1) : 195-204 doi:10.1016/j.mcn.2004.09.007. |
| [6] | 邓钰双, 余刚. 阿尔兹海默病中DNA甲基化对β-淀粉样蛋白的影响[J]. 遗传, 2014, 36 (4) : 295-300 . Deng Y S, Yu G. Effect of DNA methylation on β-amyloid in Alzheimer′s disease[J]. Hereditas, 2014, 36 (4) : 295-300 . |
| [7] | Sung H Y, Choi E N, Lyu D, et al. Amyloid beta-mediated epigenetic alteration of insulin-like growth factor binding protein 3 controls cell survival in Alzheimer′s disease[J]. PLos One, 2014, 9 (6) : e99047 doi:10.1371/journal.pone.0099047. |
| [8] | Muerkoster S S, Werbing V, Koch D, et al. Role of myofibrobmblats in innate chemoresistance of pancreatic carcinoma epigenetic downregulation of caspases[J]. Int J Cancer, 2008, 123 (8) : 1751-60 doi:10.1002/ijc.v123:8. |
| [9] | 项梦琦, 刘丽璇, 邓巍. 去甲基化机制在腺苷及同型半胱氨酸诱导肝癌HepG2细胞凋亡中的作用[J]. 中国药理学通报, 2014, 30 (7) : 973-9 . Xiang M Q, Liu L X, Deng W. Effect of demethylation on adenosine and homocysteine-induced apoptosis in HepG2 cells[J]. Chin Pharmacol Bull, 2014, 30 (7) : 973-9 . |
| [10] | Segura-Valdez L, Pardo A, Gaxiola M, et al. Upregulation of gelatinases A and B, collagenases 1 and 2, and increased parenchymal cell death in COPD[J]. Chest, 2000, 777 (3) : 684-94 . |
| [11] | 曾慧卉. Bcl-2基因启动子区异常甲基化在慢性阻塞性肺疾病肺血管内皮细胞凋亡中的作用[D]. 长沙:中南大学, 2012. Zeng H H. Bcl-2 gene promoter methylation abnormalities in the role of pulmonary vascular endothelium cell apoptosis in chronic obstructive pulmonary disease[D]. Changsha:Central South University, 2012. |
| [12] | Zhu Q, Jin Z, Yuan Y, et al. Impact of MTHFR gene C677T polymorphism on Bcl-2 gene methylation and protein expression in colorectal cancer[J]. Scand J Gastroenterol, 2011, 46 : 436-45 doi:10.3109/00365521.2010.537682. |
| [13] | Gao J, Wang L, Xu J, et al. Aberrant DNA methyltransferase expression in pancreatic ductal adenocarcinoma development and progression[J]. J Exp Clin Cancer Res, 2013, 32 : 86-92 doi:10.1186/1756-9966-32-86. |
| [14] | Song J, Rechkoblit O, Bestor T H, et al. Structure of DNMT1-DNA complex reveals a role for autoinhibition in maintenance DNA methylation[J]. Science, 2011, 331 (6020) : 1036-40 doi:10.1126/science.1195380. |
| [15] | Pawlak M, Jaenisch R. De novo DNA methylation by Dnmt3a and Dnmt3b is dispensable for nuclear reprogramming of somatic cells to a pluripotent state[J]. Genes Dev, 2011, 25 (10) : 1035-40 doi:10.1101/gad.2039011. |
| [16] | Hermann A, Gowher H, Jeltsch A. Biochemistry and biology of mammalian DNA methyltransferases[J]. Cell Mol Life Sci, 2004, 61 (19-20) : 2571-87 doi:10.1007/s00018-004-4201-1. |

