


2. 徐州医学院江苏省麻醉与镇痛应用技术重点实验室, 江苏 徐州 221004;
3. 南京军区南京总医院麻醉科, 江苏 南京 210002
李伟彦(1965-),男,博士,主任医师,博士生导师,研究方向:麻醉与镇痛的基础与临床,Tel:025-80860147,E-mail:weiyanlee@sina.com
2. Key Laboratory of Anesthesia and Analgesia Application Technology of Jiangsu Province, Xuzhou Medical College, Xuzhou Jiangsu 221004, China;
3. Dept of Anesthesiology, Nanjing General Hospital of Nanjing Military Command, Naning 210002, China
神经病理性疼痛(neuropathic pain,NeP)发展早期NF-κB被激活,NF-κB信号通路在脊髓中被活化,参与伤害性信息的传递和疼痛的产生[1]。p65是NF-κB的一个亚单位,其翻译后乙酰化修饰能够精细地调控NF-κB的转录活动。沉默信息调节因子1( silent information regulator 1,SIRT1) 是一种依赖烟酰胺腺嘌呤二核苷酸的组蛋白去乙酰化酶。研究表明,SIRT1能直接去乙酰化NF-κB的p65亚单位,降低其乙酰化水平,抑制NF-κB的激活[2]。白藜芦醇属于多酚化合物,具有抗氧化、抗自由基、抗炎等生物学活性,已有文献报道白藜芦醇是SIRT1的激动剂[3]。因此,我们推测白藜芦醇可能通过激活SIRT1,促进p65去乙酰化,从而抑制NF-κB活化来发挥镇痛作用。本研究观察L5脊神经结扎(spinal nerve ligation,SNL)大鼠脊髓内SIRT1和p65蛋白乙酰化水平的变化,并探讨SIRT1激活剂白藜芦醇对神经病理性疼痛的作用和可能机制。
1 材料与方法 1.1 实验动物和分组清洁级成年♂ SD大鼠,体质量180~220 g,由南京军区南京总医院比较医学科提供。实验所实行操作均符合国际疼痛研究会的准则,并且经动物伦理委员会许可。将鞘内置管成功的大鼠按照随机数表法分为6组(n=15),正常组(Naive组)、假手术组(Sham组)、疼痛对照组(SNL组)、高剂量白藜芦醇治疗组(High组)、中剂量白藜芦醇治疗组(Middle组)、低剂量白藜芦醇治疗组(Low组)。
1.2 鞘内置管大鼠腹腔注射2%的戊巴比妥钠50 μg·g-1。参考Milligan等[4]的方法,常规消毒后在大鼠腰5-6间隙纵行切开,依次分离筋膜和肌肉,显露L5白色椎板,摘除部分棘突后用5号针尖破脊间膜。用镊子将一段长为15 cm的PE-10导管(宁波市科技园区安来软件科技有限公司,中国) 经L5-L6向上置入2 cm,出现鼠尾侧向甩动视为穿刺成功。导管外端经皮下隧道至颈项部引出皮肤后固定,热熔封口。术后单笼饲养大鼠以防止导管脱落。置管成功3 d后,剔除运动功能异常的大鼠,经导管注入2%利多卡因15 μL,如注射后30 s内大鼠出现双后肢麻痹现象说明鞘内置管成功。
1.3 SNL模型采用Kim等[5]法制备SNL模型,即自大鼠背部L5棘突水平纵行切开皮肤,依次分离组织暴露右侧L5横突,剪去L5部分横突,显露L5脊神经后用5-0丝线结扎。用生理盐水清洗伤口后,分层缝合伤口,消毒,继续饲养。Naive组不做处理,Sham组仅暴露L5脊神经不结扎。
1.4 给药方案High、Middle、Low组分别将300、30、3 μg白藜芦醇溶于10 μL的100%二甲基亚砜(DMSO)溶剂中,于SNL术后d 4经鞘内导管给药,每天1次,连续给药4 d。SNL组则在相同时间点经鞘内导管注射10 μL 100% DMSO。
1.5 行为学测定SNL术后1、3、5、7、9、11、14 d,固定于上午8:00~10:00,采用热痛测痛仪器(Model390,IITC Science.Inc,美国),参照Hargreaves等[6]方法,对所有大鼠右足测定热缩足潜伏期(paw withdrawal latency,PWL)。测试前使大鼠在25℃安静环境中适应约30 min。测痛仪以5 mm光斑照射大鼠右侧第一足趾下着力点,照射时间不超过20s,以免出现灼伤。测试期间及时清除大鼠排泄在玻璃板上的大小便,以免影响热痛阈反应时间。每只大鼠均测量6次,每次间隔5min,去掉最大值和最小值,取4次测量值的平均值作为PWL。
1.6 标本采集SNL术后d 7,各组大鼠完成疼痛行为学测试后随机选择3只大鼠,腹腔注射2%的戊巴比妥钠80 μg·g-1处死。用于Western blot检测的标本用300~400 mL生理盐水快速冲洗血液,之后取出脊髓的腰膨大段快速放入液氮中短暂保持。用于免疫荧光检测的标本则再用400~500 mL 4%多聚甲醛先快后慢的灌注,取出脊髓的腰膨大段后,将其放入4%的多聚甲醛中后固定3 h,随后转入30%蔗糖中脱水2 d。
1.7 Western blot将脊髓组织剪切成细小的碎片。取适量的RIPA裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1 mmol·L-1。按照每20mg组织加入150~250 mL裂解液的比例加入裂解液。用玻璃匀浆器匀浆,直至充分裂解。蛋白定量后,加入SDS上样缓冲液,沸水煮浴使其变性后,进行SDS-PAGE电泳,转膜,5%的脱脂牛奶室温封闭1 h,加一抗:兔抗大鼠SIRT1(1 ∶2000,Abcam,美国)或兔抗大鼠乙酰化NF-κB p65(1 ∶ 1000,Pierce,美国),4℃孵育过夜。复温后,弃一抗,TBST清洗5min×6次,加HRP标记的羊抗兔二抗(1 ∶1000,Cell Signaling Technology公司,美国)室温孵育1 h,TBST清洗5min×6次,暗室内加显色底物显色曝光。定影内参为β-actin ( 1 ∶1000,Cell Signaling Technology公司,美国)。以目的条带灰度值与β-actin灰度值的比值反映SIRT1和乙酰化p65的表达水平。所得条带经Adobe公司Photoshop软件半定量分析处理。
1.8 免疫组织荧光染色取多聚甲醛固定的L4~6腰膨大标本,经蔗糖溶液梯度脱水后用冰冻切片机进行连续切片,片厚20μm。5%的BSA封闭1h,随后加入磷酸化p65单克隆抗体(1 ∶200,Santa Cruz Biotechnology,美国),4℃孵育过夜。用PBS清洗5min×3次后,加入异硫氰酸荧光素标记的二抗( 1 ∶300,Santa Cruz Biotechnology,美国),室温避光孵育2h,漂洗3次。每个标本随机抽取5张切片,普通荧光显微镜下观察。
1.9 统计学分析采用SPSS 16.0 软件进行统计学分析,计量资料以±s表示。大鼠行为学结果采用重复测量设计的方差分析,SIRT1、乙酰化p65蛋白表达采用单因素方差分析。组间两两比较采用LSD检验。
2 结果 2.1 大鼠PWL的变化6组大鼠术前PWL差异无统计学意义(P>0.05)。Sham组术侧后肢PWL各时间点未见明显改变(P>0.05)。SNL组大鼠与Sham组比较,PWL明显降低(P<0.05);High、Middle组与SNL组比较,大鼠术后各时间点PWL增高(P<0.05),但与Sham组相比仍存在统计学意义(P<0.05),提示鞘内注射300、30 μg白藜芦醇均可以减轻SNL大鼠的热痛敏反应。SNL组和Low组术后各时间点PWL差异无统计学意义(P>0.05),提示鞘内注射3 μg白藜芦醇无镇痛作用。见Fig 1。
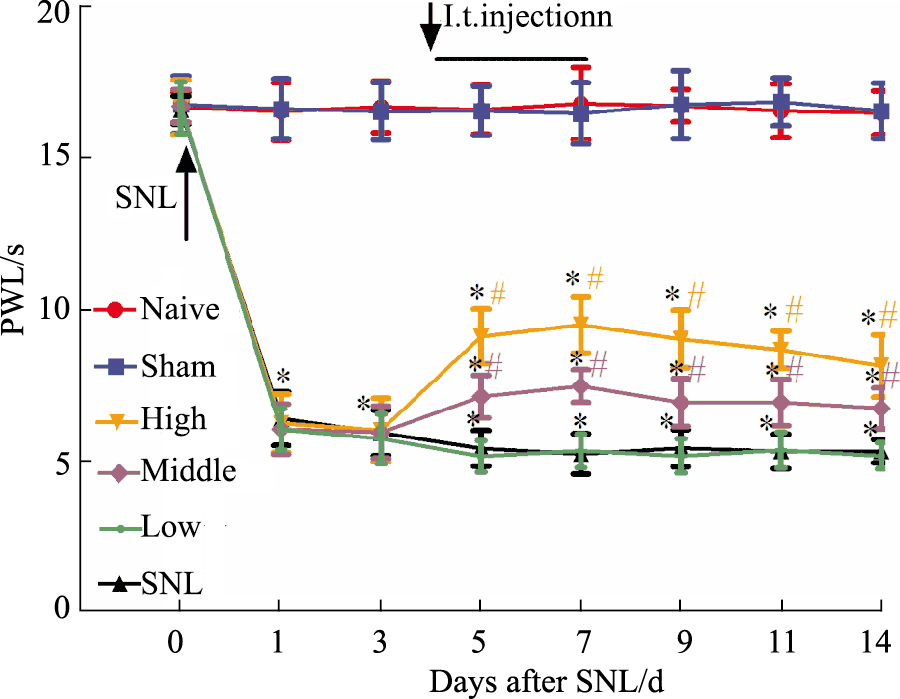
|
| Fig 1 Changes of PWL in all rats Comparison of PWL in rats with different treatments: *P<0.05 vs Sham group; #P<0.05 vs SNL group |
SNL术后d 7,与Sham组相比,SNL组脊髓腰膨大中的SIRT1蛋白含量明显降低(P<0.05)。与SNL组相比,High、Middle组脊髓腰膨大中SIRT1含量明显升高(P<0.05),而Low组SIRT1蛋白含量无明显变化(P>0.05)。见Fig 2A。与Sham相比,SNL组脊髓腰膨大中的乙酰化p65的含量明显升高(P<0.05)。与SNL相比,High、Middle组脊髓腰膨大中乙酰化p65含量明显下降(P<0.05),而Low组乙酰化p65蛋白量无明显变化(P>0.05)。见Fig 2B。

|
| Fig 2 Expression of SIRT1 and Ac-p65 in the lumbar spinal cord of rats at d7(n=5) A:The expression of SIRT1 in rats with different treatments; B:The expression of Ac-p65 in rats with different treatments. *P<0.05 vs Sham group; #P<0.05 vs SNL group |
免疫荧光染色结果显示,Sham组大鼠腰段脊髓背角中活化的NF-κB表达量较少。与Sham组相比,SNL活化的NF-κB表达量明显增加。与SNL相比,Low组表达无明显变化,而High组活化的NF-κB表达量明显降低,见Fig 3。

|
| Fig 3 NF-κB expression in the spinal cord at d7(n=5)(×200) Representative immunofluorescence detection of actived NF-κB in the rat spinal dorsal horns among different groups.*P<0.05 vs Sham group; #P<0.05 vs SNL group |
乙酰化是一种重要的翻译后修饰,可以调节目标蛋白质的功能活性,与多种生理和病理过程密切相关。用药物干扰组蛋白乙酰化的过程可以影响疼痛的行为,相反地,病理性疼痛状态可能影响相关的伤害感受器基因的组蛋白乙酰化状态[7]。组蛋白乙酰转移酶(histone acetyltransferases,HAT)以及组蛋白去乙酰化酶(histone deacetylase,HDAC)相互拮抗、共同维持蛋白质乙酰化水平的动态平衡。
Yeung等[2]率先提出,SIRT1作为一种重要的HDAC,可以直接去乙酰化NF-κB的p65亚单位,降 低其乙酰化水平。敲除SIRT1基因可导致NF-κB过度乙酰化[8]。这都提示SIRT1是催化NF-κB去乙酰化的关键酶。白藜芦醇是去乙酰化酶SIRT1的激动剂,属于多酚化合物,具有抗氧化、抗自由基、抗炎等生物学活性。同时白藜芦醇还可穿透血脑屏障,对神经产生保护作用,对外周和中枢神经炎症疾病有较好的防治作用[9]。有研究证实鞘内注射白藜芦醇能通过上调SIRT1蛋白表达,进而发挥延迟或减轻神经病理性疼痛的作用[3],但其具体机制还未见完整的报道。本研究探索了SIRT1激活剂白藜芦醇对神经病理性疼痛的影响。由于SNL模型热痛阈变化明显,稳定性好,可靠性高,所以我们选择SNL模型作为本次神经病理性疼痛的模型。外周给予白藜芦醇难以通过血脑屏障,为了更好的研究中枢效应,本实验选择鞘内注射。 行为学显示SNL术后即产生了明显的热痛阈值降低现象,并且持续至术后14 d。实验结果表明每天注射300 μg和30 μg 白藜芦醇可以缓解SNL大鼠神经病理性疼痛的热痛敏症状,并且缓解效果以连续给药后d 4为甚。所以我们选择给药后d 4来研究大鼠脊髓中蛋白的变化。而停止给药后,白藜芦醇的镇痛作用呈逐渐减弱的趋势。提示每天注射一定剂量的白藜芦醇可以明显减轻大鼠神经病理性痛,这种镇痛作用随着给药时间的延长逐渐减弱。每天注射3 μg白藜芦醇没有明显镇痛作用。同时,实验过程中各组大鼠均无明显不良反应,说明鞘内注射白藜芦醇是安全、可靠的。
NF-κB信号通路的异常激活与神经病理性疼痛的发生、发展密切相关[1]。我们发现疼痛组大鼠脊髓中NF-κB的表达明显高于正常对照组,这与之前的研究相一致[10]。研究证实白藜芦醇可以抑制NF-κB信号通路[11]。因此,我们推测白藜芦醇通过抑制NF-κB信号通路活性,来达到缓解神经病理性疼痛的作用。本研究中,我们利用免疫荧光法来检测磷酸化p65亚基的表达来代表大鼠脊髓背角中NF-κB的活化程度。白藜芦醇干预4 d后,High组(300 μg白藜芦醇组)大鼠脊髓背角中活化的NF-κB表达减少,Low组(3 μg白藜芦醇组)大鼠脊髓NF-κB活化程度无明显变化。免疫荧光的结果与各组大鼠PWL变化情况相一致,进一步确认了白藜芦醇的镇痛作用,并且表明其镇痛作用至少有一部分是通过抑制NF-κB通路而实现。
NF-κB/p65亚单位上310位赖氨酸(lysine,Lys)的乙酰化修饰水平与 NF-κB 的活性有明显的正相关性。p65去乙酰化过程中,发挥主要作用的HDAC是SIRT1[12]。因此,我们推测白藜芦醇是否通过激活SIRT1的HDAC活性来影响p65乙酰化,达到对NF-κB的抑制作用。为此,我们进一步检测了各组大鼠脊髓中乙酰化的p65和SIRT1的含量。结果显示:SNL术后大鼠脊髓中乙酰化 p65含量明显升高,提示 p65的过度乙酰化可能参与了神经病理性疼痛的发生发展。连续4 d鞘内注射300、30 μg白藜芦醇后,模型大鼠脊髓内乙酰化 p65水平明显降低,同时也逆转了SNL导致的痛觉高敏现象。同时我们发现SNL组大鼠脊髓腰膨大组织中SIRT1呈低表达状态,这与之前研究结果一致[3],300μg和30μg 白藜芦醇对SIRT1蛋白有明显的激活作用,但不能使SIRT1升至正常水平。提示SIRT1激活剂白藜芦醇逆转了p65的过度乙酰化,影响NF-κB表达,这可能是白藜芦醇镇痛作用的机制之一。
综上所述,结扎腰5脊神经可降低SIRT1水平,乙酰化p65蛋白表达增多,激活NF-κB通路,促进大鼠产生神经病理性疼痛。鞘内注射一定量的白藜芦醇能通过上调SIRT1来抑制p65乙酰化,从而降低NF-κB的表达,发挥镇痛作用。本研究在更深入阐明神经病理性痛的发病机制的同时,为治疗神经病理性疼痛提供新的思路。
(致谢:本实验在南京军区南京总医院比较医学科麻醉科实验室完成,在此衷心感谢我的导师李伟彦教授的耐心培养,实验室刘清珍老师的细心指导,各位同学的合作和帮助!)
| [1] | Ledeboer A, Gamanos M, Lai W, et al. Involvement of spinal cord nuclear factor κB activation in rat models of proinflammatory cytokine-mediated pai n facilitation[J]. Eur J Neurosc,2005,22(8):1977-86. |
| [2] | Yeung F,Hoberg J E,Ramsey C S,et al.Modulation of NF-κB-depende nt transcription and cell survival by the SIRT1 deacetylase[J].EMBO J,2004,23(12):2369-80. |
| [3] | Yin Q, Lu F F, Zhao Y, et al. Resveratrol facilitates pain attenuation in a rat model of neuropathic pain through the activation of spinal Sirt1[J]. Regi Onal Anesth Pain Med,2013,38(2):93-9. |
| [4] | Milligan E D, Hinde J L, Mehmert K K, et al. A method for increasing the viability of the external portion of lumbar catheters placed in the spinal sub arachnoid space of rats[J]. J Neuro Sci Meth,1999,90(1):81-6. |
| [5] | Kim S H, Chung J M. An experimental model for peripheral neuropathy pro duced by segmental spinal nerve ligation in the rat[J].Pain,1992,50(3):355-63. |
| [6] | Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J]. Pain,1988,32(1):77-88. |
| [7] | Denk F, McMahon S B. Chronic pain:Emerging evidence for the involvement of epigenetics[J]. Neuron, 2012,73(3):435-44. |
| [8] | Giblin W, Skinner M E, Lombard D B. Sirtuins:guardians of mammalian healthspan[J]. Trends Genet,2014,30(7):271-86. |
| [9] | 成薇,沈长波,王莉,等.白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响[J]. 中国药理学通报, 2015,31(1):113-8.[9] Cheng W,Shen C B,Wang L,et al.Effect of resveratrol pretreatment on proliferation of cortical neural stem cells after oxygen-glucose deprivation/reoxygenation injury in rats[J].Chin Pharmacol Bull,2015,31(1):113-8. |
| [10] | Chou C W, Wong G T, Lim G, et al. Spatiotemporal pattern of concurrent spinal and supraspinal NF-kappa B expression after peripheral nerve injury[J]. J Pain, 2011,12(1):13-21. |
| [11] | Park H J, Jeong S K, Kim S R, et al. Resveratrol inhibits Porphyromonas gingivalis lipopolysaccharide-induced endothelial adhesion molecule expression by suppressing NF-κB activation[J]. Arch Pharmacal Res, 2009,32(4):583-91. |
| [12] | Kauppinen A, Suuronen T, Ojala J, et al. Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders[J]. Cell Signal, 2013, 25(10):1939-48. |
