


2. 安徽医科大学第一附属医院药学部, 国家中医药管理局中药化学三级实验室 TCM-2009-202, 安徽 合肥 230022
2. Dept of Pharmacy, The First Affiliated Hospital of Anhui Medical University, Third-Grade Pharmaceutical Chemistry Laboratory of State Administration of Traditional Chinese Medicine, Hefei 230022, China
难治性呼吸系统疾病病程长、发病机制不明确,不易治疗。近年来由于大气污染、吸烟、工业经济发展等因素,这类疾病的发病率逐年增加,因此对于难治性呼吸系统疾病的治疗及发病机制的研究十分必要。
核转录相关因子-2(nuclear factor etythroid-2 related factor 2,Nrf2)是机体各类细胞参与抗氧化的关键因子[1]。在正常生理情况下Nrf2不被激活,主要与其特异性抑制受体Kelch样ECH相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)结合存在于细胞质中;当氧化应激发生时,Nrf2被激活,进入到细胞核内,启动抗氧化反应元件(antioxidant response element,ARE),调节体内氧化应激水平,提高机体对外界刺激的抗性,影响相关疾病的进程[2]。近年来的研究表明[3],Nrf2/Keap1/ARE信号通路与肺纤维化、肺癌、慢性阻塞性肺病(COPD)等难治性呼吸系统疾病的发展有密切联系。当给予Nrf2/Keap1/ARE信号通路激动剂如莱菔硫烷(SFN)时,能够明显抑制或促进相关疾病的病理进程,这说明Nrf2/Keap1/ARE可能作为治疗难治性呼吸系统疾病的研究靶点。本综述将通过介绍Nrf2/Keap1/ARE信号通路对难治性呼吸系统疾病的影响,探讨该信号通路的具体作用机制,为难治性呼吸系统疾病的治疗提供参考。
1 Nrf2/Keap1/ARE信号通路的作用机制 1.1 Nrf2、Keap1、ARE的结构Nrf2属于CNC(cap-‘n’-collar)转录因子家族成员,是具有碱性亮氨酸拉链(b-ZIP)结构的66-ku蛋白,其中含有6个高度保守的结构域Neh(Nrf2-ECH homology),分别被命名为Neh1-Neh6,如Fig1所示。Neh1-Neh6结构域功能如下[4]:Neh1 区主要与细胞核内小Maf 蛋白(small Maf proteins)形成异二聚体,使Nrf2 能够识别、结合ARE,从而启动目标基因转录。Neh2区是Nrf2与胞质蛋白Keap1结合区,含有ETGE基序、DLG基序两个结合位点。Neh3是维持Nrf2转录活性的必不可少的结构域。Neh4、Neh5是参与启动下游基因转录的结构域,当进入细胞核的Nrf2以Nrf2-Maf 的形式与ARE 结合后并不能立即启动转录,尚需要其他辅助蛋白如CREB结合蛋白、转录激活剂与Nrf2 的Neh4、Neh5两个结构域结合后,才能启动转录过程。Neh6结构域中含有大量的丝氨酸残基,但其具体功能目前尚不明确。Nrf2主要表达于如肝脏、肾脏等代谢和解毒组织中,以及其它持续暴露在环境中的组织如皮肤、肺、消化道等,普遍表达于各种细胞。
Keap1是一种胞质蛋白伴侣分子,位于染色体19p13.2位点,包含5个主要的结构域:N末端序列(NTR)、大复合体形成序列(BTB)、富含半胱氨酸插序列(IVR)、富含双甘氨酸序列(DGR)以及C末端序列(CTR),如Fig1。其中IVR和BTB富含半胱氨酸,很容易进行氧化还原反应,是调控Nrf2所必须的结构域。DGR区含有6个Kelch功能域,它们形成β折叠结构与Nrf2结合[4]。
ARE是细胞核内一个特异的DNA启动子结合序列,位于第Ⅱ相解毒酶和抗氧化酶基因的5′端启动序列[4]。ARE能够被核内的Nrf2激活,调控第Ⅱ相解毒酶和抗氧化酶基因的表达,影响体内氧化应激水平。
1.2 Nrf2/Keap1/ARE信号通路的激活在正常生理状态下,Nrf2位于胞质中,与其特异性抑制性受体Keap1结合,基本无活性,且Keap1可促进Nrf2的泛素化降解过程,故Nrf2表达较低。氧化应激源作用下,Nrf2与Keap1解偶联,转移入核,通过bZIP与小分子肌腱纤维瘤蛋白异二聚体化,从而启动ARE,调控第Ⅱ相解毒酶和抗氧化酶基因的表达,这些基因包括还原型辅酶Ⅱ(NADPH)、醌氧化还原酶1(NQO1)、血红素氧合酶(HO-1)等,它们能够增强细胞和组织对氧化应激的抗性,从而影响相关疾病的进程[5]。
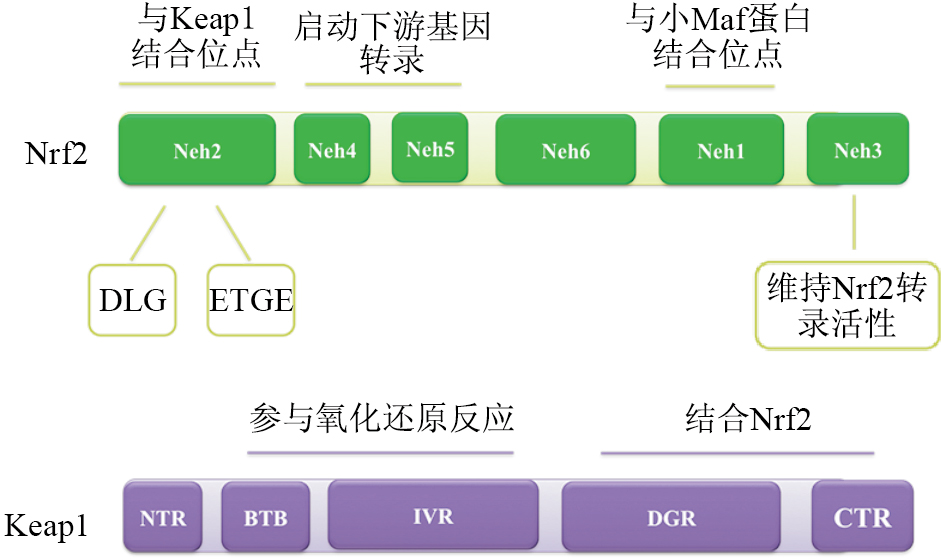
|
| Fig.1 Charts and the corresponding functions of nuclear transcription factor-2(Nrf2) and its specific inhibitory receptors Kelch-like ECH-associated protein-1(Keap1) |
由于呼吸系统直接参与体内外气体交换,极易受到外界刺激,从而导致氧化应激的发生。研究表明,抗氧化信号通路Nrf2/Keap1/ARE能够影响多种难治性呼吸系统疾病的发生发展[2],给予Nrf2/Keap1/ARE信号通路激动剂能够促进或抑制有关病理过程,说明该信号通路对这类疾病有重要的调控作用。
2.1 Nrf2/Keap1/ARE信号通路对肺纤维化的影响肺纤维化(pulmonary fibrosis,PF)是以弥漫性、进行性肺间质纤维增生和肺泡结构紊乱并最终导致肺功能障碍为特点的疾病,是一种严重的、渐进的慢性肺部疾病[6]。肺纤维化的发病机制至今尚未完全阐明[5]。转化生长因子-β1(transforming growth factor beta1,TGF-β1)是促进肺纤维化进程中的关键因子[5]。目前的研究表明,氧化应激的发生能够激活TGF-β1并增强TIMPs活性,从而导致胶原的大量合成以及细胞外基质的沉积,促进肺纤维化发生。除此之外,氧化应激还能够导致炎性细胞的浸润,加重肺组织损伤程度。
由于Nrf2/Keap1/ARE信号通路的抗氧化作用,其对肺纤维化的影响越来越受到关注。体内和体外实验研究表明,Nrf2/Keap1/ARE信号通路上调HO-1、NQO1等抗氧化物的表达,调控体内氧化应激水平,降低肺纤维化大鼠的死亡率,减少细胞外基质(如胶原)的合成,保护肺部组织,提高细胞抗性;抑制成纤维细胞转分化为肌成纤维细胞,下调α-SMA 的表达,最终起到抗肺纤维化的作用[7, 8]。Kikuchi 等[9]的研究表明,在博来霉素诱导的小鼠肺纤维化模型中,Nrf2能够通过调节Th1/Th2平衡,降低小鼠体内氧化应激水平,从而抑制肺纤维化的发生。
虽然有研究显示Nrf2/Keap1/ARE信号通路的激活对肺纤维化有抑制作用,但最新的研究显示[10],Nrf2/Keap1/ARE持续激活,将导致体内抗氧化水平持续升高,反而促进肺纤维化的发展。经查阅文献后分析,体内的过氧化物及过氧化物酶过多时会造成机体的损伤,然而若Nrf2/Keap1/ARE持续激活,则体内抗氧化水平过高、过氧化物及过氧化物酶水平过低,导致抗氧化酶催化的氧化还原反应中产生的细胞毒性物质如过氧化氢等,无法被过氧化物和过氧化物酶水解,从而逐渐累积,最终损伤细胞,加重疾病程度。综上,Nrf2/Keap1/ARE信号通路激活程度对PF的影响还需要进一步探讨。
2.2 Nrf2/Keap1/ARE信号通路对肺癌的的影响有研究表明[11, 12, 13],Nrf2在癌症中可能是一个原癌基因或能够调控原癌基因高表达。肺癌发生于支气管黏膜上皮,发病机制尚不明确,调查显示肺癌的死亡率居我国恶性肿瘤死亡率的第1位[14]。前期研究认为,吸烟是导致肺癌的最主要原因,但现阶段的统计结果显示仍有10%~20% 的非吸烟肺癌患者,这说明可能存在导致肺癌的新途径[14]。非小细胞肺癌(NSCLC)占所有肺癌的85%[14],其在烟民和非吸烟者中均十分常见。此处仅介绍Nrf2/Keap1/ARE信号通路与NSCLC之间的联系。
目前对于肿瘤的治疗最主要采用化疗法,但由于肿瘤细胞容易产生耐药性,故治疗效果不佳。研究显示Nrf2与肿瘤耐药性密切相关,Alexander 等[15]使用乌拉坦对BALB种系小鼠肺癌造模后,发现Nrf2基因缺失小鼠对肿瘤的敏感性远远低于野生型小鼠。另外,Bauer 等[16]的研究表明,Nrf2还能够诱导肿瘤细胞的耐药性,导致化学药物治疗失败,加重癌症程度。这是因为Nrf2/Keap1/ARE信号通路能够调控体内谷胱甘肽、还原型辅酶Ⅱ、超氧化物歧化酶、HO-1等第Ⅱ项解毒酶和抗氧化酶的表达,提高了肿瘤细胞的抗性,降低肿瘤细胞对化疗药物的敏感性,诱导肿瘤细胞耐药的产生,进而加重癌症病情。但Homma 等[17]对另一品系、相同模型的小鼠基因敲除Keap1后发现,敲除Keap1的小鼠体内Nrf2水平高于野生型小鼠,而肺癌细胞的转移率却低于野生型小鼠,说明Nrf2可能抑制肺癌的发生,这与Alexander、Bauer等的研究结果相矛盾。产生这种矛盾的原因可能有两点,一方面,虽然Nrf2激活后产生的大量抗氧化物可能诱导肿瘤细胞产生耐药性,但抗氧化物同时也能够保护正常细胞、降低体内炎性水平,减轻化疗药物对机体的损伤;另一方面,由于实验采用的小鼠品系不同,不同品系的小鼠的有关基因型对癌症的抵抗力、Nrf2及其激活产物的敏感性存在差别,从而导致矛盾的实验结果。以上论述表明,Nrf2/Keap1/ARE信号通路对肺癌的影响,还需要从Nrf2/Keap1/ARE信号通路的激活程度、不同品系基因型区别等方面进行全面、系统的研究。
2.3 Nrf2/Keap1/ARE信号通路对慢性阻塞性肺病的影响慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以有害气体或颗粒所引起的,以不完全可逆的气流受限为特点,并进行性加重的慢性呼吸系统疾病,由于其缓慢进行性发展,严重影响患者的劳动能力和生活质量。随着吸烟人群的增多以及环境污染的加重,COPD的发病率和死亡率居高不下,专家预测到2020年,COPD可能成为世界第三大流行病[18]。
COPD的发病机制与多种因素有关,其中氧化应激起到了十分重要的作用[19]。污染的空气、香烟中含有大量的过氧化物,它们进入机体后使体内过氧化物与抗氧化物失衡,导致氧化应激的发生。研究表明[20],COPD患者体内过氧化物水平以及呼出气体中过氧化氢水平明显高于正常人。过氧化物能够刺激炎性细胞,进而激活核转录因子κB(NF-κB)释放大量的炎性因子如IL-8、TNF-α,最终影响COPD的发展。另外[21],过氧化物还能够促进细胞凋亡、增加DNA损伤、加强弹性蛋白酶的活性,从而进一步加重COPD程度。这些研究均说明,氧化应激能够诱导COPD的发生或加重COPD的程度。
在体实验证实[22],对小鼠进行肺气肿造模后,相较于造模后的野生型小鼠,Nrf2基因敲除小鼠肺泡灌洗液中氧化应激的相关指标明显增高,肺部组织炎症水平加重,细胞凋亡增加;进一步对Nrf2基因敲除小鼠移植骨髓细胞后,阻碍了早期的炎症发展并减轻了肺气肿的程度。体外实验同样证实,当克拉拉细胞暴露于香烟环境中时,给予Nrf2激动剂,发现Nrf2大量表达后增加细胞中抗氧化物水平,能够保护细胞、降低细胞的死亡率。除此之外,Nrf2的缺失还能够影响肺泡Ⅱ型细胞的生长,从而导致肺部损伤修复的失败。研究表明[23],受Nrf2/Keap1信号通路所调控表达的第Ⅱ解毒酶类以及抗氧化物如HO-1、NQO1等对COPD也有一定影响。如HO-1除了抗氧化作用,还能够降低肺部巨噬细胞内炎症水平、减少肺泡Ⅱ型细胞凋亡,从而抑制COPD的发展。
这些研究表明,Nrf2/Keap1/ARE信号通路激活后,能够从调节体内氧化应激水平、减少细胞凋亡、控制炎症程度等方面抑制COPD的发展,这为COPD的治疗提供了潜在的治疗靶点。由于目前环境污染越来越严重,COPD的发病率逐年增加,因此Nrf2/Keap1/ARE信号通路的激活对COPD疾病是否能够起到有效的预防作用,需要进一步研究。
2.4 Nrf2/Keap1/ARE信号通路对急性肺损伤的影响急性肺损伤(acute lung injury,ALI)是由心源性以外的各种肺内外致病因素所致的急性肺泡-毛细血管膜损伤,严重的ALI或者ALI的最终严重阶段被定义为急性呼吸窘迫综合征(ARDS)[24]。ALI发病机制复杂,病死率高,是临床常见的危重症。ALI发生时将促进中性粒细胞的聚集、黏附和激活,这是导致过度炎症的主要原因[25]。除了介导促炎与抗炎因子水平的失衡,中性粒细胞被激活后,能够增加氧气的摄取速率,激活NADPH氧化酶,促进过氧化物的合成,导致过氧化物/抗氧化物失衡,诱导氧化应激的发生。氧化应激能够引起DNA损伤、促进细胞凋亡,同时引发脂质过氧化,导致氧自由基的扩散,逐步加深肺损伤的程度。
近年来对抗氧化与ALI之间的关系越来越受到关注,其中就包括对Nrf2/Keap1/ARE信号通路的研究。研究表明[26],该通路能够通过抑制NF-κB的激活,影响体内炎性因子的释放,从而缓解ALI程度;另外,Nrf2/Keap1/ARE信号通路在氧化应激时被激活后,促进其下游蛋白HO-1的表达,HO-1是一种重要的抗炎、抗氧化、起到细胞保护的酶类,能够减轻缺血/再灌注所致大鼠急性肺损伤的程度。除此之外,对Nrf2基因敲除小鼠进行造模后,发现与野生型小鼠相比,基因敲除小鼠ALI的程度更重、死亡率高,这可能与Nrf2缺失后,过氧化物酶体增殖物激活受体γ(PPARγ)表达被抑制有关[27]。PPAR-γ不仅与脂肪形成、葡萄糖/脂质平衡有关,其在抗炎反应中也起到了关键的作用。
通过分析以上研究结果,Nrf2/Keap1/ARE减轻ALI的作用可能与抗氧化、抗炎有关。Nrf2/Keap1/ARE信号通路被激活后,一方面通过调控下游抗氧化蛋白如HO-1的表达,维持体内氧化/抗氧化的平衡;另一方面,还能够通过抑制NF-κB的激活、诱导抗炎反应重要因子PPARγ的表达,缓解炎症程度,从抗炎和抗氧化两个方面同时减少ALI对肺部结构和功能的损害,最终减轻ALI程度。以上论述说明,Nrf2/Keap1/ARE信号通路可能作为治疗ALI的有效靶点。
2.5 Nrf2/Keap1/ARE信号通路对支气管哮喘的影响支气管哮喘(bronchial asthma,简称哮喘)是一种世界范围内的常见病和多发病。其中支气管哮喘迁延难愈,随着病程的延长,常常威胁患者的健康,给患者的家庭及社会带来沉重的负担。近年来的研究表明,Nrf2/Keap1/ARE信号通路的激活对过敏性哮喘有着重要的影响。
体内和体外实验均证实[28],当吸入这些污染物时,将产生大量的活性氧,此时将激活Nrf2/Keap1/ARE信号通路,调控抗氧化酶如谷胱甘肽的表达,提高细胞的自我防御能力,减轻哮喘的程度。若基因敲除Nrf2的小鼠暴露在烟尘环境中,8周后发现,Nrf2基因敲除小鼠较野生型小鼠更容易发生咳嗽、气喘。这表明Nrf2/Keap1/ARE信号通路调控相关抗氧化酶基因的表达,提高机体的抗氧化能力,影响哮喘的发生。另外,Nrf2/Keap1/ARE信号通路还参与了哮喘的炎症反应[29]。这是由于在炎症反应早期,Nrf2/Keap1/ARE信号通路的激活可以抑制促炎介质,包括细胞因子类、炎症趋化因子类、细胞黏附分子的产生和表达,抑制炎症反应进一步加重。由于支气管哮喘是一种气道非特异性的炎症性疾病,炎症反应贯穿于哮喘发病过程的始终,这种长期的炎症反应可以进一步导致哮喘的加重以及哮喘气道重构的产生,从而使哮喘病症更加难以治愈。因此,早期激活Nrf2/Keap1/ARE信号通路无疑能从抑制炎症反应发展的角度防治哮喘。
3 展望Nrf2/Keap1/ARE作为体内调控氧化应激水平的关键信号通路,在肺纤维化、肺癌、慢性阻塞性肺病等难治性呼吸系统疾病的发生发展过程中发挥了重要作用。Nrf2/Keap1/ARE信号通路影响难治性呼吸系统疾病发生发展的作用机制主要与抗炎和抗氧化作用有关,如Fig2所示。抗炎作用主要通过抑制炎性因子的释放如IL-8、TNF-α,进而缓解炎症水平;抗氧化作用主要通过调控第Ⅱ相解毒酶和抗氧化酶基因的表达,从而提高细胞对氧化应激的抗性。然而,Nrf2/Keap1/ARE信号通路的激活程度的不同可能对疾病的发生发展起到相反的作用,如适度激活对PF起抑制作用,而持续激活则促进PF。另外,Nrf2/Keap1/ARE信号通路对肺癌的影响可能与基因型有关,不同基因型下该通路的作用结果可能不同。
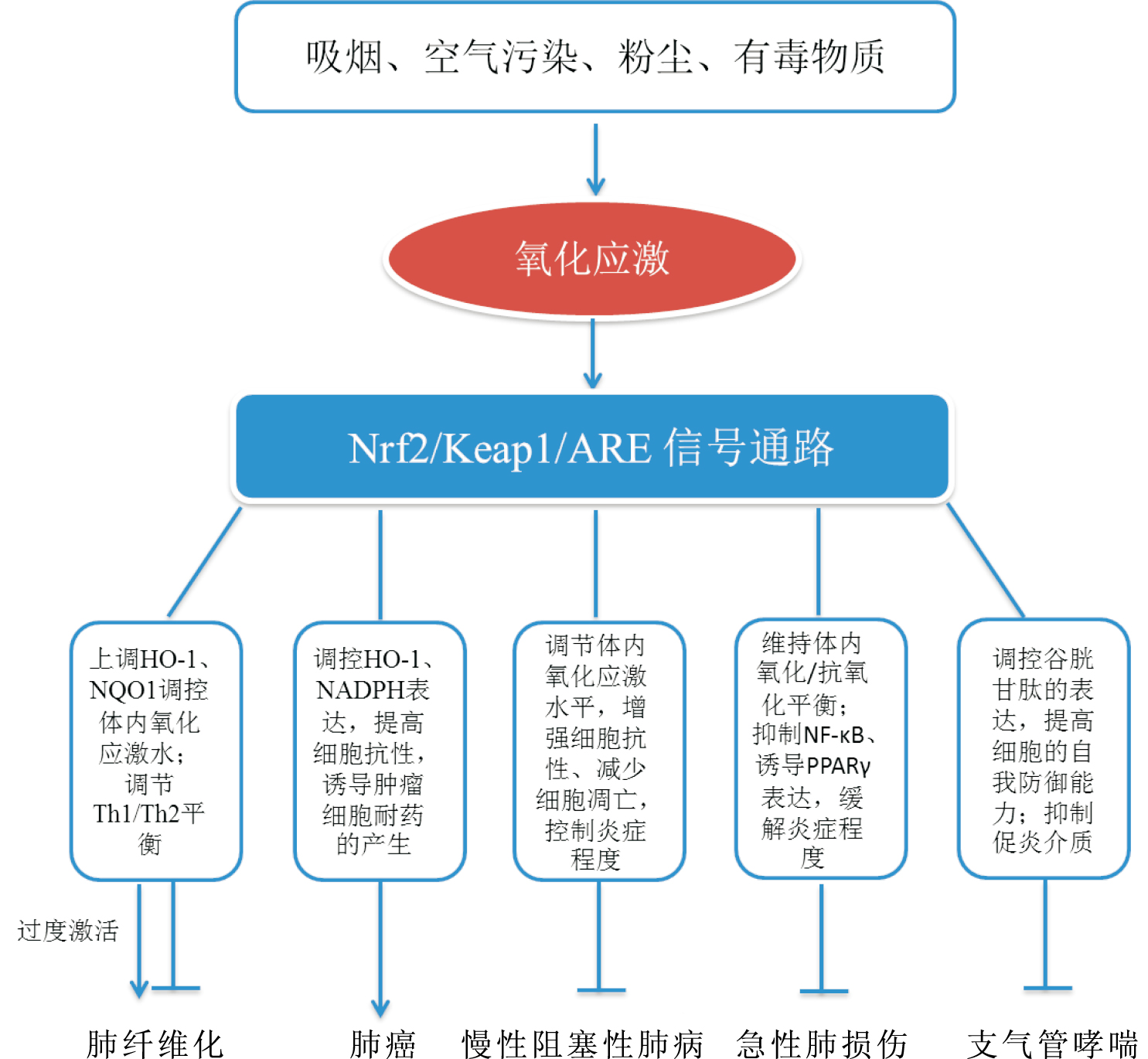
|
| Fig.2 The relationship between Nrf2/Keap1/ARE pathway and respiratory diseases |
综上,Nrf2/Keap1/ARE信号通路可能作为药物治疗难治性呼吸系统疾病的潜在靶点,这为难治性呼吸系统疾病的治疗提供了新的思路,但其作用机制和作用效果仍需要进一步研究。
| [1] | Ma Q. Role of Nrf2 in oxidative stress and toxicity[J]. Annu Rev Pharmacol Toxicol, 2013, 53(1): 401-26. |
| [2] | Niture S K, Khatri R, Jaiswal A K. Regulation of Nrf2—an update[J]. Free Radic Biol Med, 2014, 66(1): 36-44. |
| [3] | Hybertson B M, Gao B, Bose S K, et al. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation[J]. Mol Aspects Med, 2011, 32(2):234-46. |
| [4] | Lo S C, Li X, Henzl M T, et al. Structure of the Keap1 Nrf2 interface provides mechanistic insight into Nrf2 signaling[J]. EMBO J, 2006, 25(15):3605-17. |
| [5] | Zhang D D. The Nrf2-Keap1-ARE signaling pathway: the regulation and dual function of Nrf2 in cancer[J]. Antioxid Redox Signal, 2010, 13(11):1623-6. |
| [6] | Hunninghake G M. A new hope for idiopathic pulmonary fibrosis[J]. N Engl J Med, 2014, 370(22): 2142-3. |
| [7] | Cheresh P, Kim S J, Tulasiram S, Kamp D W. Oxidative stress and pulmonary fibrosis[J]. Biochim Biophys Acta, 2013, 1832(7): 1028-40. |
| [8] | Temneanu O R, Zamfir C, Cojocaru E, et al. Oxidants and antioxidants relevance in rats' pulmonary induced oxidative stress[J]. J Med Life, 2011, 4(3): 244-9. |
| [9] | Kikuchi N, Ishii Y, Morishima Y, et al. Nrf2 protects against pulmonary fibrosis by regulating the lung oxidant level and Th1/Th2 balance[J]. Respir Res, 2010, 11(31): 1186-96. |
| [10] | Zucker S N, Fink E E, Bagati A, et al. Nrf2 amplifies oxidative stress via induction of Klf9[J]. Mol Cell, 2014, 53(6): 916-28. |
| [11] | Jaramillo M C, Zhang D D. The emerging role of the Nrf2-Keap1 signaling pathway in cancer[J]. Gene Dev, 2013, 27(20): 2179-91. |
| [12] | Taguchi K, Motohashi H, Yamamoto M. Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution[J]. Genes Cells, 2011, 16(2): 123-40. |
| [13] | Kansanen E, Kuosmanen S M, Leinonen H, et al. The Keap1-Nrf2 pathway: mechanisms of activation and dysregulation in cancer[J]. Redox Biol, 2013, 1(1): 45-9. 赵真真, 王忠敏, 茅爱武. 非小细胞肺癌的介入治疗现状[J]. 介入放射学杂志, 2014, 23(3): 272-6. |
| [14] | Zhao Z Z, Wang Z M, Mao A W. Current situation of interventional treatment for non-small cell lung cancer[J]. J Intervent Radiol, 2014, 23(3): 272-6. |
| [15] | Alexander C M. The involvement of NRF2 in lung cancer[J]. Oxid Med Cell Longev, 2013, 2013:746432. |
| [16] | Bauer A K, Cho H Y, Miller-De Graff L, et al. Targeted deletion of Nrf2 reduces urethane-induced lung tumor development in mice[J]. PLoS One, 2011, 6(10): 1-15. |
| [17] | Homma S, Ishii Y, Morishima Y, et al. Nrf2 enhances cell proliferation and resistance to anticancer drugs in human lung cancer[J]. Clin Cancer Res, 2009, 15(10): 3423-32. |
| [18] | Pauwels R A, Buist A S, Ma P, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease[J]. Respir Care, 2001, 46(8):798-825. |
| [19] | Fischer B M, Voynow J A, Ghio A J. COPD: balancing oxidants and antioxidants[J]. Int J Chron Obstruct Pulmon Dis, 2015, 10(1): 261-76. |
| [20] | Rahman I, MacNee W. Antioxidant pharmacological therapies for COPD[J]. Curr Opin Pharmacol, 2012, 12(3): 256-65. |
| [21] | Antus B, Kardos Z. Oxidative stress in COPD: molecular background and clinical monitoring[J]. Curr Med Chem, 2015, 22(5): 627-50. |
| [22] | Boutten A, Goven D, Artaud-Macari E, et al. NRF2 targeting: a promising therapeutic strategy in chronic obstructive pulmonary disease[J]. Trends Mol Med, 2011, 17(7): 363-71. |
| [23] | Reddy N M, Kleeberger S R, Cho H Y, et al. Deficiency in Nrf2-GSH signaling impairs type Ⅱ cell growth and enhances sensitivity to oxidants[J]. Am J Resp Cell Mol, 2007, 37(1): 3-8. |
| [24] | Carnesecchi S, Pache J C, Barazzone-Argiroffo C. NOX enzymes: potential target for the treatment of acute lung injury[J]. Cell Mol Life Sci, 2012, 69(14): 2373-85. |
| [25] | Narasaraju T, Yang E, Samy R P, et al. Excessive neutrophils and neutrophil extracellular traps contribute to acute lung injury of influenza pneumonitis[J]. Am J Pathol, 2011, 179(1): 199-210. |
| [26] | Soromou L W, Chen N, Jiang L, et al. Astragalin attenuates lipopolysaccharide-induced inflammatory responses by down-regulating NF-κB signaling pathway[J]. Biochem Biophys Res Commun, 2012, 419(2): 256-61. |
| [27] | Cho H Y, Gladwell W, Wang X, et al. Nrf2-regulated PPARγ expression is critical to protection against acute lung injury in mice[J]. Am J Respir Crit Care Med, 2010, 182(2): 170-82. |
| [28] | Li Y J, Kawada T, Azuma A. Nrf2 is a protective factor against oxidative stresses induced by diesel exhaust particle in allergic asthma[J]. Oxid Med Cell Longev, 2013, 13(1): 1-5. |
| [29] | Wendell S G, Baffi C, Holguin F. Fatty acids, inflammation, and asthma[J]. J Allergy Clin Immun, 2014, 133(5): 1255-64. |

