


2. 天津中医药大学方剂学教育部重点实验室, 天津 300193
2. Ministry of Education Key Laboratory of Traditional Chinese Medical Formulae, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
异补骨脂素是一种呋喃香豆素类成分,存在于补骨脂等多种药材中,2010药典中将异补骨脂素及其同分异构体补骨脂素作为药材补骨脂(Psoralea corylifolia L.)的质量控制成分。补骨脂可用于治疗更年期综合征、骨质疏松等,其中异补骨脂素有雌激素样作用[1],可选择性作用于雌激素受体α[2],可以促进成骨细胞分化成熟[3],有利于骨质疏松的治疗,是补骨脂中一种有效成分。近年来发现临床中补骨脂及其相关制剂可能导致肝损害,并有胆汁淤积的表现[4, 5],而动物实验发现异补骨脂素、补骨脂素、异补骨脂苷、补骨脂苷为主要成分的补骨脂水提物有明显肝毒性[6],更有研究表明异补骨脂素和补骨脂素对小鼠肝功能有一定影响[7],这提示补骨脂导致的胆汁淤积性肝损害现象可能与异补骨脂素和补骨脂素有关。更进一步推测就是异补骨脂素和补骨脂素干扰了胆汁酸的正常合成转运,从而导致胆汁淤积的发生。通常认为胆汁酸是胆固醇在肝细胞内经由CYP7A1(7-α羟化酶,cytochrome P450,family 7,subfamily A,polypeptide 1)、CYP27A1(甾醇 27-羟化酶,cytochrome P450,family27,subfamily A,polypeptide 1)等酶合成[8],而BSEP (胆盐输出泵,也称为ABCB11,ATP-binding cassette,sub-family B,member 11)、MRP2(多药耐药相关蛋白2,也称为ABCC2,ATP-binding cassette,sub-family C,member 2)、MRP3(多药耐药相关蛋白3,也称为ABCC3,ATP-binding cassette,sub-family C,member 3)、OATP2 (有机阴离子转运多肽2,也称为OATP1B1,SLCO1B1,solute carrier organic anion transporter family,member 1B1)、OSTα(有机溶质转运蛋白α,也称为SLC51A,solute carrier family 51,alpha subunit)、NTCP (钠-牛磺胆酸共转运蛋白,也称为SLC10A1,solute carrier family 10,member 1)是肝细胞膜上的与胆汁酸转运相关的转运体,这些酶和转运体在胆汁酸的合成转运中起到重要的作用,并且肝细胞内存在FXR(法尼醇X受体,farnesoid X receptor)、PXR(孕烷X受体,pregnane X receptor)等受体可以调节相关酶和转运体[9, 10]。本研究考察了异补骨脂素作用24 h后HepG2细胞中相关酶、转运体等mRNA的变化,以了解异补骨脂素对于胆汁酸合成转运的影响,为解释异补骨脂素在胆汁酸淤积中的作用机制、以及更进一步地阐明补骨脂毒性提供基础。
1 材料 1.1 受试药异补骨脂素购自天津市月牙湖科技有限公司,经HPLC检测纯度大于95%。
1.2 细胞HepG2细胞,购自中国科学院上海生命科学研究院细胞资源中心。
1.3 试剂与仪器DMEM培基和无血清Opti-MEM培基,胎牛血清(FBS)为Gibco产品;青霉素-链霉素双抗、胰酶、DMSO、DEPC水为北京索莱宝产品;PBS为武汉博士德产品;TRIzol为Invitrogen产品;RevertAid First Strand cDNA Synthesis Kit为Fermentas产品;Hot start fluo-PCR mix SYBR Green Ⅰ(2×)为上海生工产品;BCA蛋白检测试剂盒为Thermo产品;总胆汁酸(TBA)试剂盒为中生北控产品;其它化学试剂为国产分析纯。
Hitachi 7020全自动生化仪;PerkinElmer Enspire多功能读板机;Thermo Stratos离心机;Bio-Rad CFX96型荧光定量PCR仪;Olympus BX51型倒置荧光显微镜及成像系统;上海世平SPH-103B恒温振荡器。
2 方法 2.1 细胞培养HepG2细胞培养于含10%的FBS、1%双抗的DMEM的培基中,置37℃、5% CO2的孵箱中进行培养。细胞贴壁24 h,每48 h换液1次,先用无菌PBS洗细胞3次,再加0.25%的胰酶消化。细胞悬液离心(1 000 r·min-1,4℃,10 min)后弃上清,加入含10% FBS的完全培养基,反复吹打细胞至单细胞悬液,进行传代和种板。
2.2 细胞活力和细胞中胆汁酸检测HepG2细胞按每孔1×104 个细胞接种于96孔板中,在37℃、5% CO2条件下培养 24 h贴壁后,分别给予用Opti-MEM培基稀释的终浓度为6.25、25、100、400 μmol·L-1的异补骨脂素,作用24 h后移除培养基,加10 μL MTT溶液(5 g·L-1)温箱孵育4 h,移除上清,每孔加入100 μL的DMSO,振荡10 min后在490 nm处测得吸光度值。计算细胞存活率(相对于对照组)。
HepG2细胞按每孔1×105个接种于24孔板中,在37℃、5% CO2条件下培养 24 h贴壁后,分别给予用Opti-MEM培基稀释的终浓度为6.25、25、100、400 μmol·L-1的异补骨脂素,作用24 h后移除培养基,加入PBS缓冲液100 μL,用细胞刮刀刮取细胞,细胞用超声破碎细胞,BCA法检测细胞破碎液的蛋白浓度,并在全自动生化仪检测TBA。
2.3 Real time PCR检测HepG2细胞按每孔5×105个接种于6孔板,于37℃、5% CO2培养箱中培养24 h,然后给予异补骨脂素 (25、100 μmol·L-1,Opti-MEM培基稀释)处理24 h。去除培养液,用PBS洗细胞3次。用TRIzol常规提取HepG2细胞中总RNA,-80℃保存。紫外分光光度法检测RNA样品的纯度与浓度。按反转录试剂盒要求进行反转录,real time PCR反应体系20 μL,其中cDNA样本1 μL,上、下游引物各0.5 μL,Hot start Fluo-PCR mix试剂10 μL,无RNA酶水8 μL。在94℃预变性4 min,每个循环94℃变性30 s,57℃退火30 s,72℃延伸30 s,共40个循环。取2-△△CT值进行数据统计。引物序列见下表:
| Forward(5′→3′) | Reverse(5′→3′) | Product/bp | |
| GAPDH | TGGGTGTGAACCATGAGAAGT | TGAGTCCTTCCACGATACCAA | 126 |
| BSEP | CCCTCAGTAACATCCGCACT | AGGCAAAGCAGAATCCGTAA | 132 |
| MRP2 | GCACCGACTATCCAGCATCT | AACCAAAGGCACTCCAGAAA | 111 |
| MRP3 | CACACCACAACCACCTTCAC | TCAGGGTAGAGTCCAATGAGC | 126 |
| OATP2 | TGAATGCCCAAGAGATGATG | ATTGAGTGGAAACCCAGTGC | 165 |
| NTCP | TTGGCTTTCTGCTGGGTTAT | CATTGAGGATGGTGGAACAG | 120 |
| OSTα | GTTCGCCTCCCTATTCCTCT | ACCTTGTGGTCTTTCCTTCG | 121 |
| CYP7A1 | CAGAACACCCTCACCACACA | GATTCACAAGCAAGCACTGG | 102 |
| CYP27A1 | ACGAGGAAGTGGTGGGTGT | CACAGGGTAGAGACGCAGAG | 113 |
| FXR | GCACAGAGCCAAGGAAGAGA | GGGAGACAATGAGGTGAGGA | 102 |
| PXR | GCGTGTGTGTGATTTGGTGT | TGATTGTCAGCGTAGCCTTG | 112 |
实验数据以 ± s表示,组间比较采用单因素方差分析。
± s表示,组间比较采用单因素方差分析。
异补骨脂素作用于HepG2细胞24 h,6.25 μmol·L-1异补骨脂素即对HepG2细胞增殖有一定抑制作用,细胞相对存活率为92.8%。在6.25~400 μmol·L-1范围内随着异补骨脂素的浓度升高、细胞存活率也明显降低,而400 μmol·L-1异补骨脂素作用下细胞相对存活率仅为27.9%。异补骨脂素作用24 h的IC50为118.1 μmol·L-1(95%可信限107.1~130.2 μmol·L-1),见Fig1A。对细胞破碎液的检测发现,异补骨脂素作用24 h后,400.0 μmol·L-1的异补骨脂素处理组HepG2细胞内胆汁酸浓度升高约5倍,100.0 μmol·L-1处理组的细胞内胆汁酸浓度也明显升高,见Fig1B。

|
| Fig.1 Cell viability and bile acid concentration in HepG2 cells A: Cell viability; B: Bile acid concentration. *P<0.05,**P<0.01 vs control. |
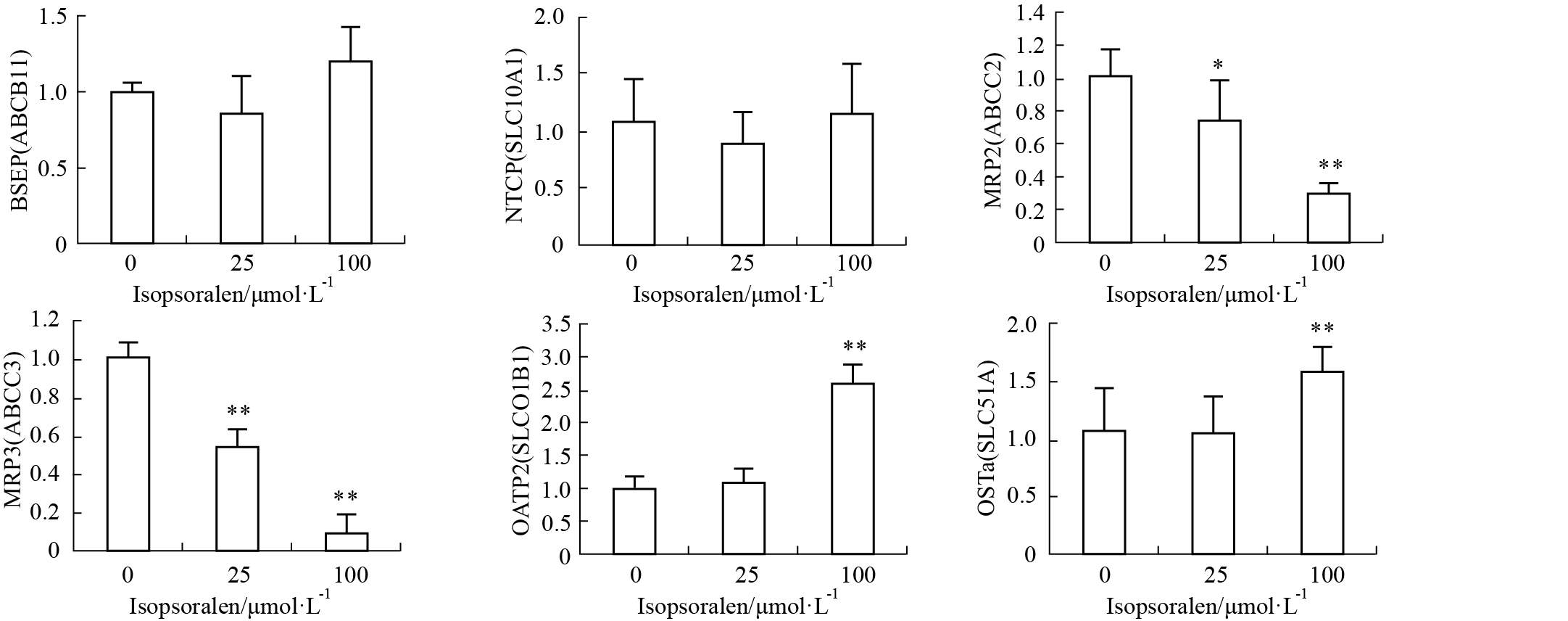
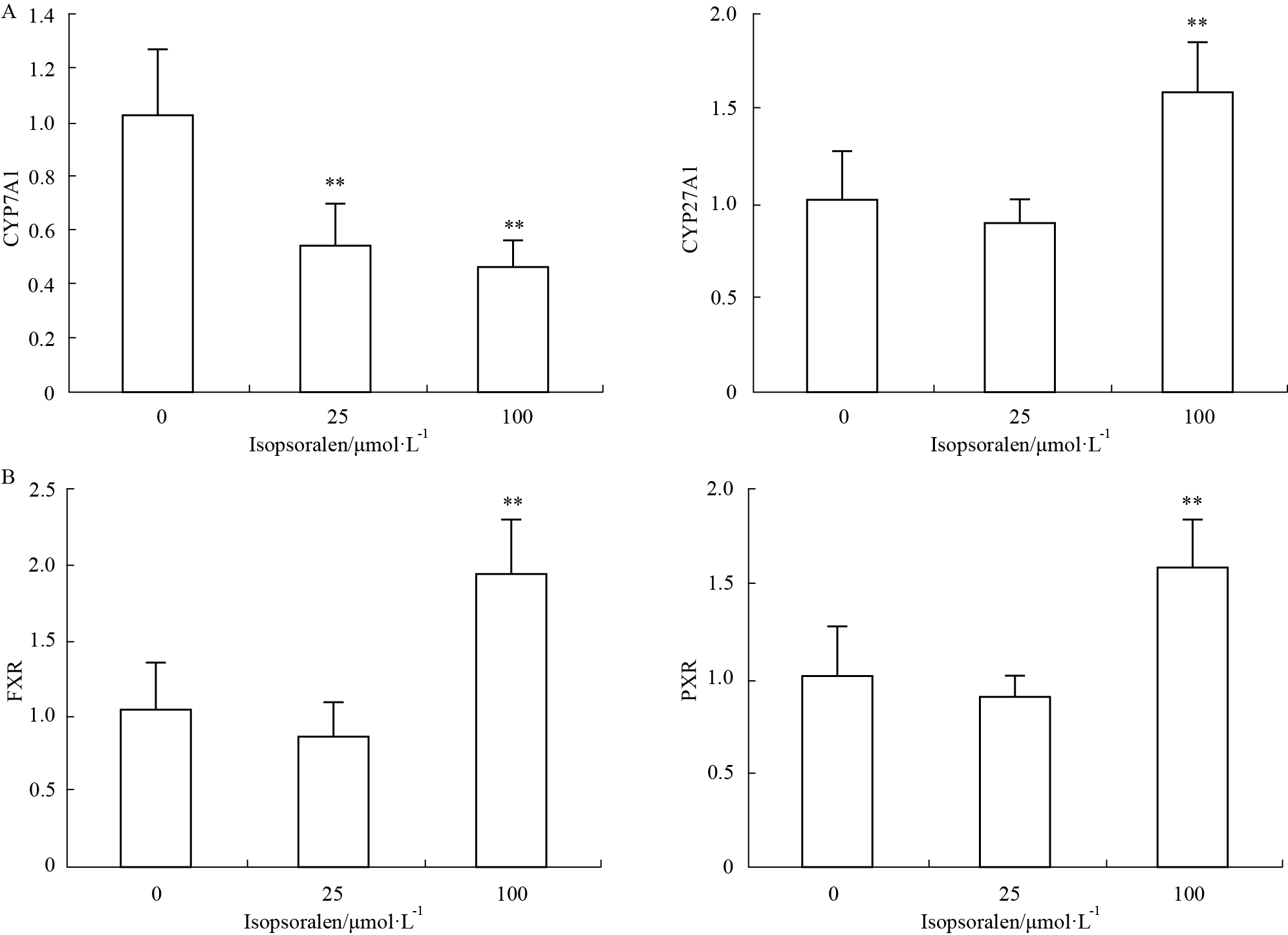
异补骨脂素处理24 h后,HepG2细胞中BSEP、NTCP的mRNA虽然与空白相比均值有一定变化、但并无统计学意义;25 μmol·L-1 异补骨脂素组,HepG2细胞中MRP2、MRP3、CYP7A1的mRNA转录均明显降低,而100 μmol·L-1异补骨脂素组,除了MRP2、MRP3、CYP7A1的降低外,OATP2、OSTα、CYP27A1、FXR、PXR的mRNA转录明显升高,见Fig2,3。
|
| Fig.2 Bile acid transporter mRNA transcription *P<0.05,**P<0.01 vs control |
|
| Fig.3 Bile acid synthetase and receptor mRNA transcription A:synthetase; B:receptor. **P<0.01 vs conctrol |
异补骨脂素在体外HepG2细胞中作用24 h的IC50为118.1 μmol·L-1,但其毒性作用的最小毒性剂量很小,按实验结果可以拟合量效方程并计算IC5仅为3.8 μmol·L-1,提示异补骨脂素的安全剂量较低。
将细胞培养基中的药物浓度近似为血液中的药物浓度,可以借助于体内代谢研究结果来先对体外研究结果进行外推。大鼠代谢研究表明[11],大鼠口服给予香豆素混合物(相当于异补骨脂素4.39 mg·kg-1),异补骨脂素在血液中峰浓度高达37.89 mg·L-1,口服的生物利用度高达70.35%。同时有研究[12]表明异补骨脂苷在体内可以转化为异补骨脂素,那么实际使用补骨脂时血液中异补骨脂素的来源除了异补骨脂素外还包括异补骨脂苷,这个量可达补骨脂的1%以上,按2010版药典中补骨脂每人每天10 g的使用上限,折合大鼠异补骨脂素用量9 mg·kg-1。参考文献[11]研究中的结果,大鼠血液中峰浓度可达70 mg·L-1以上(超过400 μmol·L-1,异补骨脂素分子质量186.16),即便是药后24 h血液中异补骨脂素浓度也在2 mg·L-1以上(约10 μmol·L-1大于其在HepG2细胞的IC5)。很显然,按上述推断异补骨脂素在体内也会导致相似的毒性,这也许可以一定程度地解释补骨脂所导致的肝损害。
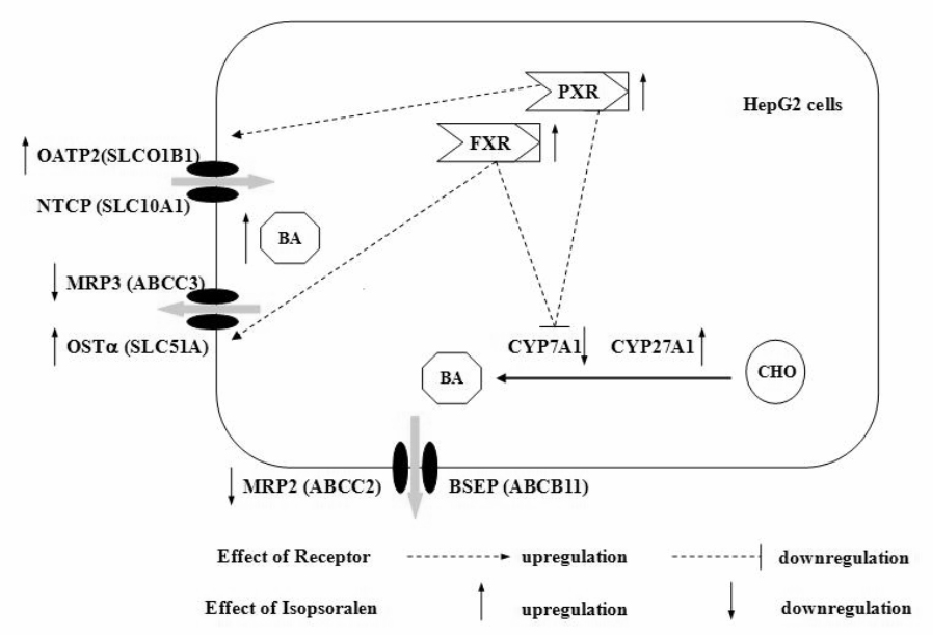
胆汁酸可以诱导细胞凋亡[13],高浓度的胆汁酸可导致动物肝损害[14, 15]。Fig4是异补骨脂素对胆汁酸调节相关基因影响的示意图,FXR和PXR可以通过调节胆汁酸合成转运来对抗胆汁酸的毒性,FXR和PXR的缺失会导致胆汁酸更容易蓄积而产生毒性作用[14]。理论上FXR的激活可以上调BSEP、OSTα/β、MRPs,下调NTCP以降低细胞内胆汁酸浓度,FXR还可下调CYP7A1以减少肝细胞内胆汁酸合成[8, 9]。实验中异补骨脂素100 μmol·L-1,细胞内胆汁酸浓度明显升高,将会激活胆汁酸受体FXR、PXR,并使之上调,OSTα上调和CYP7A1下调是符合FXR预期作用的;而作为替代途径的CYP27A1的上调可能是因为肝细胞内胆汁酸合成限速酶的CYP7A1被抑制的结果;通过文献[15]发现,小鼠在胆酸的诱导下OATP2也是升高的,而且在胆酸的作用下小鼠的OATP2上调倍数明显高于PXR-/-小鼠,尽管未用胆酸处理时野生型小鼠OATP2绝对水平低于PXR-/-小鼠肝脏中,但胆酸处理后OATP2水平反而高,提示实验中OATP2似乎更可能是PXR的调节作用。异补骨脂素在25 μmol·L-1时,细胞内胆汁酸浓度已经有所升高,但与对照之间的差异尚无统计学意义,而此时MRP2、MRP3已经明显下调,故异补骨脂素对MRP2、MRP3的下调作用显然早于胆汁酸的淤积,是异补骨脂素对胆汁酸转运干预的早期作用点,而上调的OATP2和CYP27A1也许对抗了上调的OSTα和下调的CYP7A1的作用,最终导致胆汁酸在细胞内蓄积,细胞内胆汁酸的检测也证实细胞内胆汁酸较正常升高了5倍、达到400 μmol·L-1。
|
| Fig.4 Effect of isopsoralen on bile acid synthesis and transport |
当然,体外HepG2细胞是人源肿瘤细胞,而文献[11, 12]中代谢研究是大鼠的数据,种属不同可能导致推论有一定差异,最终异补骨脂素在体内是否会同样影响胆汁酸合成转运还有待于研究确证。
| [1] | 赵丕文,牛建昭,王继峰,等. 异补骨脂素的植物雌激素作用及其机制的探讨[J]. 中国药理学通报, 2009, 25(9):1193-6.Zhao P W, Niu J Z, Wang J F, et al. Research on the phytoestrogenic effect and its mechanism of isopsoralen in T47D cells[J]. Chin Pharmacol Bull, 2009, 25(9):1193-6. |
| [2] | Xin D, Wang H, Yang J, et al. 2010. Phytoestrogens from Psoralea corylifolia reveal estrogen receptor-subtype selectivity[J]. Phytomedicine, 2010, 17(2):126-31. |
| [3] | 翟远坤, 潘亚磊,牛银波, 等. 补骨脂素与异补骨脂素对乳鼠颅骨成骨细胞分化成熟影响的比较研究[J]. 中国药理学通报, 2012,28(3):355-61.Zhai Y K, Pan Y L, Niu Y B, et al. Comparative studies on the differentiation and maturation of rat calvarial osteoblasts by psoralen and isopsoralen in vitro[J]. Chin Pharmacol Bull, 2012, 28(3):355-61. |
| [4] | Nam S W, Baek J T, Lee D S, et al. A case of acute cholestatic hepatitis associated with the seeds of Psoralea corylifolia[J]. Clin Toxicol, 2005, 43(6):589-91. |
| [5] | Cheung W I, Tse M L, Ngan T, et al. Liver injury associated with the use of Fructus Psoraleae (Bol-gol-zhee or Bu-gu-zhi) and its related proprietary medicine[J]. Clin Toxicol, 2009, 47(7): 683-85. |
| [6] | 周 昆,代 志,柳占彪,等. 补骨脂水提物引起的大鼠肝损害[J]. 天津中医药大学学报, 2013, 32(4):221-4.Zhou K, Dai Z, Liu Z B, et al. Aqueous extract of psoralea corylifolia induced liver injury in rats[J]. J Tianjin Univ Tradit Chin Med, 2013, 32(4):221-4. |
| [7] | Wang X, Lou Y J, Wang M X, et al. Furocoumarins affect hepatic cytochrome P450 and renal organic ion transporters in mice[J]. Toxicol Lett, 2012, 209(1):67-77. |
| [8] | Chiang J Y. Bile acids regulation of synthesis[J]. J Lipid Res, 2009, 50(10) 1955-66. |
| [9] | Fiorucci S,Distrutti E,Ricci P, et al. Targeting FXR in cholestasis: hype or hope[J]. Expert Opin Ther Targets, 2014, 18(12):1449-59. |
| [10] | Pauli-Magnus C, Meier P J. Hepatobiliary transporters and drug-induced cholestasis[J]. Hepatology, 2006, 44(4):778-87. |
| [11] | Feng L, Wang L, Jia X H. Pharmacokinetics, tissue distribution and excretion of Coumarin components from Psoralea corylifolia L. in rats[J]. Arch Pharm Res, 2010, 33(2): 225-30. |
| [12] | Wang Y F,Liu Y N, Xiong W, et al. A UPLC-MS/MS method for in vivo and in vitro pharmacokinetic studies of psoralenoside, isopsoralenoside, psoralen and isopsoralen from Psoralea corylifolia extract[J]. J Ethnopharmacol, 2014, 151(1):609-17. |
| [13] | Palmeira C M,Rolo A P. Mitochondrially-mediated toxicity of bile acids[J]. Toxicology, 2004, 203(1-3):1-15. |
| [14] | Guo G L, Lambert G, Negishi M, et al. Complementary roles of farnesoid X receptor, pregnane X receptor, and constitutive androstane receptor in protection against bile acid toxicity[J]. J Biol Chem,2003, 278(46):45062-71. |
| [15] | Teng S,Piquette-Miller M. Hepatoprotective role of PXR activation and MRP3 in cholic acid-induced cholestasis[J]. Br J Pharmacol,2007, 151(3):367-76. |
