2. 中南大学药学院, 湖南 长沙 410013
颜苗(1981-),男,博士,主管药师,研究方向:临床药学与药理学,通讯作者,Tel:0731-85292099,E-mail:yanmiaocsu@126.com
2. School of Pharmaceutical Sciences, Central South University, Changsha 410013, China
1 Nrf2-ARE信号转导通路及其调控
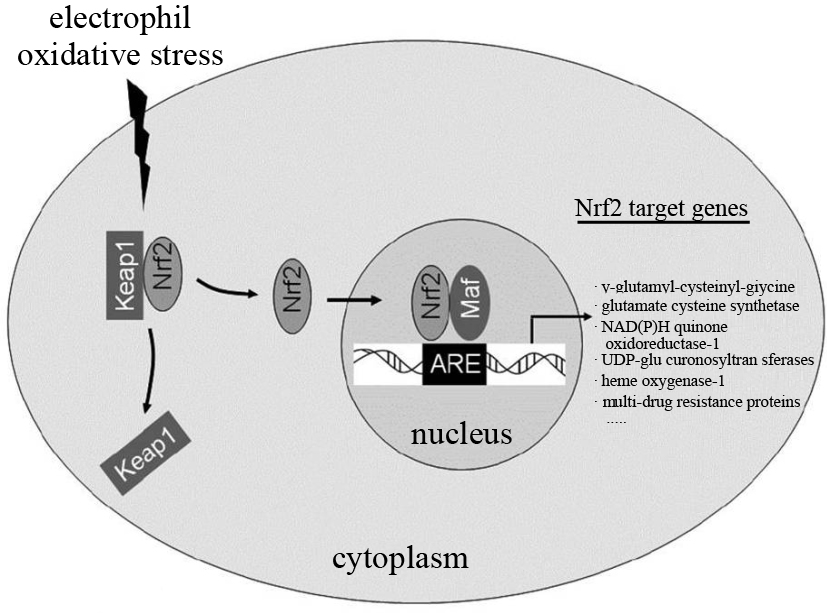
核因子NF-E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)是亮氨酸拉链家族中调节氧化应激反应的重要转录因子,Keap1是其特异性受体。如Fig1所示,在正常生理状态下,Nrf2通过N端与Kelch样ECH联合蛋白1(Kelch-like ECH-associated protein 1,Keap1)特异性结合于细胞质中,此时Nrf2的活性受到抑制,细胞内Ⅱ相酶类和抗氧化物处于基础表达水平,细胞处于稳定状态。当受到活性氧(reactive oxygen species,ROS)或其他亲电试剂刺激时,Nrf2与Keap1解偶联,并使得Nrf2转移进入细胞核,在核内与小Maf蛋白结合成异二聚体,进而识别并结合抗氧化反应元件(antioxidant response element,ARE),启动下游抗氧化保护性基因和Ⅱ相解毒酶基因的转录,包括血红素氧化酶(hemeoxygenase-1,HO-1)、NAD(P)H醌氧化还原酶[NAD(P)H: quinone oxidoreductase 1,NQO1]、谷氨酸半胱氨酸连接酶(glutamate-cysteine ligase,GCL)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)和环氧化物水解酶(epoxide hydrolase,EH)[1]等。这些酶能够保护机体和细胞免受ROS及一些毒性物质(如致癌物、药物活性代谢产物等)的侵害。此外,该通路还可由丝裂原活化蛋白激酶、磷脂酰肌醇3激酶、蛋白激酶C激活,这主要源于激酶可磷酸化Nrf2的丝氨酸和苏氨酸残基,致使Nrf2与Keap1分离并转位入核,结合ARE而激活该通路[2]。Nrf2-ARE通路是迄今为止发现的最为重要的内源性抗氧化应激通路。
目前发现有两种主要的途径可以激活Nrf2-ARE信号通路:药物途径和基因途径。一些药物如甘草、莱菔硫烷、奥替普拉及齐墩果酸衍生物CDDO-Im等可激活Nrf2-ARE通路及下游靶基因,抵制炎症反应及氧化损伤的发生,从而减少肝损伤。不同的物质作用于不同的肝脏疾病,奥替普拉不仅可用于改善α-荼基异硫氰酸盐(α-naphthylisothiocyanate,ANIT)诱导的小鼠肝脏胆汁淤积,还可降低黄曲霉素诱导大鼠肝癌的形成[4]。CDDO-Im同样也可以用于抵抗黄曲霉素诱发的肝细胞癌症病变以及刀豆蛋白A(concanavalin A,ConA)介导的炎症性肝损伤,并且该作用只存在于野生型鼠中,Nrf2缺陷鼠无此现象。Nrf2主要基因激活途径有Keap1-KO、Keap1-CKO以及Keap1-kd。腹腔注射给予高剂量(700 mg·kg-1)对乙酰氨基酚(acetaminophen,APAP)后,Keap1-CKO小鼠肝脏中Nrf2及其下游靶基因NQO1、GCL、GST的表达明显增加,可对APAP引发的肝脏毒性起抵制作用,此外,该模型小鼠还可抵御ConA以及甲基汞诱导的肝损伤[5]。
2 Nrf2-ARE通路与肝脏疾病的关系Nrf2-ARE通路抗肝氧化损伤系统涉及多个环节,如调节肝脏的代谢、解毒及促进肝细胞再生,在各类肝脏疾病的病理发生机制中均发挥重要作用,如药物性肝损伤(drug-induced liver injury,DILI)、胆汁淤积性肝病、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD/NASH)、酒精性脂肪肝(alcoholic liver disease,ALD)、肝纤维化及肝癌等。
2.1 Nrf2-ARE与DILI一些药物在肝细胞内经CYP450代谢产生的亲电子基、自由基、氧基等可与肝细胞内大分子物质共价结合,引发脂质过氧化反应,破坏膜的完整性和膜Ca2+-ATP酶系,扰乱细胞内外Ca2+稳态,影响线粒体、内质网等重要细胞器的功能,并最终导致肝细胞损伤甚至死亡,造成DILI。APAP介导的肝损害是评估DILI的经典模型,可致活性亲电子体的增加、GSH排空以及氧化应激。APAP在CYP酶作用下产生的高活性代谢产物N-乙酰对苯醌亚胺(N-acetyl-1,4-benzoquinone imine,NAPQI),可与谷胱甘肽(glutathione,GSH)结合并排出体外。过量APAP可耗竭肝内GSH,致使NAPQI与细胞内大分子共价结合,诱发氧化应激产生大量ROS,进一步造成氧化损伤,产生细胞毒性。Nrf2结合ARE可转录调节与APAP代谢及排泄有关的蛋白如UGT、GST、NQO1等,因此Nrf2被认为是APAP肝损伤治疗的重要靶点之一。当暴露于相同剂量的APAP时,同野生型鼠相比,Nrf2缺陷鼠肝损伤更严重,且死亡率明显增加。APAP可促进Nrf2的转位入核,使其入核速度最快提升60 min,并且其下游EH、HO-1、GCL基因的表达量也明显增加[6]。CDDO-Im可激活Nrf2-ARE通路,诱导下游HO-1、NQO1以及GCLC基因表达,降低APAP引起野生型鼠的肝损伤,而对Nrf2缺陷鼠无此作用[7]。APAP肝损伤小鼠,其肝细胞膜外排转运体多药耐药相关蛋白3(multidrug resistance-associated protein 3,Mrp3)、Mrp4的表达量随Nrf2增加而增加,而Nrf2缺陷鼠Mrp3和Mrp4表达量无明显变化,提示Nrf2通路及其下游基因在解除APAP及其代谢物引起的肝损伤中起着重要作用。另一方面,肝特异性Keap1缺陷鼠体内Nrf2高度活化,其肝脏NADPH浓度较高,有助于提高机体氧化应激防御能力[8]。除此之外,其他药物也可引起DILI,Nrf2缺陷鼠易感于1-溴丙烷诱发的肝毒性,主要表现为肝GSH含量降低,肝脏坏死率增加以及脂质过氧化产物丙二醛水平的升高[9]。此外,小鼠单剂量CCl4给药制备急性肝损伤模型后,Nrf2缺陷鼠肝损伤修复反应明显延迟[10]。而一些具抗氧化活性的天然产物如黄岑素[11]、姜黄素等可激活Nrf2信号通路,从而防御药物引起的肝损伤,如姜黄素可减缓二甲基亚硝胺诱导的大鼠肝损伤。
以上研究均表明Nrf2缺陷使机体更易感于药物所引起的肝脏损伤,而激活Nrf2-ARE信号通路对DILI有潜在的肝保护作用。
2.2 Nrf2-ARE与胆汁淤积性肝病肝细胞/胆管上皮的胆汁分泌障碍或胆汁流的阻断,可导致胆汁酸等毒性物质的过量累积,引起胆汁淤积性肝病。胆汁酸泵如胆盐输出泵(bile salt export pump,BSEP)和MRP都属于ABC转运家族,可将体内的过多的胆汁酸外排至体外,而Nrf2不仅可调控肝解毒酶和抗氧化蛋白的表达,还可调控BSEP及MRP的转运活性,调节体内胆汁酸的水平。
胆管结扎(bile duct ligation,BDL)是研究胆汁淤积性肝病常见的动物模型,可致肝脏胆汁酸的堆积而引起肝损伤。BDL处理后,同野生型鼠相比,Nrf2缺陷鼠体内肝脏胆汁酸转运体表达量发生明显变化,表现在Mrp3、Mrp4以及胆汁酸合成酶(CYP7A1、CYP8B1)的表达量下降。相反,同野生型鼠相比,BDL处理引起的Keap1-kd鼠的肝损伤明显减弱,肝实质坏死面积以及体内ROS水平明显下降,且血清胆红素水平增大的幅度减缓,这主要是由于Keap1-kd鼠体内Nrf2通路激活,导致抗氧化应激体系增强,以及Mrp转运体和解毒酶表达增加所致[13]。然而,丙氨酸转氨酶和组织学分析结果表明,Nrf2缺陷鼠并不易感于BDL引起的肝损伤,这可能是由于胆汁酸转运体和核受体孕烷X受体的补偿机制的存在[14]。ANIT可损伤胆道上皮细胞导致肝内胆汁淤积。有研究向野生型鼠和Nrf2缺陷鼠口服给药ANIT(75 mg·kg-1)并观察转运体的变化,发现BSEP及Mrp3转运体的表达量在野生型鼠体内增加,但Nrf2缺陷鼠体内水平未见明显变化。随后,该研究小组通过Nrf2的激活剂奥替普拉对ANIT诱导的病理损伤结果推测,虽然Nrf2缺陷鼠体内存在补偿机制以抵御ANIT的毒性,激活Nrf2通路仍可作为肝内胆汁淤积的治疗手段之一[4]。
Nrf2的激活剂可降低胆汁淤积性肝损伤。天然产物芦丁具抗氧化和抗炎特性,可下调炎性因子NF-κB及TGF-β/Smad通路活性,抵御胆汁淤积性肝损伤,这一过程可能与其激活Nrf2信号通路,从而上调下游基因HO-1的表达及活性有关[15]。维生素A可激活Nrf2通路,促进阻塞性黄疸大鼠体内的Nrf2转位入核,同时下游HO-1和NQO1的表达增加,提升肝脏功能并降低氧化应激损伤,减缓胆汁淤积性肝损伤症状[16]。
2.3 Nrf2-ARE与NAFLD/NASHNAFLD是一种常见的慢性肝脏疾病,源于氧化应激和脂质过氧化机制共同作用而导致的细胞损伤、凋亡、炎症、纤维化,最终发展为NASH。NAFLD伴随脂肪尤其是甘油三酯的沉积,线粒体呼吸链活性下降导致ROS过度生成以及线粒体GSH耗竭等,此外超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶活性均减低,肝细胞内脂质过氧化程度加重。Kim等[17]给予小鼠高脂饮食12周后,发现Nrf2及其靶基因的表达与血清ALT、GLU及肝指数呈明显的正相关(P<0.01),推测这可能是机体对长期高脂饮食造成氧化应激的一种适应性反应。随着高脂饮食喂养时间的延长,小鼠出现肝脏脂肪沉积、脂肪肝等肝脏病变,并且随着脂肪变性程度和炎症浸润程度的增强,Nrf2的表达也增加,表明Nrf2对氧化应激所致的炎症损伤的抑制作用。Nrf2缺陷鼠相比野生型鼠易患NAFLD,且Nrf2缺失可明显加重NAFLD的进程。Nrf2-ARE通路参与NAFLD/NASH病理机制的过程可从多角度理解,首先,Shin等[18]发现,CDDO-Im可有效预防野生鼠的肝脏脂质堆积,但对Nrf2缺陷鼠无作用,并推测该过程与Nrf2-ARE通路的激活,从而降低脂肪酸合成酶表达有关。其次,Nrf2可减轻炎症反应,NF-κB是与炎症反应相关的重要细胞信号因子,一些化学治疗药物可在激活Nrf2通路的同时抑制NF-κB的活性。另一方面,Nrf2通路的激活及下游抗氧化靶基因HO-1和NQO1表达的增加也是重要因素之一。此外,转化生长因子β(transforming growth factor-β,TGF-β)作为体内一种重要的促纤维化信号因子,其表达受到Nrf2通路的调控[19]。莱菔硫烷可激活人肝星状细胞(hepatic stellate cell,HSC)的Nrf2,抑制TGF-β信号活化及平滑肌肌动蛋白-α(α-smooth muscle actin,α-SMA)、Ⅰ型胶原、纤连蛋白以及基质金属蛋白酶组织抑制剂1等的表达,从而减轻肝脏纤维化[19],表明Nrf2的活化可抑制NASH疾病中的纤维生成。肥胖、胰岛素抵抗与NAFLD密切相关,Yates等[20]通过对鼠肝脏基因的研究发现,基因性和药物性激活Nrf2均可诱导一系列与脂质代谢有关的基因的表达,由此可见Nrf2的激活在能量代谢方面也起着重要的作用。
2.4 Nrf2-ARE与ALDALD是由于长期大量饮酒导致的肝脏疾病,与氧化应激密切相关,乙醇在体内经CYP2E1代谢循环可产生ROS,乙醇作用于HepG2(E47细胞)可活化Nrf2,核内Nrf2水平、Nrf2-ARE结合活性及Nrf2调控基因(GCLC和HO-1)的表达均增加,并可被CYP2E1抑制剂和ROS清除剂N-乙酰半胱氨酸阻断。通过siRNA沉默Nrf2基因后,乙醇诱导的细胞内ROS和脂质过氧化产物生成量均增加[21]。由此推测,Nrf2-ARE通路在抵抗乙醇诱导的氧化应激中起着重要的作用。Nrf2缺陷鼠证实了该推测,给予相同剂量乙醇刺激后,相比野生型鼠,Nrf2缺陷鼠肝脏相关死亡率明显增加,这与其降解乙醇代谢物能力下降、导致毒性代谢物乙醛的累积有关;另外,毒性反应还表现在脂肪生成增加及变性,Kupffer细胞介导的炎症反应加重,细胞和线粒体内GSH减少且线粒体结构功能变化明显[22]。而Keap1-kd和Keap1-HKO小鼠体内Nrf2呈持续激活状态,其可明显减缓乙醇诱导血清甘油三酯和肝脏自由脂肪酸含量的增加[23]。此外,Nrf2通路的激活会诱导磷酸戊糖途径(细胞NADPH的主要来源)中相关酶的表达,而Nrf2缺陷鼠则因体内NADPH浓度较低而无法抵抗氧化应激所引起的损伤[8]。以上研究均表明Nrf2-ARE通路在ALD中的肝细胞保护作用。目前,Nrf2药物激动剂并未作为ALD的预防手段在动物模型上进行研究,因此,其在缓解ALD中的调节作用还有待深入研究。
2.5 Nrf2-ARE与肝纤维化肝纤维化是肝脏对各种原因所致肝脏炎症和损伤后修复过程的代偿反应,表现为肝内结缔组织增生与沉积,是由HSC活化以及细胞外基质(extracellular matrix,ECM),包括胶原蛋白、透明质酸等合成增多而降解不足所产生,是进一步向肝硬化发展的重要环节。TGF-β是肝纤维化的关键调节因子,可促进ECM的沉积,抑制HSC胶原酶的活性,并能通过Smad-3激活转录因子而下调GST、GCLC、SOD和谷胱甘肽过氧化物酶等抗氧化酶的表达水平及活性,而Nrf2能通过调节氧化还原敏感的转录激活蛋白和NF-κB,最终下调TGF-β,且GST、GCLC、SOD和谷胱甘肽过氧化物酶均为Nrf2-ARE下游靶基因,由此推测Nrf2与肝纤维化进程联系密切。
Nrf2的激活剂莱菔硫烷可激活TGF-β/Smad通路,抑制HSC激活和相关促纤维基因如Ⅰ型胶原蛋白、α-SMA的表达,从而影响肝纤维化进展及预后[19]。此外,许多天然抗氧化物如檞皮素、白藜芦醇等都能抑制HSC活化,这可能与其激活Nrf2/ARE诱导Ⅱ相抗氧化物酶表达有关,提示在肝纤维化进程中Nrf2的激活可抑制HSC的活化。Wang等[24]也发现通过调节Nrf2通路抑制HO-1的活性可减少肝铁沉积水平,从而有助于改善肝纤维化及调节肝门静脉压。Nrf2缺陷鼠的研究进一步证实了Nrf2或可作为肝纤维化治疗的新靶点,Xu等[10]研究发现,Nrf2缺陷鼠对CCl4所致急性肝损伤的修复同正常鼠相比明显延迟,并伴随炎症反应,同时肝纤维化程度的加重及时间延长,炎症因子IL-1α、TNF-α以及IFN-γ的表达明显增加。在CCl4介导的慢性肝损伤中,Nrf2缺陷鼠与对照组小鼠相比,肝脏/体重明显下降,切片的形态计量学显示纤维化区域明显增多,这与Nrf2及其下游解毒酶减少,从而对CCl4和其代谢产物的解毒作用减弱有关[10]。
2.6 Nrf2-ARE与肝癌在正常细胞中,Nrf2及其下游基因活化后产生的抗氧化应激作用是细胞抵抗促癌物质、抑制肿瘤生成的重要机制。2-氨基-3-甲基咪唑[4,5-f]喹啉是一种具有致癌和致突变的杂环胺类衍生物,同时作用于野生型鼠和Nrf2缺陷鼠发现,Nrf2缺陷鼠的肝癌发生率明显高于野生型鼠。一些化学物质可通过激活Nrf2-ARE信号通路或提高Nrf2的表达发挥抗癌作用,石榴是一种具有抗氧化性质的常见水果,可激活Nrf2通路上调其下游抗氧化蛋白及解毒酶的表达,从而降低二乙基亚硝胺诱导的肝癌发生率[25]。因此Nrf2被认为是肝癌化学预防的潜在分子靶点之一。
但Nrf2对肿瘤细胞具有双重作用,即在正常组织中具有抑制肿瘤形成的作用,但是在肿瘤细胞内Nrf2的异常活化却具有促肿瘤细胞增殖、增强肿瘤细胞对化疗药物耐受性的作用。tBHQ可激活小鼠肝癌细胞Hepa-1中的Nrf2-ARE通路,导致抗凋亡Bcl-xL蛋白表达增加,下调凋亡基因Bax的表达以及caspase 3/7的活性,同时细胞对药物的耐药性增加、肿瘤细胞凋亡减少;且siRNA Nrf2和过表达处理后可分别减少和增加Bcl-xL基因的表达[26]。Bao等[27]研究了Nrf2耐药的可能机制,顺铂可诱导人卵巢癌细胞株A2780形成自噬小体,同时上调自噬相关基因Atg3、Atg6、Atg1的表达,达到抗肿瘤的目的。将A2780顺铂抗性细胞的Nrf2敲除后,细胞内Atg3、Atg6、Atg12、p62 mRNA及蛋白水平均降低,其对顺铂的敏感性也增强;而用3-甲基腺嘌呤或beclin 1(自噬抑制剂)siRNA处理A2780顺铂抗性细胞后,顺铂诱导肿瘤细胞凋亡作用增强,表明抑制细胞自噬作用后,抗性细胞的耐药性降低,对顺铂作用更敏感。Bao等[27]的研究提示Nrf2可能是自噬相关基因的上游,可通过自噬来调节顺铂的耐药性。
上述研究提示,Nrf2虽然有保护细胞的作用,却也增加了肿瘤细胞对化疗药物的抵抗。
3 结论氧化应激是体内许多疾病发生发展的重要因素,而Nrf2-ARE通道在诱导各种解毒酶的表达对抗氧化应激损伤方面的意义重大,可有效降低肝脏氧化应激敏感性,减轻肝脏炎症和肝纤维化过程,维持肝脏稳定的生理功能。本文综述了Nrf2-ARE信号通路参与肝脏疾病病理机制的最新研究进展,阐明了Nrf2-ARE通道在肝脏的解毒和抗氧化作用。近期已有研究从Nrf2-ARE通道的角度出发,寻找治疗肝脏疾病的药物,且Nrf2基因敲除小鼠模型的出现加速了这一过程,深入全面地研究这一通路与肝脏疾病的关系,将为临床治疗肝脏疾病提供新的靶点和思路。
| [1] | 李 航, 段惠军. Nrf2-ARE信号通路及其调控的抗氧化蛋白[J]. 中国药理学通报, 2011, 27(3):300-3. Li H, Duan H J. Nrf2/ARE pathway and downstream antioxidant genes[J]. Chin Pharmacol Bull, 2011, 27(3):300-3. |
| [2] | Kumar H, Kim I S, More S V, et al. Natural product-derived pharmacological modulators of Nrf2/ARE pathway for chronic diseases[J]. Nat Prod Rep, 2014, 31(1): 109-39. |
| [3] | Lee D H, Gold R, Linker R A. Mechanisms of oxidative damage in multiple sclerosis and neurodegenerative diseases: therapeutic modulation via fumaric acid esters[J]. Int J Mol Sci, 2012, 13(9): 11783-803. |
| [4] | Tanaka Y, Aleksunes L M, Cui Y J, et al. ANIT-induced intrahepatic cholestasis alters hepatobiliary transporter expression via Nrf2-dependent and independent signaling[J]. Toxicol Sci, 2009, 108(2): 247-57. |
| [5] | Osburn W O, Yates M S, Dolan P D, et al. Genetic or pharmacologic amplification of Nrf2 signaling inhibits acute inflammatory liver injury in mice[J]. Toxicol Sci, 2008, 104(1): 218-27. |
| [6] | Goldring C E, Kitteringham N R, Elsby R, et al. Activation of hepatic Nrf2 in vivo by acetaminophen in CD-1 mice[J]. Hepatology, 2004, 39(5): 1267-76. |
| [7] | Reisman S A, Buckley D B, Tanaka Y, et al. CDDO-Im protects from acetaminophen hepatotoxicity through induction of Nrf2-dependent genes[J]. Toxicol Appl Pharmacol, 2009, 236(1): 109-14. |
| [8] | Wu K C, Cui J Y, Klaassen C D. Beneficial role of Nrf2 in regulating NADPH generation and consumption[J]. Toxicol Sci, 2011, 123(2): 590-600. |
| [9] | Liu F, Ichihara S, Valentine W M, et al. Increased susceptibility of Nrf2-null mice to 1-bromopropane-induced hepatotoxicity[J]. Toxicol Sci, 2010, 115(2): 596-606. |
| [10] | Xu W, Hellerbrand C, Köhler UA, et al. The Nrf2 transcription factor protects from toxin-induced liver injury and fibrosis[J]. Lab Invest, 2008, 88(10): 1068-78. |
| [11] | 庞 纯, 蒋 萍, 季莉莉. 黄岑素激活核转录因子Nrf2拮抗肝毒性的研究[J]. 中国药理学通报, 2014, 30(4): 546-9. Pang C, Jiang P, Ji L L. Baicalein induced Nrf2 activation and its protection against hepatotoxicity[J]. Chin Pharmacol Bull, 2014, 30(4): 546-9. |
| [12] | 牛 璐, 金 晶, 陈 攀, 黄 民. 黄岑素对胆汁外排转运体MRP2和BSEP的影响[J]. 中国药理学通报, 2015, 31(1): 147-8. Niu L, Jin J, Chen P, Huang M. Effect of baicalein on expression of MRP2 and BSEP in HepG2 cells[J]. Chin Pharmacol Bull, 2015, 31(1): 147-8. |
| [13] | Okada K, Shoda J, Taguchi K, et al. Nrf2 counteracts cholestatic liver injury via stimulation of hepatic defense systems[J]. Biochem Biophys Res Commun, 2009, 389(3): 431-6. |
| [14] | Weerachayaphorn J, Mennone A, Soroka C J, et al. Nuclear factor-E2-related factor 2 is a major determinant of bile acid homeostasis in the liver and intestine[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(9): G925-36. |
| [15] | Pan P H, Lin S Y, Wang Y Y. Protective effects of rutin on liver injury induced by biliary obstruction in rats[J]. Free Radic Biol Med, 2014, 73: 106-16. |
| [16] | Wang G, Xiu P, Li F. Vitamin A supplementation alleviates extrahepatic cholestasis liver injury through Nrf2 activation[J]. Oxid Med Cell Longev, 2014, 2014: 273692. |
| [17] | Kim S, Sohn I, Ahn J I. Hepatic gene expression profiles in a long-term high-fat diet-induced obesity mouse model[J]. Gene, 2004, 340(1): 99-109. |
| [18] | Shin S, Wakabayashi J, Yates M S, et al. Role of Nrf2 in prevention of high-fat diet-induced obesity by synthetic triterpenoid CDDO-imidazolide[J]. Eur J Pharmacol, 2009, 620(1-3): 138-44. |
| [19] | Oh C J, Kim J Y, Min A K, et al. Sulforaphane attenuates hepatic fibrosis via NF-E2-related factor 2-mediated inhibition of transforming growth factor-beta/Smad signaling[J]. Free Radic Biol Med, 2012, 52(3): 671-82. |
| [20] | Yates M S, Tran Q T, Dolan P M, et al. Genetic versus chemoprotective activation of Nrf2 signaling: overlapping yet distinct gene expression profiles between Keap1 knockout and triterpenoid-treated mice[J]. Carcinogenesis, 2009, 30(6): 1024-31. |
| [21] | Cederbaum A. Nrf2 and antioxidant defense against CYP2E1 toxicity[J]. Expert Opin Drug Metab Toxicol, 2009, 5(10): 1223-44. |
| [22] | Lamlé J, Marhenke S, Borlak J, et al. Nuclear factor-eythroid 2-related factor 2 prevents alcohol-induced fulminant liver injury[J]. Gastroenterology, 2008, 134(4): 1159-68. |
| [23] | Wu K C, Liu J, Klaassen C D. Role of Nrf2 in preventing ethanol-induced oxidative stress and lipid accumulation[J]. Toxicol Appl Pharmacol, 2012, 262(3): 321-9. |
| [24] | Wang Q M, Du J L, Duan Z J, et al. Inhibiting heme oxygenase-1 attenuates rat liver fibrosis by removing iron accumulation[J]. World J Gastroenterol, 2013, 19(19): 2921-34. |
| [25] | Bishayee A, Bhatia D, Thoppil R J. Pomegranate-mediated chemoprevention of experimental hepatocarcinogenesis involves Nrf2-regulated antioxidant mechanisms[J]. Carcinogenesis, 2011, 32(6): 888-96. |
| [26] | Niture S K,Jaiswal A K. Nrf2-induced antiapoptotic Bcl-xL protein enhances cell survival and drug resistance[J]. Free Radic Biol Med, 2013, 57: 119-31. |
| [27] | Bao L J, Jaramillo M C, Zhang Z B, et al. Nrf2 induces cisplatin resistance through activation of autophagy in ovarian carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(4): 1502-13. |