


2. 滨州医学院中西医结合学院, 山东 烟台 264003;
3. 烟台大学生命科学学院, 山东 烟台 264005
郑秋生(1967-),男,博士,博士生导师,教授,研究方向:肿瘤药理学,E-mail:zqsyt@sohu.com
 , LIU Ying1, YAN Xin-yan1, SI Ling-ling1, GAO Cai-xia2, YU Li-na2, ZHENG Qiu-sheng1, 3
, LIU Ying1, YAN Xin-yan1, SI Ling-ling1, GAO Cai-xia2, YU Li-na2, ZHENG Qiu-sheng1, 3
2. Binzhou Medical University, Yantai Shandong 264003, China;
3. College of Life Science, Yantai University, Yantai Shandong 264005, China
恶性黑色素瘤(黑色素瘤)是临床上较为常见的皮肤黏膜和色素膜恶性肿瘤,也是发病率最高的肿瘤之一[1]。目前,临床治疗黑色素瘤的主要方法是辐射和化疗,但这些方法给病人带来难以忍受的不良反应,因此,寻找高效低毒的中药改善黑色素瘤的治疗是十分有意义的。
甘草查尔酮A是一种酚类查尔酮化合物,具有抗寄生物[2]、抗菌[3]、抗肿瘤[4]等作用。由于甘草查尔酮A大量分布于甘草根茎中,且甘草在自然界中分布广泛,故其具有广阔的开发应用前景。本研究目的在于研究甘草查尔酮A对黑色素瘤B16F10细胞的增殖影响,为进一步阐明甘草查尔酮A抗黑色素瘤机制研究提供更多实验依据。
1 材料与方法 1.1 主要试剂与仪器 1.1.1 药品和试剂小鼠黑色素瘤细胞 B16F10 购买于中国典型培养物保藏中心;甘草查尔酮A(成都普瑞法生物科技有限公司,纯度为98%,批号:14022606);DMEM培养基(Gibco公司,批号:1342967);胎牛血清(杭州四季青生物工程材料有限公司,批号:140130);磺基罗丹明B(SRB,Sigma,批号:3520421);苯甲基磺酰氟(PMSF,Sigma,批号:101335685); RNA提取试剂盒(上海生工生物技术有限公司,批号:13112605Y);cDNA逆转录试剂盒(Thermo 公司,批号:00170212);实时荧光定量SYBR Green扩增试剂盒(凯杰公司,批号:148041276):Annexin V/FITC凋亡检测试剂盒、PI周期检测试剂盒(杭州碧云天生物技术研究所);Giemsa干粉、4-羟乙基哌嗪乙磺酸(HEPES,北京拜尔迪生物技术有限公司)。
1.1.2 主要仪器Thermo 3131型CO2细胞培养箱、Thermo 3001型多功能酶标仪、PCR扩增仪(美国Thermo公司);5424R型Eppendorf离心机(德国Eppendorf);倒置荧光显微镜(德国ZEISS公司); 流式细胞仪(美国BD公司);AR-2140 型电子天平(梅特勒-托利多仪器有限公司)。
1.2 方法 1.2.1 细胞培养取生长状态良好细胞B16F10,用含10% 胎牛血清、链霉素(100 μg·L-1)、庆大霉素(100 μg·L-1)的DMEM培养液(pH=7.5),在37 ℃、5 % CO2饱合湿度的培养箱中培养,取对数生长期细胞进行各项实验。
1.2.2 SRB法测定细胞增殖抑制率取对数生长期B16F10细胞,计数后用完全培养基制成细胞悬液,按每孔0.8×104个细胞接种于96孔板中,培养过夜,然后加不同浓度的甘草查尔酮A,使终浓度分别为0、15、30、45、60、75 μmol·L-1,继续分别培养24、48和72 h,培养结束后,每孔加入50%(质量/体积)的三氯乙酸(TCA)50 μL固定细胞,然后在4℃ 冰箱中放置1 h。培养板各孔用去离子水洗涤5遍,使TCA被去除。室温条件下,晾干96孔板内残余液体,每孔加0.4% 的SRB 100 μL,在室温下放置20 min,弃去各孔内液体(回收)后用1% 乙酸洗涤5遍,去除未结合的染料,空气中干燥后用DMSO(二甲基亚砜)150 μL溶解,在平板振荡器上振荡5 min,Thermo 3001多功能酶标仪OD 515nm测量各孔的吸光值。并按下公式计算药物对细胞增殖的抑制率:
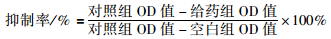
取对数生长期细胞,消化,离心后,按每孔3×105 个细胞接种于6孔板,待细胞贴壁状态良好,用终浓度为0、15、30、45 和60 μmol·L-1甘草查尔酮A处理B16F10细胞24 h后,在倒置显微镜下观察并拍照。
1.2.4 Giemsa染色观察取对数生长期细胞,消化,离心后,按每孔3×105 个细胞接种于6孔板,待细胞贴壁状态良好,用终浓度为0、15、30、45 和60 μmol·L-1甘草查尔酮A处理B16F10细胞24 h后,吸弃培养液,PBS洗2遍,每孔加固定液(甲醇 ∶ 冰醋酸=3 ∶ 1)1 mL,固定30 min后,吸弃固定液,PBS洗2遍,每孔加Giemsa染色液1.5 mL,染色15 min,吸弃染液,PBS洗2~3遍,吸弃PBS,晾干,镜下观察并拍照。
1.2.5 比色法检测细胞内外黑色素含量接种对数生长期的B16F10细胞,(按每孔3×105 个细胞接种于6孔板),待细胞贴壁状态良好,加入终浓度为0、15、30、45 和60 μmol·L-1甘草查尔酮A后,继续培养 24 h,PBS洗2次,用0.25% 的胰酶消化收集于离心管,8 400 r·min-1 离心15 min,收集细胞上清液,取1 mL上清液加入1 mL 0.4 mol·L-1 HEPES buffer (pH 6.8)和1 mL 乙醚乙醇混合物(乙醚 ∶ 乙醇=1 ∶ 1),8 400 r·min-1 离心15 min,取下层水相铺96孔板,每组6个平行孔,于405 nm 测定细胞外吸光度(A);将细胞沉淀制成悬液,计数后加入1 mL含10% DMSO-NaOH,80℃煮1 h,12 000 r·min-1 离心10 min,取上清液铺96孔板,每组6个平行孔,于405 nm测定细胞内吸光度(A)。
1.2.6 检测细胞凋亡率细胞经药物作用24 h后,离心(1 000 r·min-1,离心5 min)收集。用PBS 洗涤细胞1次 (1 000 r·min-1,离心5 min),调整细胞数为1×105个。加入Binding buffer悬浮细胞液500 μL。 轻缓操作,混匀细胞,加入Annexin V-FITC 5 μL混匀,加入碘化丙啶(propidium iodide,PI)5 μL,混匀。室温,避光,反应 10 min,在1 h内进行流式细胞仪的观察和检测。激发波长 Ex=488 nm;发射波长 Em=530 nm。
1.2.7 细胞周期的检测细胞经药物处理24 h后,收集细胞于离心管中,离心弃上清液,加预冷的70% 乙醇3 mL,边加边振荡,使细胞完全分散后置4℃冰箱过夜,然后离心弃去乙醇,加 PBS洗2遍,最后加配好的PI染液(0.05 g·L-1),RNase A(0.5 g·L-1)避光染色 30 min。用流式细胞仪检测各细胞周期所占的比例,激发波长 Ex=488 nm;发射波长 Em=650 nm。
1.2.8 Q-PCR检测凋亡相关基因Bax、Bcl-2及周期相关基因Cyclin E2、CDK2的mRNA表达取对数生长期细胞,消化,离心,计数,每培养瓶加入5×105个细胞,培养24 h后,加甘草查尔酮A,使其终浓度分别为0、15、30、45和60 μmol·L-1,继续培养24 h。根据试剂盒说明书操作,先提取总RNA,定量后进行逆转录反应,上PCR扩增仪进行扩增反应。扩增条件:95 ℃预变性5 min,95℃ 变性10 s,60℃ 退火和延伸30 s,不同引物选择不同温度退火,退火40 s,循环数为40-60次,最后得PCR产物并分析数据。 PCR引物序列见下表(Tab1)。
| Name | Sequence | Product size/bp |
| Bax | (+) 5′-TGAACTGGACAGCAATATGGA-3′ | 112 |
| (-) 5′-GAAGTTGCCATCAGCAAACAT-3′ | ||
| Bcl-2 | (+) 5′-ATGTTGAGAACGGAAACCATC-3′ | 168 |
| (-) 5′-CGAGACAGTAATCAGGGCATC-3′ | ||
| CyclinE2 | (+) 5′-TGTGCATTCTAGCCATCGAC-3′ | 119 |
| (-) 5′-GTCATCCCATTCCAAACCTG-3′ | ||
| CDK2 | (+)5′-GGTCTGTTCATCGTGGTTCA-3′ | 139 |
| (-) 5′-ACCTGGCTCATTGGTGGTA-3′ | ||
| GAPDH | (+)5′-CAAGGTCATCCATGACAACTT-3′ | 406 |
| (-) 5′-GTCCACCACCCTGTTGCTGTA-3′ |
所有实验设3个平行组或重复3次,结果以 ± s表示,以F检验(Origin7.5统计软件)进行组间比较。
± s表示,以F检验(Origin7.5统计软件)进行组间比较。
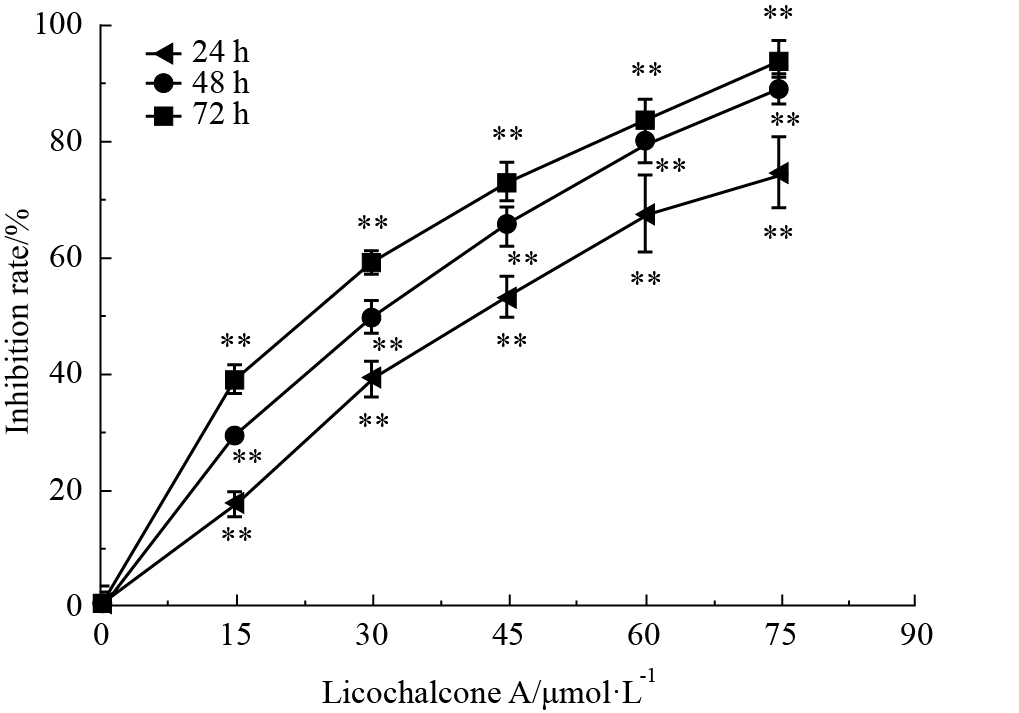
甘草查尔酮A作用于B16F10细胞24、48和72 h后,细胞增殖抑制率明显升高,且呈现浓度依赖性和时间依赖性(Fig1),各时间点IC50分别为(45.32±1.06)μmol·L-1、(35.40±3.2)μmol·L-1及(30.3±1.8)μmol·L-1。
|
Fig 1
Effect of Licochalcone A on proliferation rate of B16F10 cells( ± s,n=3)
**P<0.01 vs control ± s,n=3)
**P<0.01 vs control
|
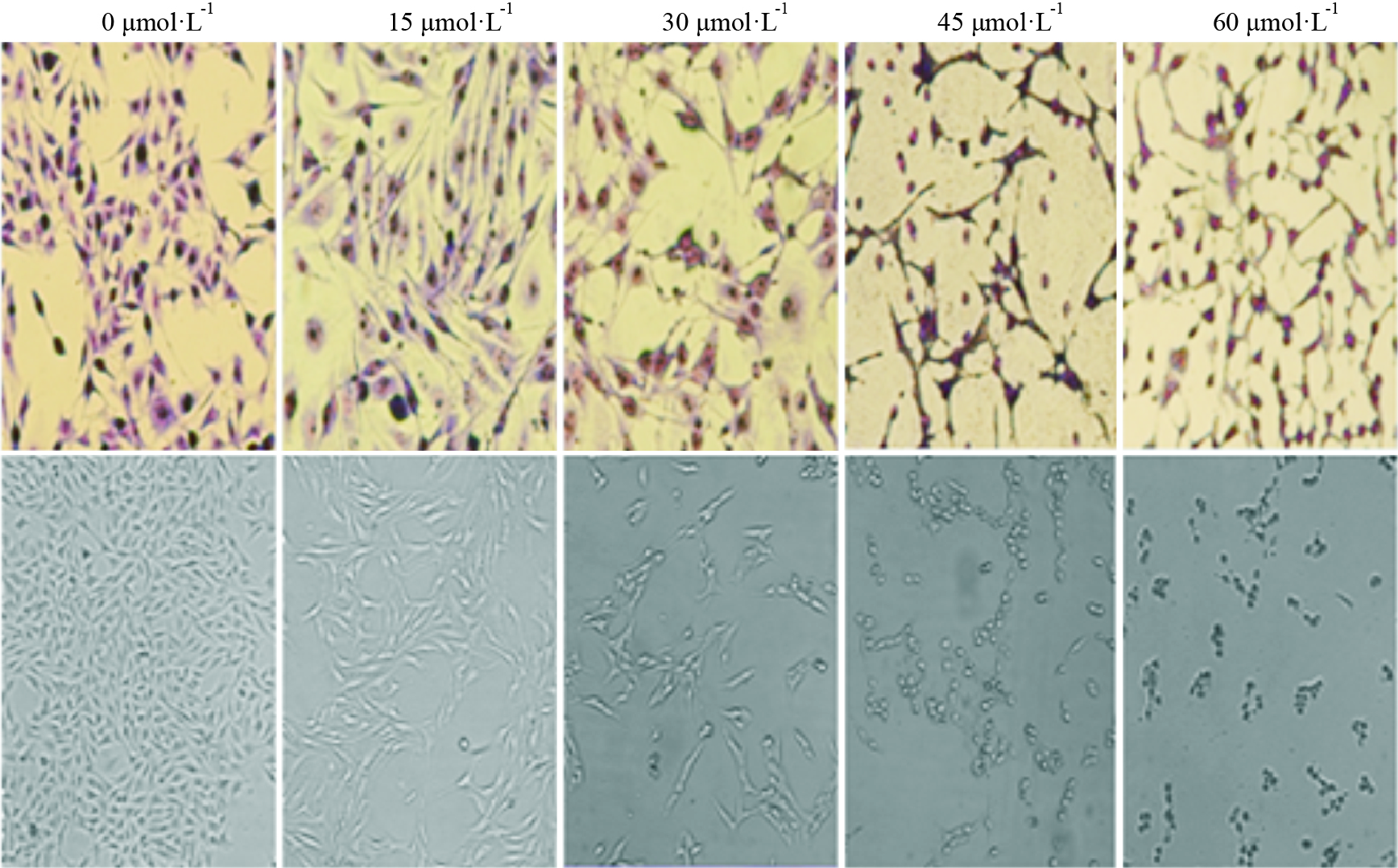
甘草查尔酮A作用B16F10细胞24 h后,经Giemsa染色,在倒置相差显微镜下观察发现,对照组细胞贴壁状态良好,呈不规则梭形,随着药物浓度的增加(15、30、45、60 μmol·L-1),细胞数量逐渐减少,低浓度加药组(15和30 μmol·L-1)细胞变长,呈现树突网状结构,高浓度组(45和60 μmol·L-1)细胞体积逐渐缩小,呈现固缩的圆形结构,且有黑色颗粒物出现(Fig2)。
|
| Fig 2 Effect of Licochalcone A on morphological changes in B16F10 cells observed by Giemsa (upper) (×200) and under phase contrast microscope (lower) (×200) |
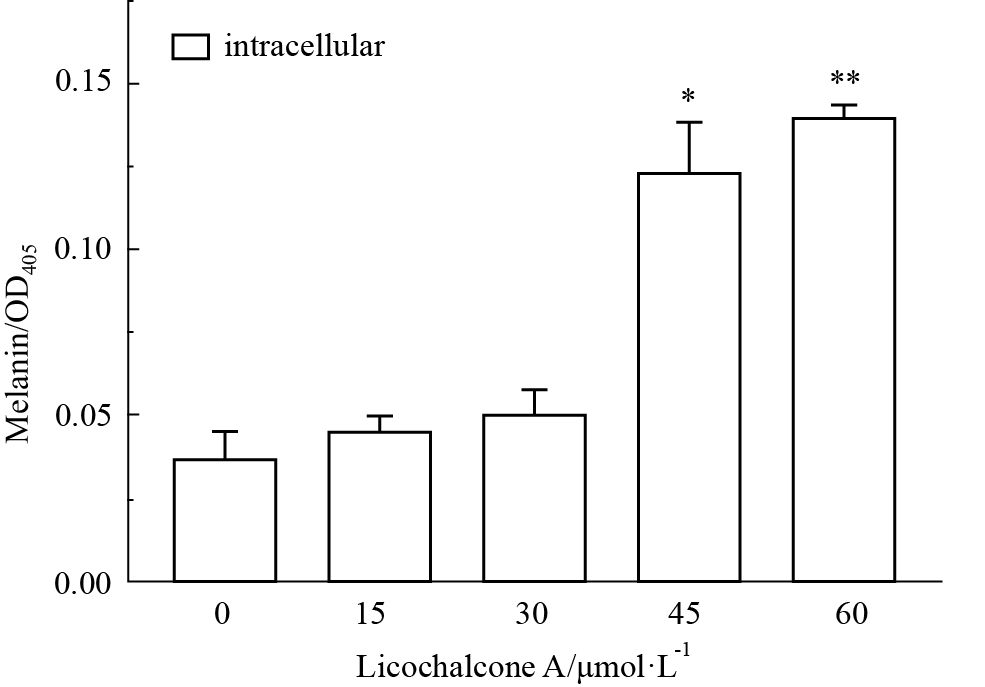
如Fig3、4所示,随着药物浓度的增加,甘草查尔酮A能明显促进B16F10细胞内外黑色素含量增加,且呈浓度依赖性。与对照组相比,加药组(45 μmol·L-1)B16F10细胞内黑色素含量差异有显著性(P<0.05);加药组(15 μmol·L-1)B16F10细胞外黑色素含量差异有显著性(P<0.05)。
|
Fig 3
Effect of Licochalcone A on intracellular melanin production of B16F10 cells ( ± s,n=3)
*P<0.05, **P<0.01 vs control ± s,n=3)
*P<0.05, **P<0.01 vs control
|
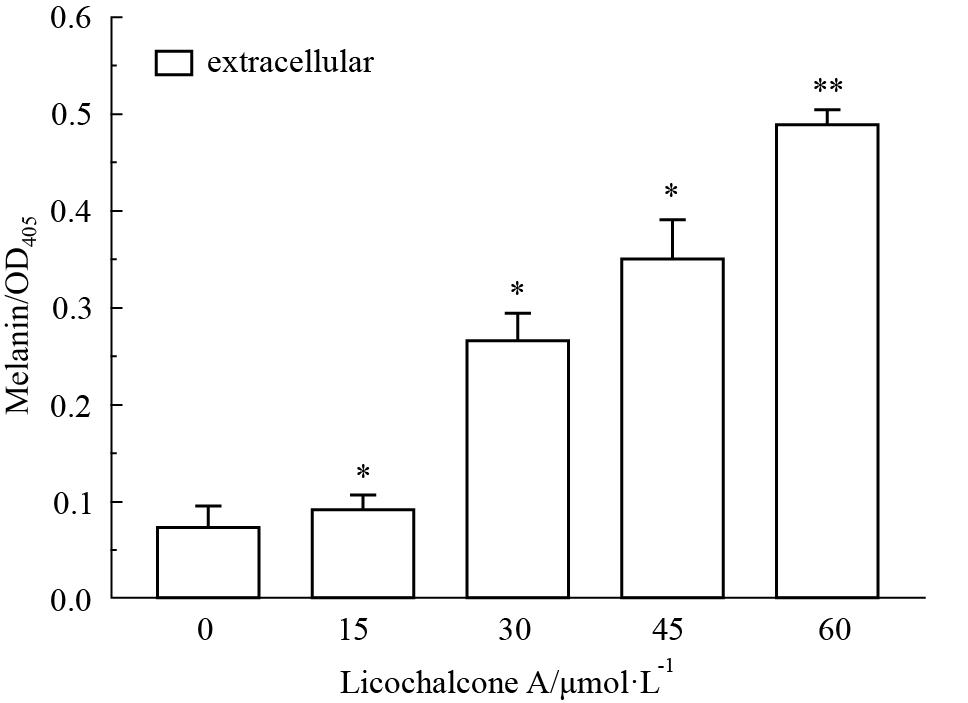
|
Fig 4
Effect of Licochalcone A on extracellular melanin production of B16F10 cells ( ± s,n=3)
*P<0.05, **P<0.01 vs control ± s,n=3)
*P<0.05, **P<0.01 vs control
|
如Fig5所示,甘草查尔酮A能诱导B16F10细胞凋亡,呈现浓度依赖性。 与对照组相比,加药组(45和60 μmol·L-1)B16F10细胞凋亡率具有差异显著性(P<0.01)。

|
Fig 5
Effect of Licochalcone A on apoptotic rates of B16F10 cells ( ± s,n=3)
**P<0.01 vs control ± s,n=3)
**P<0.01 vs control
|
如Fig6所示,随着甘草查尔酮A浓度增加,B16F10细胞G1期分布比率增加,S期分布比率下降,且呈现浓度依赖性。
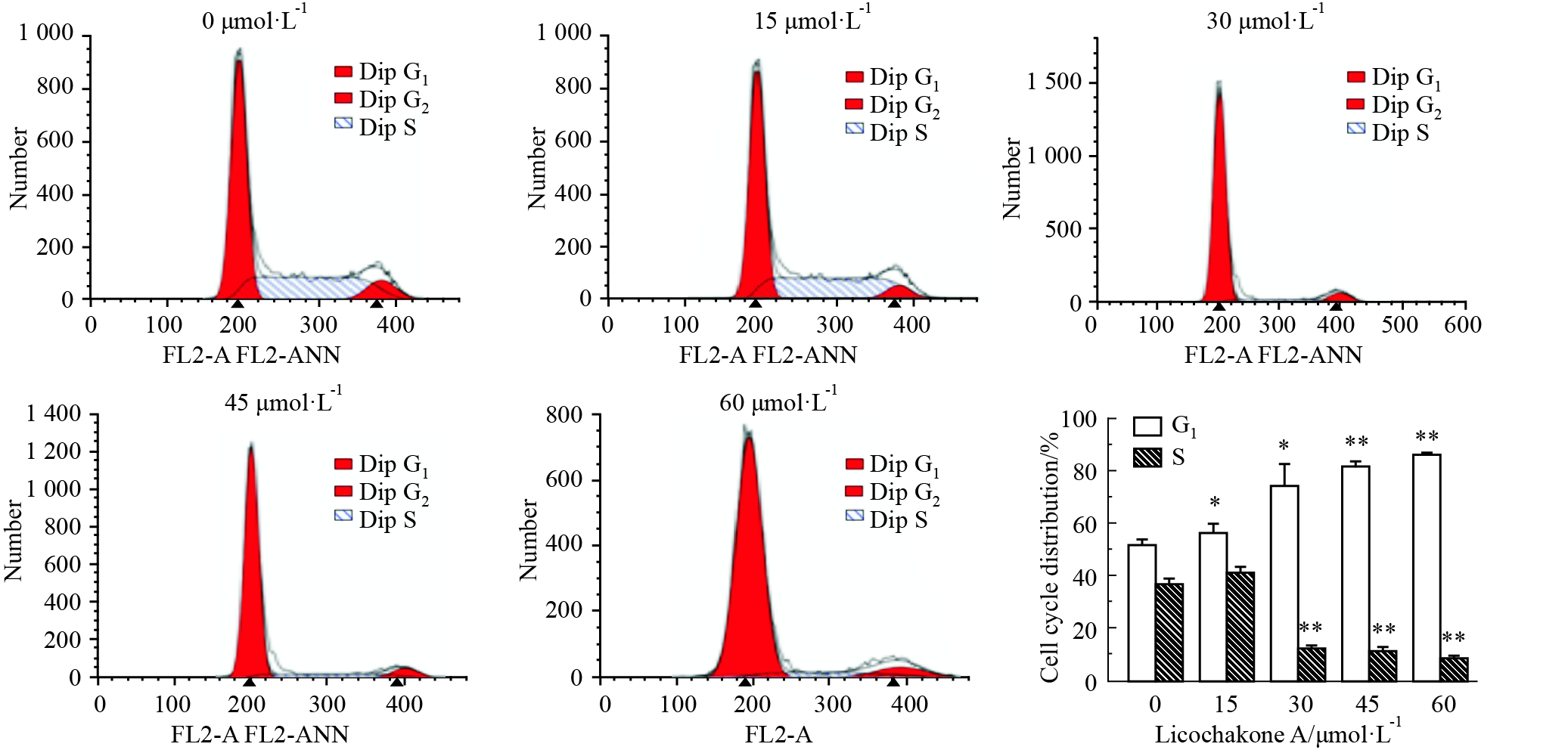
|
Fig 6
Effect of Licochalcone A on cell cycle distribution of B16F10 cells ( ± s,n=3)
*P<0.05, **P<0.01 vs control ± s,n=3)
*P<0.05, **P<0.01 vs control
|
如Fig7所示,甘草查尔酮A能明显抑制 Bcl-2 基因的表达,促进Bax基因的表达。与对照组相比,加药组(15 μmol·L-1)B16F10细胞Bcl-2和Bax基因表达(P<0.05)差异有显著性。
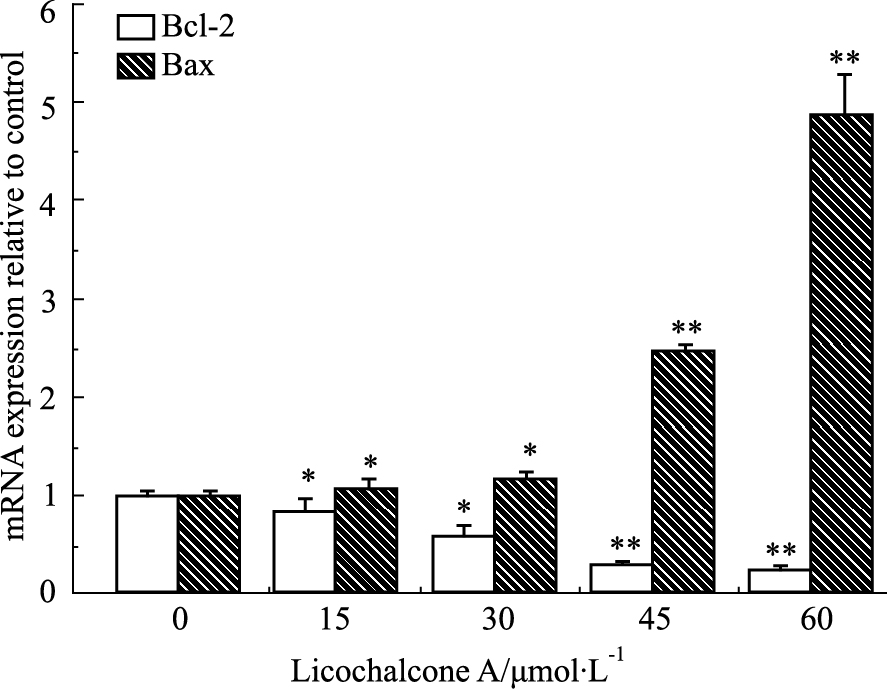
|
Fig 7
Effect of Licochalcone A on mRNA expression levels of Bcl-2 and Bax in B16F10 cells ( ± s,n=3)
*P<0.05, **P<0.01 vs control ± s,n=3)
*P<0.05, **P<0.01 vs control
|
如Fig8所示,甘草查尔酮A能 明显抑制CyclinE2和CDK2基因的表达,具有浓度依赖性。与对照组相比,加药组(15 μmol·L-1)B16F10细胞CyclinE2 和CDK2基因表达(P<0.05)差异有显著性。
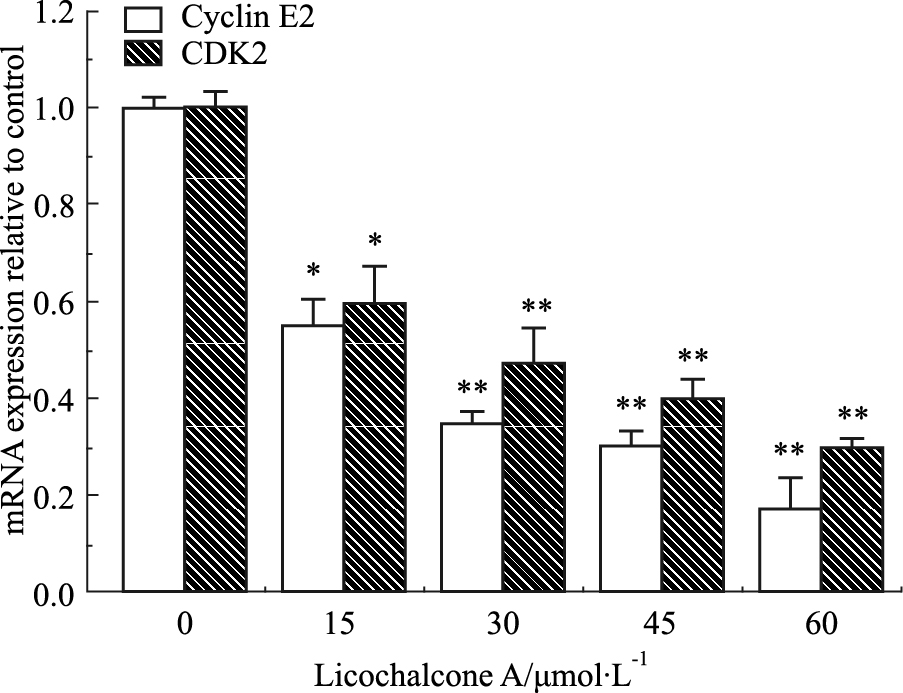
|
Fig 8
Effect of Licochalcone A on mRNA expression levels of CyclinE2 and CDK2 in B16F10 cells ( ± s,n=3)
*P<0.05, **P<0.01 vs control ± s,n=3)
*P<0.05, **P<0.01 vs control
|
肿瘤细胞具有快速增殖、抵抗凋亡、无限复制等特征[5]。肿瘤细胞的这些特征,使临床治疗出现很多困难,给人类健康带来巨大威胁,其中,黑色素瘤的发病危险系数与总体死亡率依旧呈现逐年上升的趋势。近年来天然药物以不良反应少、毒性低、药源丰富受到人们广泛关注。甘草查尔酮A是一种黄酮类化合物,主要来源于甘草中。越来越多研究证明甘草查尔酮A对多种肿瘤细胞有抑制作用[6, 7, 8, 9],但对小鼠黑色素瘤B16F10细胞增殖抑制机制的研究未见报道。
黑色素瘤细胞的典型分化特征是细胞形态呈现树枝状,且细胞内外黑色素含量明显增加[10]。在本研究中,低浓度组(15和30 μmol·L-1)甘草查尔酮A能使细胞呈现典型的分化形态,细胞体积变大,呈现树突网状结构;高浓度组(45和60 μmol·L-1)细胞体积固缩为圆球状,并伴有黑色颗粒物出现,同时,甘草查尔酮A能促进B16F10细胞内外黑色素含量明显增加。这些都表明甘草查尔酮A能诱导B16F10细胞分化,使B16F10细胞趋向正常黑色素细胞,分泌大量黑色素。
为了进一步明确甘草查尔酮A抑制 B16F10细胞增殖机制,采用流式细胞技术检测细胞凋亡率和细胞周期分布情况。本研究发现:与对照组相比,低浓度组(15和30 μmol·L-1)细胞凋亡率仅为0%和1.36%;而高浓度组(45和60 μmol·L-1)细胞凋亡率为25.8% 和32.66%,且差异具有显著性。这些结果表明:低浓度甘草查尔酮A能诱导B16F10细胞分化,而高浓度甘草查尔酮A可能诱导细胞凋亡。另外,甘草查尔酮A还能使B16F10细胞周期分布率发生明显变化,呈现G1期细胞增加,S期细胞减少的趋势。
已有研究表明,Bcl-2和Bax都属于凋亡基因Bcl-2家族蛋白,Bax /Bcl-2 可以决定细胞对凋亡或生存信号的反应[11, 12];而周期蛋白CyclinE2与CDK2可结合形成复合物,促进细胞向S期过渡[13]。本研究结果显示:甘草查尔酮A能明显下调Bcl-2/Bax比率,诱导B16F10细胞凋亡;同时,甘草查尔酮A能减少Cyclin E2和CDK2的mRNA表达,抑制Cyclin E2与CDK2结合形成复合物,这样就促使细胞周期阻滞在G1期而无法进入S期,迫使细胞周期发生紊乱。
上述结果表明:甘草查尔酮A能有效抑制B16F10细胞增殖,低浓度(15和30 μmol·L-1)能诱导B16F10细胞分化,高浓度(45和60 μmol·L-1)能诱导B16F10细胞凋亡,这两种机制的发生可能是通过抑制Cyclin E2与CDK2的mRNA表达,促使细胞阻滞在G1期实现的。
(致谢:本研究在石河子大学药学院,新疆特种植物药资源教育部重点实验室完成。感谢肿瘤实验室郑秋生老师和同学在本课题的研究中给予我的关怀和支持,他们开创性的研究拓展了我的学术视野,创造了团结而上进的科研氛围中,使我的科研工作取得进展,谨此向我的导师郑秋生博士和实验室全体同学致以衷心的感谢和崇高的敬意!)
| [1] | Thompson J F,Scolyer R A,Kefford R F.Cutaneous melanoma[J]. Lancet, 2005,365(9460):687-701. |
| [2] | Xiao X Y,Hao M,Yang X Y,et al.Licochalcone A inhibits growth of gastric cancer cells by arresting cell cycle progression and inducing apoptosis[J]. Cancer Lett,2011,302(1):69-75. |
| [3] | Yo Y T,Shieh G S,Hsu K F,et al.Licorice and licochalcone-A induce autophagy in LNCaP prostate cancer cells by suppression of Bcl-2 expression and the mTOR pathway[J]. J Agric Food Chem,2009,57(18):8266-73. |
| [4] | Kim J K,Shin E K,Park J H,et al.Antitumor and antimetastatic effects of licochalcone A in mouse models[J]. J Mol Med (Berl),2010,88(8):829-38. |
| [5] | Hanahan D,Weinberg R A.Hallmarks of cancer:the next generation[J]. Cell,2000,100(1):57-70. |
| [6] | Kim K H,Yoon G,Cho J J,et al.Licochalcone A induces apoptosis in malignant pleural mesothelioma through downregulation of Sp1 and subsequent activation of mitochondria-related apoptotic pathway[J]. Int J Oncol,2015,46(3):1385-92. |
| [7] | Yang P,Tuo L,Wu Q,Cao X.Licochalcone-A sensitizes human esophageal carcinoma cells to TRAIL-mediated apoptosis by proteasomal degradation of XIAP[J]. Hepatogastroenterology,2014,61(133):1229-34. |
| [8] | Huang H C,Tsai L L,Tsai J P,et al.Licochalcone A inhibits the migration and invasion of human lung cancer cells via inactivation of the Akt signaling pathway with downregulation of MMP-1/-3 expression[J]. Tumour Biol,2014,35(12):12139-49. |
| [9] | Jiang J T,Yuan X,Zhao H,et al.Licochalcone A inhibiting proliferation of bladder cancer T24 cells by inducing reactive oxygen species production[J]. Biomed Mater Eng,2014,24(1):1019-25. |
| [10] | Umek R M, Friedman A D,McKnight S L.CCAAT-enhancer binding protein:a component of a differentiation switch[J]. Science,1991,251(4991):288-92. |
| [11] | Farrow S N,Brown R. New members of the Bcl-2 family and their protein partners [J]. Curr Opin Genet Dev,1996,6:45. |
| [12] | 孟 岩,李 艳,叶尚尚,张 月.rhEPO对高糖状态下大鼠Müller细胞凋亡及对Bcl-2和Bax 表达的影响[J]. 中国药理学通报,2013,29(8):1132-5. Meng Y,Li Y,Ye S S,Zhang Y.Effects of rhEPO on apoptosis of rat Müller cells cultured in high glucose and the expression of Bcl-2 and Bax[J]. Chin Pharmacol Bull,2013,29(8):1132-5. |
| [13] | Caldon C E,Musgrove E A.Distinct and redundant functions of cyclin E1 and cyclin E2 in development and cancer[J].Cell Div,2010,5:2. |