


2. 江南大学无锡医学院, 江苏 无锡 214062
2. Jiangnan University's Medicine, Wuxi Jiangsu 214062, China
硫化氢 (hydrogen sulfide,H2S) 作为第3种气体信号分子,近年来在心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤中的作用备受关注。本课题组前期研究证实,H2S后处理可减轻心肌I/R损伤[1],其机制可能与多种物质及信号通路有关。但目前人们对H2S保护心肌I/R损伤的机制尚未完全清楚。研究发现[2],激活腺苷酸活化蛋白激酶/过氧化物酶体增生物激活受体γ共激活因子1α (AMP-activated protein kinase-peroxisome proliferator activated receptor gamma co-activator,AMPK/PGC-1α)通路可减轻心肌细胞缺氧/复氧损伤。但是AMPK/PGC-1α 通路是否参与了H2S后处理对离体大鼠心肌I/R损伤的保护作用尚未见报道。本研究利用AMPK特异性抑制剂Compound C阻断AMPK/PGC-1α 信号通路,观察其对H2S后处理心肌保护作用的影响,以探讨AMPK/PGC-1α 信号通路在H2S抗心肌I/R损伤中的作用。
1 材料与方法 1.1 药品与试剂氯化三苯基四氮唑(TTC)、NaHS(Sigma,美国);AMPK抑制剂Compound C(Sigma,美国),用DMSO溶解;其余化学试剂均为国产分析纯产品。兔抗总AMPKα抗体(2603S,Cell Signaling)、兔抗磷酸化AMPKα(Thr172)单克隆抗体(2535P,Cell Signaling);兔抗PGC-1α多克隆抗体(ab54481,ABCAM);兔抗β-actin多克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG及兔超敏二步法免疫组化检测试剂、二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物公司);SDS-PAGE蛋白上样缓冲液、超敏ECL化学发光试剂盒(碧云天,中国)。
1.2 仪器Langendorff灌注装置、八通道生理记录仪Powerlab/8s(AD Instrument,澳大利亚);-80℃超低温冰箱(EppendorfAG,德国);石蜡切片机(Leica,德国);Nikon 80i光学显微镜及图像处理系统(Nikon 80i ,日本)。
1.3 大鼠离体心肌I/R模型建立清洁级♂SD大鼠72只,体质量(250~300) g,浙江省实验动物中心提供,实验动物许可证号:SCXK (浙) 2014-0001。大鼠腹腔注射肝素钠500 U·kg-1抗凝,10% 水合氯醛(300~350)mg·kg-1麻醉。开胸迅速取心脏,置于预冷(4℃)的改良Krebs-Henseleit(K-H)液中,迅速主动脉逆行插管并固定在Langendorff 灌注装置上。以改良的K-H液[其成分为(mmol·L-1):NaCl 118.5,KCl 4.7,CaCl2 2.5,MgSO4 1.2,KH2PO4 1.2,NaHCO3 24.8,d-Glucose 11,EDTA-2Na 0.125,pH 7.4,95% O2和5% CO2的混合气体饱和]行常规恒压灌流,维持灌流液温度37 ℃。心脏灌流(1~2) min后经左心耳切口向左心室插入球囊,向球囊缓慢注水调节囊内压为(0.67~1.33) kPa,另一端接压力传感器至多导生理记录仪,Labchart 7.0软件实时观测并分析左心血流动力学指标:心率(heart rate,HR)、左室发展压(left ventricular developed pressure,LVDP)、左室内压上升最大速率(the maximun rate of increase of left ventricular pressure,+dp/dtmax)、左室内压下降最大速率(the maximun rate of decrease of left ventricular pressure,-dp/dtmax)和左室舒张末压( left ventricular diastolic pressure,LVEDP)。
1.4 实验分组72只♂SD大鼠随机分为6组(n=12 ,每组中6只用于测定心肌梗死面积,6只用于免疫组化及Western blot检测):① Control组,37℃ K-H液全心灌注110 min;② I/R组,平衡20 min,全心停灌30 min后,再灌注60 min;③ DMSO组,平衡10 min后及再灌注5 min内用含有0.02% DMSO的K-H液灌注,共计15 min,其余步骤同I/R处理;④ CC组,平衡10 min后及再灌注5 min内灌注含10 μmol·L-1 Compound C溶于0.02% DMSO的K-H液,共15 min,其余处理同I/R组;⑤ NP组,全心停灌30 min后,即刻再灌含NaHS 10 μmol·L-1的K-H液15 s,不含NaHS的K-H液15 s,连续循环4次,共灌注60 min,其余处理同I/R组;⑥ N+C组,平衡10 min后及再灌注5 min内灌注含10 μmol·L-1 Compound C溶于0.02% DMSO的K-H液,共15 min,同时再灌即刻灌流含NaHS 10 μmol·L-1的KH液15 s,不含NaHS的K-H液15 s,连续循环4次,其余处理同I/R组。
1.5 心肌梗死面积测定再灌注末取下心脏于-80 ℃冰箱冷冻,自心尖至心底部将心脏横切约2 mm薄片,浸于1 % TTC磷酸缓冲液(pH 7.4)中,37 ℃恒温箱中闭光孵化20 min,染色过程中不时振荡使染色均匀,梗死心肌呈灰白色,正常存活心肌呈砖红色。甲醛固定后扫描,采用Image pro plus 6.0软件计算心肌梗死面积百分比(MIS%)=(心肌梗死面积之和/心肌总面积之和)×100%。
1.6 常规组织病理学检测及免疫组化检测再灌注末取心脏,4%甲醛溶液固定,乙醇梯度脱水,常规石蜡包埋切片,分别进行苏木精-伊红(hematoxylin-eosin,HE)及免疫组织化学染色。免疫组化染色按照兔超敏二步法免疫组化试剂盒说明书进行标记染色。一抗(PGC-1α,1 ∶ 300稀释)4℃孵育过夜,BAD显色,苏木精复染,镜下以黄色或深棕褐色颗粒为阳性标记观察 PGC-1α 表达。每张切片随机选取5个高倍视野(high power field,HPF)(×400),计数 PGC-1α 阳性细胞,以阳性表达指数(positive expression index,PEI)反映各组心肌组织 PGC-1α 表达的情况,表达指数/%=(视野内阳性细胞个数/视野内所有心肌细胞个数)× 100%。
1.7 Western blot 法半定量测定总的 AMPKα(t-AMPKα)、p-AMPKα 和 PGC-1α再灌注末迅速取左心室心肌组织于-80 ℃冰箱保存。标本齐后冰上裂解组织制备匀浆,4 ℃ 14 000×g 离心10 min,取上清BCA测蛋白浓度,配平煮沸,取等量心肌样本进行SDS-PAGE电泳,分离后将蛋白转移到PVDF膜上。5% BSA室温封闭2 h ,加入一抗(AMPKα,1 ∶ 1 000稀释;p-AMPKα,1 ∶ 1 000稀释;PGC-1α,1 ∶ 1 000稀释;β-actin,1 ∶ 3 000稀释),4℃孵育过夜,TBST室温漂洗,加入二抗(辣根过氧化物酶标记山羊抗兔IgG,1 ∶ 2 000稀释),室温摇床孵育2 h ,TBST漂洗后,ECL发光和曝光,用Image pro plus 6.0图像分析软件对蛋白条带进行半定量分析。
1.8 统计学分析 所有实验数据以 ± s表示,采用SPSS 16.0统计软件进行统计学处理。各组间比较采用单因素方差分析,差异有显著性时采用LSD(least significant difference)法进行两两比较。
± s表示,采用SPSS 16.0统计软件进行统计学处理。各组间比较采用单因素方差分析,差异有显著性时采用LSD(least significant difference)法进行两两比较。
结果显示,平衡末各组血流动力学指标间差异无统计学意义(P>0.05),见Tab1。再灌注60 min末,除Control组外,其余各组与基础值比较,LVEDP 明显升高(P < 0.05),HR、LVDP、±dp/dtmax 明显降低(P < 0.05);与I/R组比较,NP 组 LVEDP 明显降低(P < 0.05),HR、LVDP、±dp/dtmax 明显升高(P < 0.05);与NP组比较,N+C 组LVEDP明显升高(P < 0.05),HR、LVDP、±dp/dtmax明显降低(P < 0.05);DMSO组、CC组与I/R比较差异无统计学意义,见Tab2。
( ± s ,n=12) ± s ,n=12)
|
|||||
| Group | HR/min-1 | LVDP/kPa | +dp/dtmax/kPa·s-1 | +d | LVEDP/kPa |
| Control: time-matched reperfusion;I/R: ischemia reperfusion;DMSO: dimethyl sulfoxide;CC:AMPK/ PGC-1α pathway inhibitor Compound C(10 μmol·L-1);NP: hydrogen sulfide postconditioning(10 μmol·L-1);N + C: hydrogen sulfide postconditioning with Compound C | |||||
| Control | 253±16 | 12.2±0.6 | 332±24 | 251±13 | 1.05±0.09 |
| I/R | 254±14 | 12.2±1.4 | 325±25 | 246±14 | 1.03±0.11 |
| DMSO | 252±15 | 12.1±0.6 | 329±27 | 248±17 | 1.05±0.08 |
| CC | 249±18 | 12.2±0.9 | 322±22 | 244±13 | 1.04±0.06 |
| NP | 252±20 | 12.3±0.4 | 319±29 | 246±9 | 1.04±0.14 |
| N+C | 251±14 | 12.2±0.57 | 323±33 | 249±11 | 1.04±0.06 |
( ± s ,n=12) ± s ,n=12)
|
|||||
| Group | HR/min-1 | LVDP/kPa | +dp/dtmax/kPa·s-1 | +d | LVEDP/kPa |
| *P < 0.05 vs control;#P < 0.05 vs I/R;△P < 0.05 vs NP | |||||
| Control | 246±22 | 11.6±0.9 | 328±27 | 246±16 | 1.06±0.07 |
| I/R | 181±14* | 7.2±0.9* | 177±26* | 116±12* | 4.54±0.81* |
| DMSO | 187±17*△ | 7.2±0.9*△ | 182±25*△ | 119±13*△ | 4.19±0.40*△ |
| CC | 166±15*△ | 7.0±0.8*△ | 174±21*△ | 116±7*△ | 4.66±0.56*△ |
| NP | 233±12*# | 9.7±0.8*# | 282±24*# | 173±11*# | 3.73±0.84*# |
| N+C | 192±20*△ | 7.4±0.5*△ | 189±24*△ | 124±9*△ | 4.43±0.46*△ |
结果显示,与Control组梗死面积百分比 (15.2±2.9) % 比较,I/R组梗死面积百分比增加,为 (60±3.8)%(P < 0.05);与I/R组比较,NP组梗死面积百分比减小,为 (23.9±3.4) %(P < 0.05);与NP组比较,N+C组梗死面积百分比增加,为 (58.5±4.3)%(P < 0.05);DMSO组和CC组的梗死面积百分比分别为 (59.4±2.7)% 和(61.6±4.9)%,与I/R组比较差异无统计学意义,见Fig1。

|
Fig.1
Percentage of infract size of myocardium at the end of reperfusion( ± s ,n=6)
*P < 0.05 vs control;#P < 0.05 vs I/R;△P < 0.05 vs NP ± s ,n=6)
*P < 0.05 vs control;#P < 0.05 vs I/R;△P < 0.05 vs NP
|
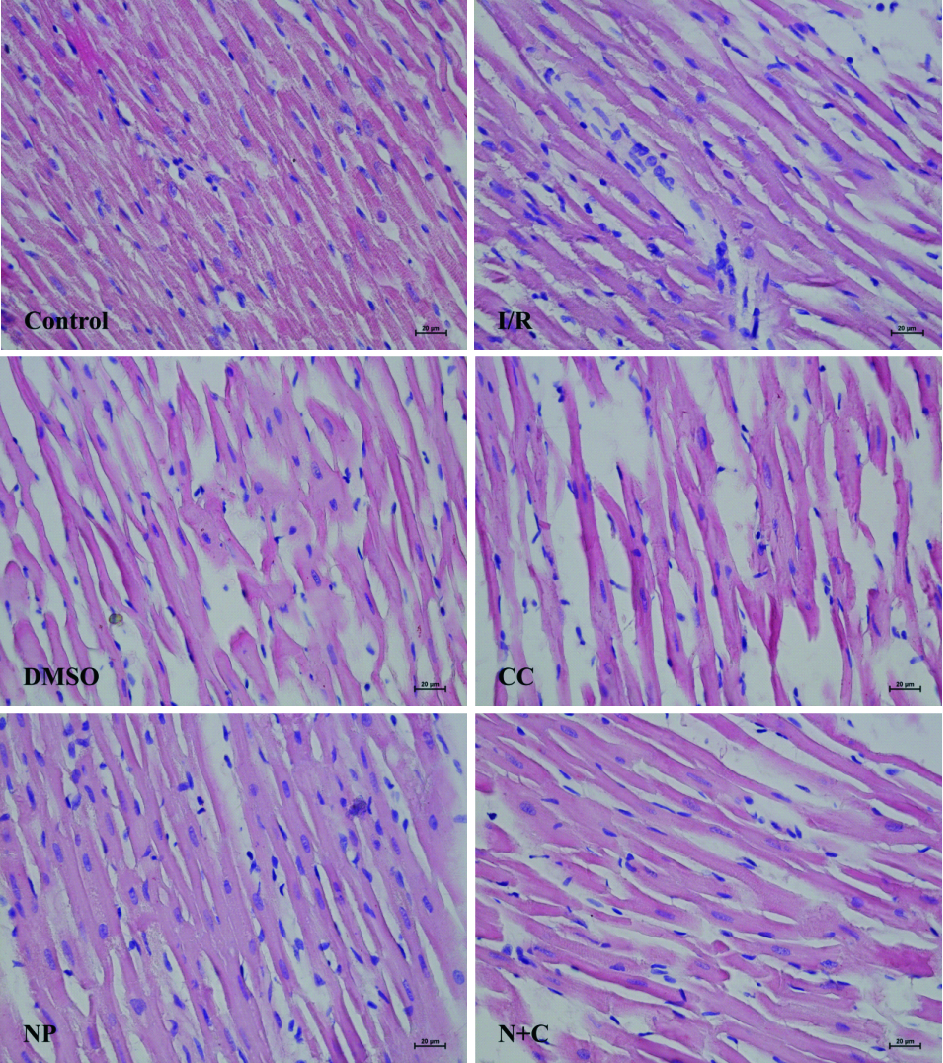
各组HE染色心肌组织形态学改变见Fig2。Control组心肌肌束排列整齐,有分支,着色均匀,胞膜完整,间质无水肿;I/R组心肌肌束排列紊乱,大量肌纤维断裂,间质水肿明显;NP组心肌肌束排列相对整齐,间质轻度水肿,介于正常组和I/R组之间;CC组和N+C组与I/R组比较无明显差异。
|
| Fig 2 The myocardial tissue morphology change after HE staining of each group(×400,bar=20 μm) |
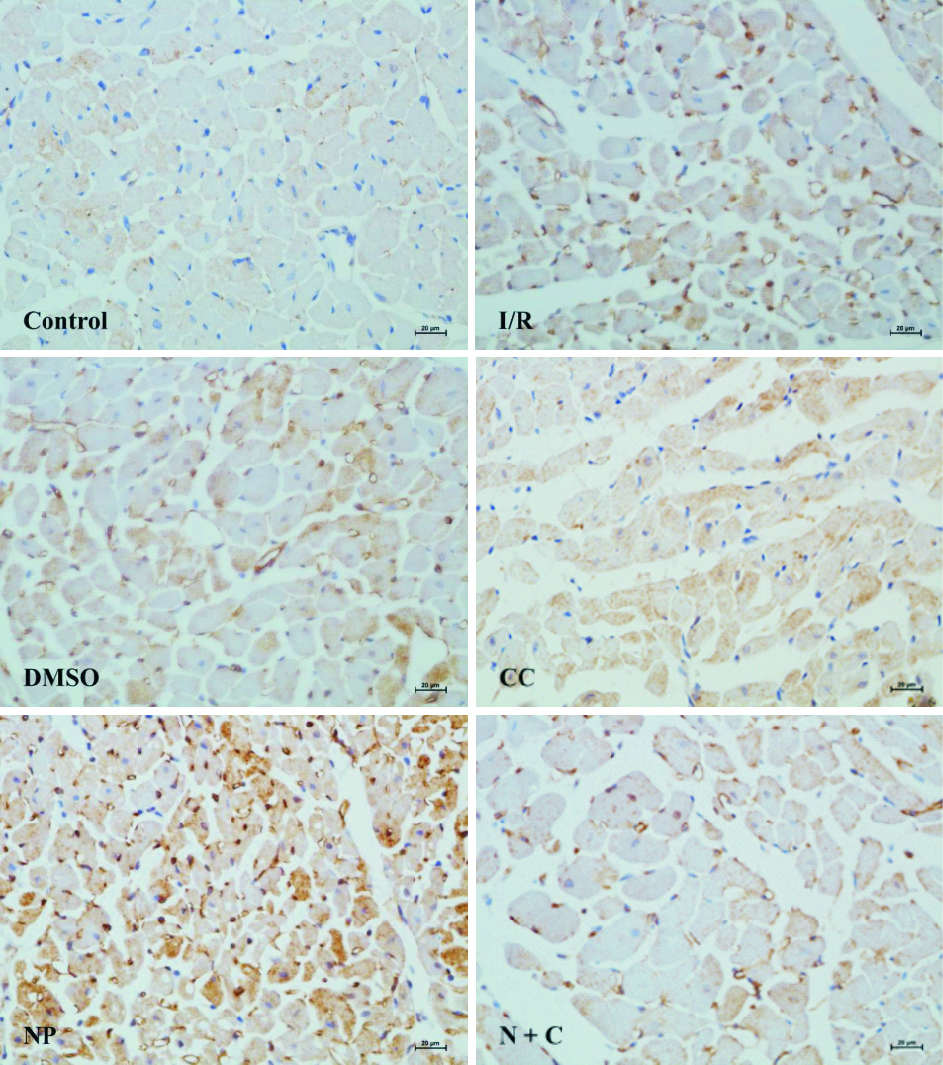
PGC-1α阳性反应为黄色或深棕褐色颗粒,主要在心肌细胞核中表达明显,见Fig3。结果显示,正常细胞核被苏木精复染成蓝色,少见阳性染色。与Control组PGC-1α 阳性表达指数(PEI)(11±4)%比较,I/R组PGC-1α PEI明显增加,为(41±5)%(P < 0.05);与I/R组比较,NP组PGC-1α PEI进一步增加,为 (54±3) %(P < 0.05);与NP组比较,N+C组PGC-1α PEI减少,为 (37±4)%(P < 0.05);DMSO组和CC组的PGC-1α PEI分别为 (36±5)%和(31±4)%,与I/R组比较差异无统计学意义。
|
| Fig 3 Expression of PGC-1α at 60 min reperfusion detected by immunohistochemstry(×400,bar=20 μm) |
Western blot 半定量分析p-AMPKα和PGC-1α 在心肌细胞中的表达情况,见Fig4A和Fig4B。结果显示,与Control组比较,I/R 组p-AMPKα、PGC-1α 蛋白表达水平升高(P< 0.05);与I/R组比较,NP组p-AMPKα、PGC-1α 蛋白表达水平进一步升高(P < 0.05);与NP组比较,CC组和N+C组p-AMPKα、PGC-1α 蛋白表达水平明显降低(P < 0.05);DMSO组与I/R组比较,差异无统计学意义。

|
Fig.4
Effect of various treatment procedures on expression of p-AMPKα, PGC-1α at 60 min reperfusion analyzed by Western blot( ± s ,n=3)
A: H2S increased the protein expression of p-AMPKα; B: H2S increased the protein expression of PGC-1α.*P < 0.05 vs control;#P < 0.05 vs I/R;△P < 0.05 vs NP ± s ,n=3)
A: H2S increased the protein expression of p-AMPKα; B: H2S increased the protein expression of PGC-1α.*P < 0.05 vs control;#P < 0.05 vs I/R;△P < 0.05 vs NP
|
随着心肌梗死发生率增高及早期冠脉再通治疗的广泛开展,心肌I/R损伤成为临床常见的病理生理现象,如何减轻I/R损伤是亟待解决的问题。越来越多的研究证明,新型气体信号分子H2S在重要脏器尤其是心肌缺血/再灌注损伤方面扮演着重要的角色。本课题组的前期研究证实,10 μmol·L-1的外源性NaHS后处理可以减轻离体大鼠心肌I/R损伤[1],其可能的机制有:激活JAK2 /STAT3信号通路[3]、调节抗肿瘤增值蛋白[4]和线粒体Cx43蛋白的表达[5]、激活线粒体ATP敏感性钾通道,抑制MPTP开放[6]等。但目前关于H2S对心肌I/R损伤的具体保护机制尚未完全阐明,仍需进一步研究。
AMPK/PGC-1α 信号通路是近年来新发现的一条重要的细胞内信号通路,在调节缺血缺氧及能量代谢等方面发挥着重要的作用[7]。研究发现,在心肌缺血缺氧时,AMPK可被迅速激活,进而减轻心肌I/R损伤[8, 9]。PGC-1α作为AMPK的下游重要的靶分子,可被AMPK直接磷酸化,在线粒体生物合 成过程中发挥关键作用[10]。研究发现[11],激活AMPK/PGC-1α 通路可通过促进线粒体生物合成途径减轻心肌细胞缺氧/复氧损伤。另外也有文献报道p-AMPKα可以上调PGC-1α 蛋白的表达,其抑制剂Compound C可以抑制PGC-1α 的表达上调[2]。为了研究AMPK/PGC-1α 信号通路在H2S抗心肌缺血/再灌注损伤中的作用。本实验应用AMPK/PGC-1α 通路抑制剂Compound C,观察各组心功能指标、心肌梗死面积、HE染色心肌组织形态学改变以及p-AMPKα、PGC-1α 蛋白的表达情况。
本实验研究发现,与I/R组比较,NP组HR、LVDP、±dp/dtmax均升高,LVEDP降低,明显改善了心功能。同时,H2S后处理使心肌梗死面积减少,HE染色心肌组织形态学损伤也相对较轻,提示H2S后处理可以减轻心肌损伤。而加入Compound C抑制AMPK/PGC-1α 后,H2S后处理血流动力学的改善作用被废除,心肌梗死面积增加,HE染色心肌组织形态学损伤相对严重,提示AMPK/PGC-1α 参与了H2S后处理对心肌I/R损伤的保护作用。同时我们还发现,正常情况下,心肌细胞中p-AMPKα和PGC-1α 蛋白的表达均较少;I/R后,二者表达水平均升高。但在H2S后处理后,与I/R组比较,二者的表达水平进一步升高,提示H2S后处理诱导了上述蛋白的表达;而加入Compound C后,上述蛋白的表达水平均又下降,提示Compound C抑制了H2S后处理诱导的p-AMPKα和PGC-1α 蛋白的表达能力,提示p-AMPKα可能通过诱导PGC-1α 蛋白的表达而参与硫化氢后处理的抗心肌I/R损伤作用。与Yan等[12] 发现的p-AMPKα可以上调PGC-1α 蛋白的表达发挥心肌保护作用的报道相一致。
综上所述,AMPK/PGC-1α 信号通路参与了硫化氢抗心肌缺血/再灌注损伤的作用,其机制可能与硫化氢后处理激活AMPK,上调PGC-1α 的表达有关。但硫化氢后处理与AMPK/PGC-1α 信号通路之间的具体机制将有待于进一步的深入研究。
(致谢:本实验研究在江南大学无锡医学院庞庆丰教授实验室完成,感谢庞庆丰教授给予我整个课题实验的悉心指导、帮助和支持!)
| [1] | Ji Y, Pang Q F, Xu G, et al. Exogenous hydrogen sulfide postconditioningprotects isolated rat hearts against ischemia-reperfusion injury[J]. Eur J Pharmacol, 2008, 587(1-3):1-7. |
| [2] | Ghorbangol A, Faribak K, Leila K, et al. Activation of AMP-activated protein kinase by metformin protects against global cerebral ischemia in male rats:Interfernce of AMPK/PGC-1α pathway [J]. Metab Brain Dis, 2014, 29(1):47-58. |
| [3] | Luan H F, Zhao Z B, Zhao Q H, et al. Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia and reperfusion injury mediated by the JAK2/STAT3 survival pathway[J]. Brazilian J Med Bio Res, 2012, 45(10):898-905. |
| [4] | 毛洪雅,杨洁琼,季 永,等. JAK2/STAT3调节抗增殖蛋白表达在H2S后处理心肌细胞中的保护作用[J].中国药理学通报,2014, 30(8):1122-6.Mao H Y, Yang J Q, Ji Y, et al. Role of JAK2/STAT3-regulated prohibition in cardioprotection of H2S postconditioning in hypoxia/reoxygenation-treated cardiomyocytes[J].Chin Pharmacol Bull, 2014, 30(8):1122-6. |
| [5] | 季 永,张可璇,毛洪雅,等. 缝隙连接蛋白 Cx43 介导硫化氢后处理对大鼠心肌的保护作用[J].中国药理学通报,2013, 29(7):999-1003.Ji Y, Zhang K X, Mao H Y, et al. Protective effects of Cx43-mediated exogenous hydrogen sulfide postconditinoing on rat hearts[J].Chin Pharmacol Bull, 2013, 29(7):999-1003. |
| [6] | 杨海扣,于 水,米 琰,等. 外源性硫化氢后处理对大鼠心肌缺血/再灌注损伤线粒体通透性转换孔的影响[J].中国药理学通报, 2010, 26(7):944-7.Yang H K, Yu S, Mi Y, et al. Effect of exogenous hydrogen sulfide postconditioning on the mitochondrial permeability transition pore against ischemia-reperfusion injury in isolated rat heart[J].Chin Pharmacol Bull,2010, 26(7):944-7. |
| [7] | Zaha V G, Young L H. AMP-activated protein kinase regulation and biological actions in the heart [J]. Circ Res, 2012, 111(6):800-14. |
| [8] | Kambara T, Ohashi K, Shibata R, et al. CTRP9 protein protects against myocardial injury following ischemia-reperfusion through AMP-activated protein kinase(AMPK)-dependent mechanism[J]. J Biol Chem, 2012, 287(23):18965-73. |
| [9] | Kim A S, Miller E J, Wright T M, et al. A small molecule AMPK activator protects the heart against ischemia-reperfusion injury[J]. J Mol Cell Cardiol,2011, 51(1):24-32. |
| [10] | 郭 茜,郭家彬,李 梨,等. PGC-1α与线粒体生成调控在心血管疾病中的作用[J].中国药理学通报, 2013, 29(1):1-5.Guo Q, Guo J L, Li L, et al. Role of PGC-1α and mitochondrial biogenesis in cardiovascular diseases[J].Chin Pharmacol Bull,2013, 29(1):1-5. |
| [11] | Sun L, Zhao M, Yu X J, et al. Cardioprotection by Acetylcholine:A novel mechanism via mitochondrial biogenesis and function involving the PGC-1αpathway [J]. J Cell Physiol, 2013, 228(6):1238-48. |
| [12] | Yan W, Zhang H, Liu P, et al. Impaired mitochondrial biogenesis due to dysfunctional adiponectin-AMPK-PGC-1α signaling contributing to increased vulnerability in diabetic heart[J].Basic Res Cardiol,2013,108(3):329. |

