2. 北京中医药大学基础医学院关键技术中心, 北京 100029
2. Key Technological Center of Chinese Medicine, School of Pre-clinical Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
流感病毒在宿主细胞内进行复制增殖,最终使感染细胞变性直至凋亡[1];细胞凋亡受多种相关基因及其蛋白调控,其中天冬半胱氨酸蛋白酶(caspase)与细胞凋亡关系最密切。黄芩苷是一种来源于植物的多羟基黄酮类化合物,具有抗病毒[2],抗氧化[3],抗肿瘤[4],促进神经干细胞分化[5],等药理活性。有研究报道黄芩苷能缓解炎性病理损伤,通过抑制流感病毒感染引起的转录因子AP-1高表达而降低炎性细胞因子的分泌水平[6];还通过影响细胞凋亡受体途径FAS/FASL,病毒感染小鼠肺组织细胞的凋亡系统[7],从而发挥抗流感病毒感染的作用。目前,黄芩苷对感染细胞凋亡的调控机制尚末完全阐明。因此,本研究以黄芩苷作用于流感病毒H1N1感染人肺腺癌A549细胞,探讨其对细胞凋亡关键酶caspase-3和-8的基因表达水平的影响,明确黄芩苷体外对流感病毒诱导细胞凋亡的调控作用机制,为进一步阐明其抗流感作用机制提供更多的实验依据。
1 . 材料 1.1 实验材料 1.1.1 流感病毒与实验细胞甲型H1N1流感病毒,A1/黔防/166/85株提供为中国中医科学院中药所为本室长期低温保存备用。接种于9日龄鸡胚尿囊腔连续传代2次后,病毒原液血凝滴度为2-7,TCID50=10-3.778。实验用细胞为人肺腺癌上皮细胞(A549)购自中国医学科学院细胞中心。
1.1.2 实验药物黄芩苷,黄色粉末,纯度98.2%,分子质量446.35,北京中医药大学基础医学院关键技术中心王玥琦教授惠赠;阳性对照磷酸奥司他韦胶囊(达菲),瑞士巴塞尔豪夫·迈罗氏公司生产产品,批号B1354,分装批号SH0037。
1.1.3 实验试剂McCoy’s 5A培养基和胎牛血清 (Gibco公司,美国);0.25%胰酶-0.02% EDTA (Thermo公司,美国);细胞培养液(含胎牛血清体积分数0.10和含青-链霉素混合物体积分数0.01的完全McCoy’s 5A培养基),细胞维持液(胎牛血清体积分数0.30的McCoy’s 5A培养基);1.5%鸡红细胞混悬液;PCR引物由上海生工生物工程有限公司合成;M-MLV反转录试剂盒(TaKaRa公司);qRT-PCR扩增试剂盒(北京泽平生物技术有限公司);100 bp DNA ladder(北京全式金生物技术有限公司)。
1.2 实验方法 1.2.2 实验分组细胞对照组(A)、H1N1感染组(B)、奥司他韦对照组(C:0.75 mg·L-1)、黄芩苷高剂量组(F:3.96 mg·L-1)和黄芩苷低剂量组 (G:0.99 mg·L-1)。除正常细胞对照组外,均接种100TCID50的病毒液,每孔100 μL,置37℃,5% CO2培养箱中吸附2 h,吸弃病毒液,轻轻加入PBS清洗2次后,分别加入上述浓度的药物。置于培养箱中培养48 h后弃去上清,PBS清洗1次后,加入Tris-HCl裂解液吹打,裂解液使得细胞变圆形,浮起,收集细胞裂解液置冻存管中,置-80℃冰箱冻存。
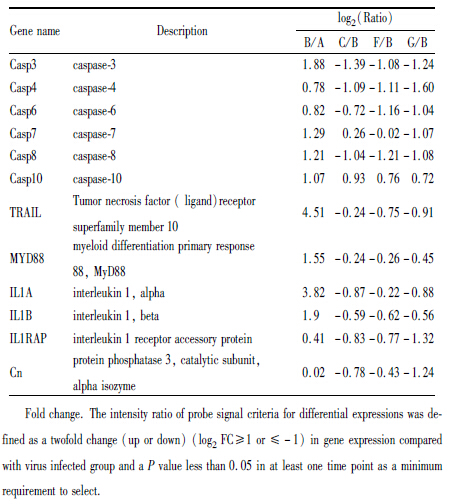
1.2.3 基因芯片分析芯片实验由华联生物科技股份有限公司完成。提取各组细胞的总RNA,定量并鉴定。反转录合成cDNA,用荧光染料Cy3和Cys双色荧光标记,检定荧光强度和标记效率,芯片杂交及扫描计算探针信号在各组与模型组的强度比值。查找基因信息功能及生物路径,筛选出与凋亡相关通路中密切相关的差异表达基因。各组探针讯号的强度比值,以log2(Ratio)表示。与H1N1感染组比较,log2(Ratio)>1,表示明显上调的表达基因;log2(Ratio)<-1,表示明显下调的表达基因。
1.2.4 荧光定量PCR检测设计GAPDH,caspase-3和caspase-8的引物序列,见Tab1,提取各组细胞总mRNA后,进行反转录。按试剂盒说明,进行PCR反应。RT-PCR产物进行琼脂糖凝胶电泳。将凝胶置于紫外自动成像系统,启动自动分析软件,记录目的基因扩增条带的灰度值,并分别计算内参基因GAPDH值与各样本目的基因的比值,统计目的基因表达的相对量,采用2-ΔΔCT方法计算。
| Gene name | Forward | Revers |
| GAPDH(136 bp) | 5′-GGGTGTGAACCATGAGAAGT-3′ | 5′-GACTGTGGTCATGAGTCCT-3′ |
| caspase-3(131 bp) | 5′-AGCACTGGAATGACATCTCG-3′ | 5′-CGCATCAATTCCACAATTTC-3′ |
| caspase-8(97 bp) | 5′-TGCAAGAGGAAATCTCCAAA-3′, | 5′-TTTCCTTCTCCCAGGATGAC-3′ |
采用SPSS 20.0统计软件进行统计学分析计量资料以x±s表示,各组间差异采用单因素方差分析,两两组间比较采用LSD-t检验。
2 . 结果 2.1 基因芯片数据分析生物学路径及部分经典差异表达基因通过KEGG pathway分析细胞凋亡信号传导途径。与细胞对照组(A)相比,H1N1感染组(B)差异表达基因Casp3、Casp7、Casp8、Casp10、TRAIL、MYD88、IL1A、和IL1B明显上调;与H1N1感染组(B)比较,奥司他韦对照组(C)对差异表达基因Casp3、Casp4和Casp8明显下调;黄芩苷高剂量组(F)对差异表达基因Casp3、Casp4、Casp6和Casp8明显下调;黄芩苷低剂量组(G)对差异表达基因Casp3、Casp4、Casp6、Casp8、IL1RAP和Cn明显下调(Tab2)。
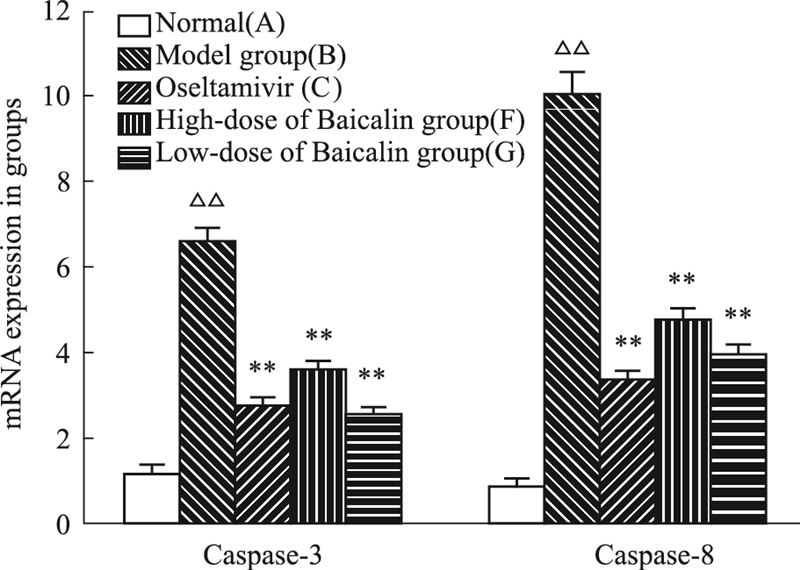
与细胞对照组(A)比较,H1N1感染组(B)Caspase-3、-8的mRNA表达均明显升高(均P < 0.01)。与H1N1感染组(B)比较,奥司他韦对照组(C)Caspase-3、-8的mRNA表达明显降低(P < 0.05 或 P < 0.01);黄芩苷组(F和G)的Caspase-3、-8的mRNA表达均明显降低(P < 0.01);该结果和基因芯片表达的结果基本相符。见Fig1。
|
| Fig.1 Comparison of expression of casp-3 and 8 in expression among groups (n=4,x±s) △△P<0.01 vs normal; **P<0.01 vs model |
流感病毒侵犯呼吸道其主要特征引起细胞凋亡[8]。细胞凋亡又叫细胞程序性死亡,一般被分为4个阶段,其中第3阶段是中心控制和效应阶段,凋亡信号激活ICE酶类-caspase(半胱氨酸蛋白酶家族),caspase执行细胞有秩序的死亡。凋亡途径分为caspase-8介导外源性途径(死亡受体途径)和内源性途径(caspase-9介导依赖线粒体途径等)[9, 10]。其中caspase-3是引发细胞凋亡的关键因子[11]。当caspase-3被激活后,作用于Bcl-2家族某些成员如Bad,进而引起宿主胞内的结构蛋白及DNA稳定被破坏,引起细胞凋亡。
本实验通过基因芯片筛选技术发现,与细胞对照组(A)相比,H1N1感染组(B)差异表达基因Casp3、Casp7、Casp8、Casp10、TNFSF10、MYD88、IL1A、和IL1B明显上调;这表明,流感病毒在体外感染细胞并诱导宿主细胞凋亡是通过外源性途径,并且主要通过高表达TRAIL诱导细胞程序性死亡[12, 13]。
而黄芩苷组 (F和G) 对与凋亡发生密切相关的差异表达基因Casp3、Casp4、Casp6和Casp8明显下调。应用荧光定量RT-PCR方法,检测相关病毒感染细胞中凋亡信号转导通路相关mRNA的表达,结果显示黄芩苷组(F和G)的Casp-3、-8的mRNA表达均明显降低(P < 0.01)。以上结果表明:黄芩苷能通过调控Casp-3、-8的表达干预流感病毒诱导的细胞凋亡。
此外,在内源性途径中又包括caspase-9介导依赖线粒体途径和内质网通路途径。内质网(endoplasmic reticulum,ER) 参与维持细胞内钙离子内环境稳定、膜蛋白的合成、修饰和折叠,内质网在凋亡信号处理过程中有重要作用[14]。钙离子稳态改变和蛋白质未折叠或错误折叠并在内质网蓄积可以引发内质网应激(endoplasmic reticulum stress,ERS),内质网应激会接激活存在于内质网上的caspase-12,存在于细胞质内的caspase-7会转移到内质网表面,进一步活化caspase-12,活化的caspase-12剪切caspase-3,而引发细胞凋亡。近年来研究表明,人的caspase-4与小鼠的 caspase-12为同源物,并且可以可特异性被ERS诱导试剂剪切激活,因而,caspase-4可能是人内质网通路途经凋亡相关蛋白[15]。此外,蛋白磷酸酶3催化亚基-α-亚型基因(Cn)也可作用于Bad,引起细胞凋亡。
实验结果中,黄芩苷组(F和G)对与凋亡发生密切相关的差异表达基因Casp4有明显下调;黄芩苷低剂量组(G)还引起Cn的明显下调;这表明黄芩苷在对流感病毒诱导细胞凋亡的干预作用中,还有可能通过内质网通路途径来调控。此外,实验结果中没有涉及Caspase-9的变化,因而黄芩苷可能并未通过线粒体依赖途径发挥拮抗凋亡作用。
综上所述,甲型流感病毒H1N1体外感染人肺腺癌细胞A549后诱导凋亡,黄芩苷能通过调控Caspase-8介导外源性途径和内质网通路途径的凋亡相关基因表达,从而抑制流感病毒感染诱导的细胞凋亡。细胞凋亡涉及众多基因,网络状信号转导调控模式非常复杂,因此,黄芩苷对H1N1感染的细胞凋亡的机制有待深入的实验研究。
| [1] | 卢娜娜, 刘 琪, 顾立刚, 等.流感病毒诱导小鼠肺组织凋亡的相关基因及两种不同中药方药的治疗作用[J].医学研究生学报, 2013, 26 (11):1134-7.Lu N N, Liu Q, Gu L G, et al. Shufengxuanfei and Jiebiaoqingli formulas on cell apoptosis in pneumonia mice infected with influenza virus[J]. J Med Postgra, 2013, 26 (11):1134-7. |
| [2] | 高 雷, 陈鸿珊.黄芩苷体外对流感病毒、单纯疱疹病毒和柯萨奇病毒的抑制作用[J].中国新药杂志, 2007, 17(6):474-8.Gao L, Chen H S. Inhibiting effect of baicalin on influenza, herpes simplex and CoxB3 virus infections in cultured cells[J]. Chin J New Drugs, 2007, 17(6):474-8. |
| [3] | Kong F, Luan Y, Zhang Z H, et al. Baicalin protects the myocardium from reperfusion induced damage in isolated rat hearts via the antioxidant and paracrine effect[J]. Exp Ther Med, 2014, 7(1):254-9. |
| [4] | Lu H F, Hsueh S C, Ho Y T, et al. ROS mediates baicalin induced apoptosis in human promyelocytic leukemia HL-60 cells through the expression of the Gadd153 and mitochondrial-dependent pathway[J]. Anticancer Res, 2007, 27(1A):117-25. |
| [5] | 张密霞, 李 越, 杜 嵘, 等.黄芩苷对体外培养神经干细胞分化的影响[J].天津中医药大学学报, 2007, 12, 26(4):119-201.Zhang M X, Li Y, Du R, et al. Effect of baicalin on differentiation of neural stemcells in vitro[J]. J Tianjin Univ Tradit Chin Med, 2007, 12, 26(4):119-201. |
| [6] | 万巧凤, 顾立刚, 殷胜骏, 等.黄芩苷对FM1肺炎小鼠肺损伤的作用机制研究[J].中国药理学通报, 2012, 28(2):208-12. Wan Q F, Gu L G, Yin S J, et al. Mechanism of Baicalin on lung tissue injury of mice with FM1 induced pneumonia[J]. Chin Pharmacol Bull, 2012, 28(2):208-12. |
| [7] | 万巧凤, 顾立刚, 殷胜骏, 等.黄芩苷对FM1肺炎小鼠肺组织细胞凋亡 FAS/FASL系统的影响[J].中国药理学通报, 2011, 27(11):1555-9. Wan Q F, Gu L G, Yin S J, et al. Effect of Baicalin on cell apoptosis FAS/FAS-L system of pneumonia mice lung tissue infected with FM1[J]. Chin Pharmacol Bull, 2011, 27(11):1555-9. |
| [8] | Pei X D, Zhai Y F, Zhang H H. Influenza virus H1N1 induced apoptosis of mouse astrocytes and the effect on protein expression[J]. Asian Pac J Trop Med, 2014, 7(7):572-5. |
| [9] | Long S, Wilson M, Bengten E, et al. Identification and characterization of a FasL-like protein and cDNAs encoding the channel catfish death-inducing signaling complex[J]. Immunogenetics, 2004, 56:518-30. |
| [10] | Nomura J, Matsumoto K, Iguchi-Ariga S M, Ariga H. Mitochondria-independent induction of Fasmediated apoptosis by MSSP[J]. Oncol Rep, 2005, 14:1305-9. |
| [11] | Porter A G, J nicke R U. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999, 6(2):99-104. |
| [12] | Wurzer W J, Ehrhardt C, Pleschka S, et al. NF-kappaB-dependent induction of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) and Fas/FasL is crucial for efficient influenza virus propagation[J]. J Biol Chem, 2004, 279 (30):30931-7 |
| [13] | 万玉立.甲型流感病毒感染A549细胞的表达谱分析及相关基因功能研究[D]北京:中国医学科学北京协和医学院, 2009. Wan Y L. Influenza A virus infection of A549 cells expression spectrum analysis and related gene function research[D]. Beijing:Chinese Academy of medical science and Peking union medical college, 2009. |
| [14] | Du C, Fang M, Li Y, et al. Smac, a mitochondrial protein that promotes cytochrome c-dependent Caspase activation by eliminating IAP inhibition[J]. Cell, 2000, 102:33-42. |
| [15] | Lakshmanan A P, Thandavarayan R A, Palaniyandi S S, et al. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J]. Eur J Pharm Sci, 2011, 44(5):627-34. |