2. 江苏省中医院消化内科, 江苏 南京 210029
2. Dept of Gastroenterology,Jiangsu Provincial Hospital of Traditional Chinese Medicine,Nanjing 210029,China
溃疡性结肠炎(ulcerative colitis,UC)是一种反复发作的肠道慢性非特异性炎症性疾病,发病机制尚未明确,细胞因子IL-6及其介导的信号通路在非可控性肠道炎症过程中起关键作用[1]。导师沈洪教授所拟清肠化湿方(QHR),治疗轻、中度UC,取得良好效果[2]。课题组前期研究表明该方能调控UC大鼠NF-κB/COX-2通路、PPAR-γ/NF-κB及Toll通路,减少IL-1β、TNF-α等促炎因子分泌,促进抑炎因子IL-10分泌等。本实验在此基础上,以TNF-α、LPS共刺激诱导HT-29细胞炎症模型,观察清肠化湿方对IL-6及其主要信号转导通路之一JAK2/STAT3的影响,进一步探讨其作用机制。
1 材料与方法 1.1 实验材料HT-29,购自中国科学院细胞库。清肠化湿方(黄连、黄芩、煨木香等购自江苏省医药公司,生产批号20121201)。柳氨磺胺吡啶(Sulfasalazine,SASP)、McCoy′s5a培养基、LPS:Sigma公司;胎牛血清(Gibco公司);Recombinant Human TNF-α(Pepro Tech公司)。人IL-6 ELISA试剂盒(EB公司);引物由上海生工合成;Real Time PCR试剂盒(TaKaRa公司);兔抗p-JAK2、p-STAT3单抗(Cell Signaling Technology公司)。酶标仪、电泳仪、转膜仪、Western blot 曝光仪购自美国Bio-Rad公司;Real Time PCR仪(TaKaRa);UVP凝胶成像系统(UVP公司)。
1.2 清肠化湿方水煎剂制备称取清肠化湿方1付,共87 g,煎煮、蒸发、减压浓缩至27 ml母液,4℃保存。
1.3 实验分组取指数生长期HT-29细胞,分为6组:对照组:加入不含FBS的McCoy′s 5a孵育24 h;模型组:根据前期研究[3],予hTNF-α(20 μg·L-1)[4, 5]孵育12 h后,再予LPS(1 mg·L-1)[5, 6]孵育15 h;实验组:根据前期研究[3],在上述药物干预的基础上,分别加入SASP(2 mmol·L-1)、QHR高、中、低剂量(10、1、0.1 mg·L-1)孵育24 h。
1.4 ELISA法检测HT-29细胞上清IL-6水平收集细胞上清液,转移至1.5 mL Eppnedorf管,离心机1 600 r·min-1离心5 min,取上清。按ELISA试剂盒步骤检测IL-6的水平。
1.5 Real Time PCR法检测HT-29细胞JAK2、STAT3 mRNA相对表达水平取HT-29细胞,TRIzol充分裂解,氯仿萃取,异丙醇沉淀,75%乙醇洗涤,溶于DEPC水,-80℃保存。取2μg总 RNA逆转录为cDNA。引物:JAK2:上游5′-GGAATGGCCTGCCTTACAATG-3′;下游5′-TGGCTCTATC TGCTTCACAGAAT-3′;STAT3:上游5′-CACCTTGGATTGAG AGTCAAGAC-3′;下游5′-AGGAATCGGCTATATTGCTGGT-3′;GAPDH:上游5′-AGGTCGGTGTGAACGGATTTG-3′;下游5′-GGGGTCGTTGATGGCAACA-3′。Real-time PCR反应体系:SYBR Premix Ex Taq(2×)12.5 μL,上下游引物各0.5 μL,cDNA模板1 μL,DEPC水9.5 μL。反应条件:95℃预变性2 min,95℃ 5 s,57℃ 30 s,扩增45个循环;95℃ 15 s,60℃ 30 s,95℃ 15 s循环读取溶解曲线,57℃ 30 s读取荧光。结果以CT值表示。
基因表达量以各样基因CT值减去内参基因GAPDH CT值表示,相对表达量以2-ΔΔCt表示。
1.6 Western blot法检测HT-29细胞p-JAK2、p-STAT3 蛋白表达取HT-29细胞,低温提取细胞总蛋白,BCA法测定蛋白浓度,以30 μg质量体积分数上样,分离胶 SDS-PAGE 分离样品,转膜,封闭。按1 ∶ 1 000浓度稀释一抗,4℃摇床振荡孵育过夜,充分洗涤,按1 ∶ 3 000浓度稀释二抗,室温摇床振荡孵育2 h,充分洗涤,加 ECL 显影液。
1.7 统计学分析实验数据采用SPSS 19.0统计软件进行t检验、One way-ANOVA分析,计量资料以 表示。
表示。
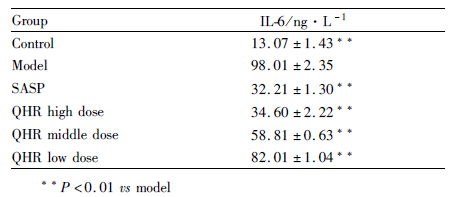
模型组细胞上清IL-6水平较对照组明显升高(P<0.01),QHR各剂量组IL-6的水平较模型组降低(P<0.01),并呈剂量依赖性,QHR高剂量组与SASP组相比差异无统计学意义。见Tab1。
与对照组比较,各组JAK2基因表达差异倍数未见明显差异,各组STAT3基因表达差异倍数未见明显差异。
2.3 HT-29细胞p-JAK2、p-STAT3蛋白表达与对照组相比,模型组p-JAK2表达明显升高(P<0.01),与模型组相比,各药物组明显降低(P<0.01),其中QHR各剂量组呈剂量依赖性。与对照组相比,模型组p-STAT3表达明显升高(P<0.01),与模型组相比,各药物组明显降低(P<0.01),其中QHR各剂量组呈剂量依赖性。见Tab2。
生理状态下,肠上皮细胞持续暴露于肠道共生菌并能维持稳态,在炎性因子如TNF-α等作用下,肠上皮功能破坏,免疫反应失衡,导致UC发病。研究表明,在遗传易感性IBD动物模型中Th1细胞因子和共生菌为诱导慢性炎症所必须[6]。由于体外原代培养结肠上皮细胞的困难,目前,主要使用结肠癌细胞株进行研究。Abreu等[4]研究亦表明,HT-29细胞经TNF-α刺激后可增强对LPS的反应性,LPS信号能激活胞内多条信号通路,促进大量细胞因子和粘附分子等表达,引起瀑布式的炎症级联反应[7]。本实验以前期研究为基础[3],以LPS与TNF-α联合诱导HT-29细胞炎症,结果上清中IL-6水平明显增高,与Jeong等[5]报道一致。IL-6是一种多向性细胞因子,由活化的巨噬细胞、淋巴细胞及上皮细胞分泌,能刺激巨噬细胞或单核细胞、淋巴细胞等合成前列腺素、细胞因子、血小板激活因子等炎性介质。IL-6 与受体结合后优先激活JAK和STAT3,STAT3经磷酸化活化入核,调控下游靶基因转录,参与调节炎症。IBD患者及一些动物结肠炎或肠炎模型中,皆观察到升高的IL-6 [8],高水平磷酸化的STAT3与疾病严重程度相关[9]。本实验表明清肠化湿方能降低LPS与TNF-α诱导的HT-29细胞IL-6的分泌,下调p-JAK2、p-STAT3水平,对JAK2、STAT3 mRNA表达水平无明显影响,表明清肠化湿方能抑制LPS与TNF-α诱导的HT-29细胞JAK2、STAT3的活化。清肠化湿方通过降低IL-6表达,抑制JAK2、STAT3活化,阻断炎症的发展和持续,可能是其治疗UC作用机制之一。
| [1] | Atreya R, Neurath M F.Involvement of IL-6 in the pathogenesis of inflammatory bowel disease and colon cancer[J]. Clin Rev Allergy Immunol, 2005, 28(3):187-96. |
| [2] | 沈洪, 张声生, 王垂杰, 等.中药分期序贯治疗轻中度溃疡性结肠炎临床观察[J]. 中华中医药杂志, 2012, 27(7):1788-91. Shen H, Zhang S S, Wang C J, et al.Clinical observation of sequential stages of Chinese medicine treatment on mild to moderate ulcerative colitis[J]. China J Tradit Chin Med Pharmacy, 2012, 27(7):1788-91. |
| [3] | 沈洪, 刘智群, 朱荃, 等.清肠化湿方对溃疡性结肠炎NF-κB/Tolls通路的影响及其机制[J]. 中国中西医结合杂志, 2013, 33(9):1216-20. Shen H, Liu Z Q, Zhu Q, et al.Effect of Qingchang Huashi Recipe on NF-κB/Tolls pathway in ulcerative colitis patients and mechanism study[J]. Chin J Integr Med, 2013, 33(9):1216-20. |
| [4] | Abreu M T, Arnold E T, Thomas L S, et al.TLR4 and MD-2 expression is regulated by immune-mediated signals in human iniestinal epithelial cells[J]. J Biol Chem, 2002, 277(23):20431-7. |
| [5] | Jeong J B, Shin Y K, Lee S H, et al.Anti-inflammatory activity of patchouli alcohol in RAW264.7 and HT-29 cells[J]. Food Chem Toxicol, 2013, 55:229-33. |
| [6] | French N, Pettersson, S.Microbe-host interactions in the alimentary tract:the gateway to understanding inflammatory bowel disease[J]. Gut, 2000, 47(2):162-3. |
| [7] | Herzum I, Renz H.Inflammatory markers in SIRS, sepsis and septic shock[J]. Curr Med Chem, 2008, 15(6):581-7. |
| [8] | 孙阿宁, 任改艳, 邓超, 等.牡荆素减轻小鼠溃疡性结肠炎的药效作用及机制研究[J]. 中国药理学通报, 2014, 30(12):1677-81. Sun A N, Ren G Y, Deng C, et al.Pharmacodynamic action and mechanism of Vitexin on experimental ulcerative colitis in mice[J]. Chin Pharmacol Bull, 2014, 30(12):1677-81. |
| [9] | Suzuki A, Hanada T, Mitsuyama K, et al.CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation[J]. J Exp Med, 2001, 193(4):471-81. |