


2. 福建医科大学省立临床学院药学部, 福建 福州 350001;
3. 皖南医学院弋矶山医院临床药学部, 安徽省药物临床评价中心, 安徽 芜湖 241001
 , XIE Hai-tang3, SUN Hong1, 2, ZENG Ying1, ZHU Qiong-ni1, LI Tai-lin1, WANG Guo1
, XIE Hai-tang3, SUN Hong1, 2, ZENG Ying1, ZHU Qiong-ni1, LI Tai-lin1, WANG Guo1
 , ZHU Yuan-shan1
, ZHU Yuan-shan1 2. Dept of Pharmacy, Provincial Clinical College of Fujian Medical University, Fujian Provincial Hospital, Fuzhou 350001, China;
3. Institute of Clinical Pharmacy and Pharmacology, Yijishan Hospital of Wannan Medical College, Wuhu Anhui 241001, China
长链非编码RNA(long non-coding RNA,lncRNA)定义为一类长度大于200nt、但不编码产生蛋白质的RNA转录产物[1, 2],研究表明lncRNA与多种类型的肿瘤发生发展有着密切联系,已成为近年来的研究热点之一[3]。人lncRNA基因H19位于人染色体11p15.5,全长2.3kb,是最先被报道的lncRNA基因之一[4]。同时该基因为最早发现的印记基因之一,其父系基因印记,母系基因表达。H19基因进化上高度保守,胚胎发育期高表达,婴儿出生后在大多数组织表达下调,仅在骨骼肌和心肌中有少量表达[5, 6, 7]。近年研究表明,H19与肿瘤具有密切关联,在不同的癌症中作用不一致,在某些肿瘤中表现为促进肿瘤发展,但在另外一些肿瘤中则表现为抑癌基因功能。在大多数肿瘤中,例如乳腺癌、膀胱癌、食道癌、胃癌、肝癌和转移肝癌中H19高表达,表现为促进肿瘤的生长[8, 9, 10, 11, 12, 13];而在结直肠癌和胚胎性肿瘤细胞株中H19的表达抑制了肿瘤生长[13, 14, 15]。近期研究表明,H19基因的表达还可能与肿瘤化疗耐药的调控机制相关,例如在多柔比星耐药的肝癌HepG2细胞中,H19表达上调,并通过降低MDR1基因启动子甲基化水平从而上调p-糖蛋白表达而产生多药耐药[16]。为进一步探讨H19表达对乳腺癌的发生、发展以及多柔比星化疗耐药的作用,本文克隆了该基因并构建了H19真核表达载体,并转染MCF-7细胞,过表达和干扰H19,探讨H19表达增加和降低对MCF-7细胞增殖的影响。本文的工作为我们后续研究H19在乳腺癌发生,发展以及化疗耐药过程中的作用和分子机制奠定了实验基础。
1 材料与方法 1.1 材料 1.1.1 实验细胞及主要试剂MCF-7、HEK-293T和COS 7细胞系均为本研究所冻存;限制性内切酶Bam HⅠ、HindⅢ、BbvcⅠ及T4连接酶购自NEB公司;总RNA提取试剂盒和无内毒素质粒提取试剂盒购自Omega公司;胶纯化回收试剂盒、pGEM-T easy载体和MTS试剂购自Promega公司;胎牛血清购自Hyclone公司;RPMI 1640(高糖)、DMEM(高糖)、胰酶、OPTI-MEM、DPBS和脂质体LipofectamineTM 2000购自Life Technologies公司;LA Taq DNA聚合酶、GC Buffer、DNA分子量标准品、逆转录试剂盒、Real-time qPCR试剂盒购自TaKaRa公司;DH5α超级感受态细菌购自北京全式金公司;无水乙醇、氯仿等有机试剂均为国产分析纯;pcDNA3.1(-)空载体由本研究所屈健博士提供;siRNA H19小分子片段由广州锐博公司合成。引物由上海博尚生物技术有限公司合成。
1.1.2 主要仪器PCR仪为Eppendorf公司产品;凝胶电泳仪及成像系统为Bio-Rad公司产品;Real-time qPCR仪为Roche公司产品;微量分光光度计为NanoDrop公司产品;荧光倒置显微镜为Nikon公司产品。
1.2 方法 1.2.1 细胞培养HEK-293T细胞和COS 7细胞培养基为含10%胎牛血清的DMEM高糖培养基,MCF-7细胞培养基为含10%胎牛血清的RPMI 1640高糖培养基,3株细胞的培养条件均为37℃,5%CO2。
1.2.2 hH19基因全长序列克隆根据Gen Bank数据库hH19标准序列NR_002196.1设计引物,因该RNA序列长2.3kb,故进行分段克隆。在上下游片段正向扩增引物中均引入BamH Ⅰ切点,在下游片段反向引物中均引入Hind Ⅲ切点,引物序列及说明见Tab 1。试剂盒制备MCF-7细胞总RNA,取1 μg总RNA用随机引物行逆转录。50 μL PCR体系:上下游引物(10 μmol·L-1)各2 μL,2×GC Buffer 25 μL,dNTPs(2.5 mmol·L-1 each)8 μL,LA Taq DNA聚合酶 0.5 μL,逆转录产物2 μL,ddH2O 补足50 μL。循环条件:94℃预变性1 min;94℃变性30s,60℃退火30 s,72℃ 延伸2 min,30个循环;72℃ 终末延伸5 min;产物保存于4℃。1%琼脂糖凝胶电泳分离扩增产物并行纯化回收,产物连入pGEM-T easy载体,转化DH5α超级感受态细胞,行蓝白斑筛选,挑取白色克隆,经T7和SP6通用引物对PCR鉴定后,制备插入片段阳性克隆质粒,进行测序验证。
| Prime Name | Oligonucleotide Sequence(5′-3′) | Length/bp | Application |
| F1 | AAAAGGATCCAGGGCCCTGCTCTGATTGG | 1417 | amplifying the H19 upstream fragment,BamH Ⅰ and Hind Ⅲ restriction sites are indicated in bold |
| R1 | AAAAAAGCTTCCTCGTCTCCAGCCCGAAC | ||
| F2 | GGGCGGGGCGGAGTGAATGAGC | 1162 | amplifying the H19 downstream fragment,BamH Ⅰ and Hind Ⅲ restriction sites are indicated in bold |
| R2 | AAAAAAGCTTTTGCTGTAACAGTGTTTATTGATGA | ||
| F3 | GTCCGGCCTTCCTGAACACCTT | 257 | Real-time qPCR prime,detecting H19 |
| R3 | GCTTCACCTTCCAGAGCCGAT | ||
| F4 | TTGATTTTGGAGGGATCTCGCTC | 238 | Real-time qPCR primes,detecting GAPDH |
| R4 | GAGTCAACGGATTTGGTCGTATTG |
BamH Ⅰ+Hind Ⅲ消化测序验证正确的hH19上游片段-T easy质粒以及pcDNA3.1(-)载体,分别纯化回收目的片段。连接线性化载体和hH19上游片段,转化DH5α感受态细胞,T7和BGH通用引物对行菌液PCR鉴定,得到插入片段阳性克隆,命名为hH19上游片段-pcDNA 3.1(-)。BbvC Ⅰ+Hind Ⅲ消化H19上游片段-pcDNA 3.1(-)质粒和hH19下游片段-T easy质粒,连接线性化表达载体和H19下游片段,转化感受态细胞,挑克隆,双酶切鉴定,得到包含完整,正确hH19基因序列的hH19-pcDNA3.1(-)表达载体。用无内毒素试剂盒大量制备质粒。
1.2.4 hH19表达载体瞬转HEK-293T和COS-7细胞及qPCR检测HEK-293T和COS-7细胞分别消化成单细胞悬液,2×105细胞接种1个6孔板孔。按照LipofectamineTM 2000试剂盒说明书进行转染操作,hH19表达载体质粒用量为4.0 μg,LipofectamineTM 2000用量为10 μL,并设置只加等量转染试剂组和pcDNA3.1(-)空载体组作为对照。各组细胞转染24 h后提取总RNA,随机引物行逆转录。Real-time qPCR检测hH19表达,GAPDH为内对照。20 μL qPCR体系:2×SYBR Premix Dimer Eraser 10 μL,上下游引物(10 μmol·L-1) 各0.6 μL,cDNA 2 μL,ddH2O补足20 μL。循环参数:95℃,30 s;95℃,5 s,55℃,30 s,72℃,30 s,40次循环;最后65℃,15 s以及溶解曲线检测。细胞瞬转与H19表达检测实验重复3次。
1.2.5 过表达H19对MCF-7细胞增殖的影响以及qPCR检测H19 mRNA表达MCF-7细胞以1×104细胞接种于1个96孔板孔,待细胞贴壁后转染hH19-pcDNA3.1(-)载体至细胞,并设置pcDNA3.1(-)空载体组和转染试剂组作为对照,转染0、24、48 h后,吸除孔内培养基,每孔加入含有MTS试剂的培养基40 μL,37℃培养30 min后检测每孔吸光度。MCF-7细胞以2×105细胞接种于1个6孔板孔,待细胞贴壁后转染hH19-pcDNA3.1(-)载体至细胞,并设置pcDNA3.1(-)空载体组作为对照,转染24、48 h后提取总RNA,随机引物行逆转录。Real-time qPCR检测hH19表达,GAPDH为内对照。细胞转染、MTS检测和qPCR检测实验重复3次,每次重复时每组设置3个复孔。
1.2.6 siRNA H19小分子片段干扰H19表达后对MCF-7细胞增殖的影响以及qPCR检测H19 mRNA表达MCF-7细胞以1×104细胞接种于1个96孔板孔,待细胞贴壁后转染siRNA H19小分子片段至细胞,并设置siRNA H19反义链和1条无意义的小分子片段作为对照,转染24 h后,吸除孔内培养基,每孔加入含有MTS试剂的培养基40 μL,37℃培养30min后检测每孔吸光度。MCF-7细胞以2×105细胞接种于1个6孔板孔,待细胞贴壁后转染siRNA H19小分子片段至细胞,并设置siRNA H19反义链和1条无意义的小分子片段作为对照,转染24 h后提取总RNA,随机引物行逆转录。Real-time qPCR检测hH19表达,GAPDH为内对照。细胞转染、MTS检测和qPCR检测实验重复3次,每次重复时每组设置3个复孔。
1.3 统计学分析 本文以及图表中的数据均以 表示,采用GraphPad Prism 5统计学软件进行one-way ANOVA分析。
表示,采用GraphPad Prism 5统计学软件进行one-way ANOVA分析。
以cDNA为模板,分别用引物对F1/R1和F2/R2 扩增,得到与预期片段大小相符的特异性片段(Fig 1A)。切胶纯化回收目的片段,并与pGEM-T easy载体连接,插入阳性的重组质粒 H19上游片段-pGEM-T easy和H19下游片段-pGEM-T easy经酶切鉴定正确(Fig 1B)。测序结果显示,载体中H19基因上游片段扩增长1417 bp、下游片段扩增长1162 bp与已知的NCBI基因库中人H19(NR_002196.1)序列一致。
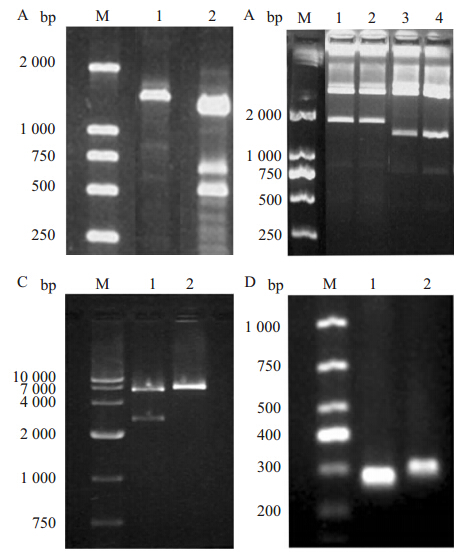
|
| Fig 1 Agarose gel electrophoresis pictures of H19 expression vector construction A: Cloning of H19 gene by PCR and agarose gel electrophoresis result. M—DNA maker; 1—PCR product of H19 up gene; 2—PCR product of H19 down gene. B: Restriction analysis of pGEM-T easy-H19 up and pGEM-T easy-H19 down and agarose gel electrophoresis result. M—DNA maker; 1,2—Digestion of pGEM-T easy-H19 up by BamH I+Hind III; 3,4—Digestion of pGEM-T easy-H19 down by BamH I+Hind III. C: Restriction analysis of pcDNA3.1(-)-H19 and agarose gel electrophoresis result. M—DNA maker; 2—Digestion of pcDNA3.1(-)-H19 by BamH I+Hind III; 3—Digestion of pcDNA3.1(-)by BamH I+Hind III. D: Identification of real-time PCR specificity primer for GAPDH gene by PCR and agarose gel electrophoresis result. 1—DNA maker; 2—Real time PCR specificity primer for GAPDH gene. |
H19上游片段-pGEM-T easy经BamH Ⅰ+Hind Ⅲ双酶切,与同样双酶切线性化的pcDNA3.1(-)载体连接,得到的表达载体H19上游片段-pcDNA3.1(-)载体;再将H19下游片段-pGEM-T easy载体和H19上游片段-pcDNA3.1(-)载体分别行经BbvC Ⅰ+Hind Ⅲ双酶切后连接,从而将H19下游片段插入至H19上游片段-pcDNA3.1(-)载体中,得到完整的hH19-pcDNA3.1(-)表达载体。经BamH Ⅰ+Hind Ⅲ双酶切鉴定(Fig 1C)和测序鉴定,确认载体构建成功。
2.3 Real-time qPCR检测转染后HEK-293T细胞和COS-7细胞中H19基因表达利用阳离子脂质体将hH19-pcDNA3.1(-)表达载体和对照组pcDNA3.1(-)空载体分别转染至HEK-293T细胞和COS-7细胞。转染24 h后,行Real-time qPCR检测各组中H19表达,HEK-293T细胞和COS-7细胞转染组的H19表达水平相对未转染组分别提高352和820倍(Fig 2A)。qPCR产物经电泳检测显示产物条带特异,片段大小与预期结果相符,产物特异(Fig 1D),进一步测序结果确认为qPCR扩增产物为H19基因片段。证明所构建的H19表达载体转染真核细胞内后可正常表达。
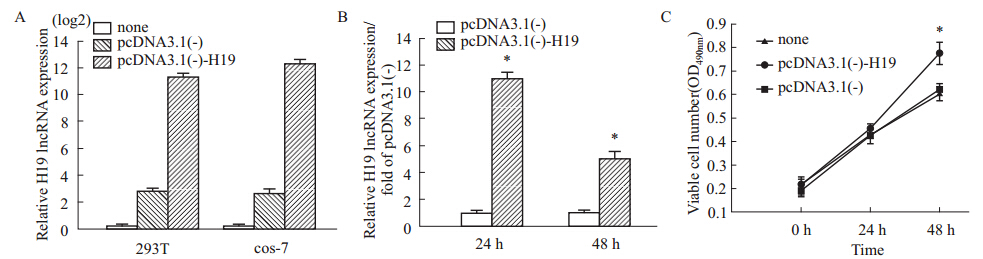
|
| Fig 2 Results of H19 expression vector transfected into cells A: Relative expression level of H19 mRNA in HEK-293T and COS-7 transfected with recombinant plasmid pcDNA3.1(-)-H19. none —transfected cells; pcDNA3.1(-)—transfected with empty plasmid; pcDNA3.1(-)-H19—transfected with expression vector plasmid pcDNA3.1(-)-H19. B: Relative expression level of H19 mRNA in MCF-7 transfected with recombinant plasmid pcDNA3.1(-)-H19. *P<0.05 vs pcDNA3.1(-); C: The influence on the proliferation of H19 expression vector plasmid transfected into MCF-7.*P<0.05 vs pcDNA3.1(-). |
转染H19表达载体到MCF-7细胞,24和48 h后qPCR均能检测到高表达的H19 mRNA,且差异有统计学意义(Fig 2B)。但H19过表达24 h后对细胞增殖的影响差异无统计学意义,而到48 h后对细胞增殖的影响差异有统计学意义,实验结果表明,H19可以促进MCF-7细胞的增殖(Fig 2C)。
2.5 siRNA 小分子片段干扰H19基因对MCF-7细胞增殖的影响转染H19 siRNA小分子干扰片段到MCF-7细胞,24 h后qPCR检测到H19被干扰70%左右,差异具有统计学意义(Fig 3A)。H19干扰24 h后观察到能够抑制细胞增殖且差异具有统计学意义,实验结果表明,干扰H19可以抑制MCF-7细胞的增殖(Fig 3B)。
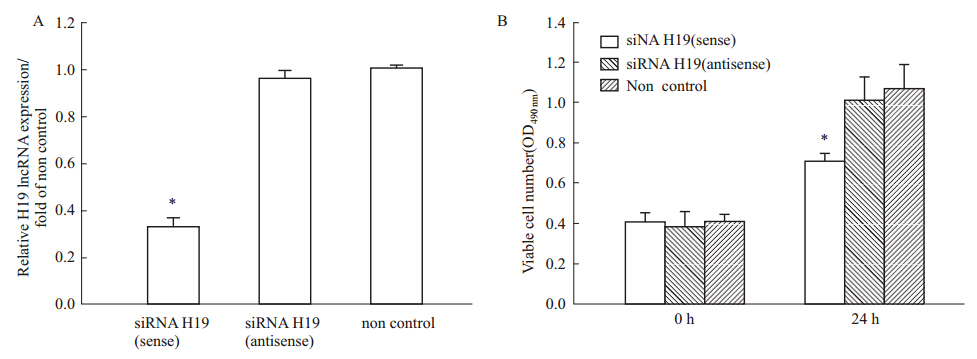
|
| Fig 3 Results of H19 siRNA interference fragment transfected into cells A: Relative expression level of H19 mRNA in MCF-7 transfected with H19 siRNA interference fragment. Non control—cells without H19 oligonucleotides transfection; siRNA H19 (sense)—sense H19 oligonucleotides transfection; siRNA H19 (antisense) —antisense H19 oligonucleotides transfection. *P<0.05 vs siRNA H19(antisense) and non control; B: The influence on the proliferation of H19 siRNA interference fragment transfected into MCF-7. *P<0.05 vs siRNA H19(antisense) and non control. |
近年来的研究表明,H19与肿瘤的发生发展及转移有着密切的联系,如:在肺癌和肝癌中发现H19和Slug相互作用促使肿瘤细胞由上皮细胞向间质细胞转移,从而增加其侵袭能力[17];在卵巢癌中,敲除H19能够使其癌细胞生长速度减慢[18] ;而在胃癌细胞和胃癌组织中,H19的表达都明显增加,有学者认为H19的上调促使细胞增殖同时伴随着部分p53的失活[19],另外有学者也认为H19能直接上调ISM1或者通过miR-675抑制CALN1的表达来促使胃癌的增殖、迁移、侵袭和转移[20]。另外在肝癌细胞、肺癌细胞和乳腺癌耐药细胞(MCF-7/AdrVp)中相对于其亲本细胞均检测到了高表达的H19,表明H19与肿瘤细胞多药耐药密切相关[21]。
为了能更深入的探讨H19基因与肿瘤细胞的关系,本实验克隆了H19基因,并构建了H19的真核表达载体,用脂质体介导转染入HEK-239T细胞和COS-7细胞,发现在HEK-293T细胞和COS-7细胞中H19基因的表达极低,转染后表达量分别升高352和820倍(与转染的空载体相比较),能够满足进一步的实验需要。然后在肿瘤细胞MCF-7细胞过表达和干扰H19的表达,发现过表达H19后能够促进肿瘤细胞MCF-7细胞的增殖,而干扰H19的表达则抑制其增殖。我们发现转染H19表达载体24 h后就检测到了H19上调并且比48 h上调得多,但是24 h对细胞的增殖影响不明显,而48 h后能明显促进细胞增殖,且具有统计学意义。初步推测H19可能不是直接影响细胞增殖,而是通过调控其下游的元件来影响细胞增殖,而这种影响存在时间差异,因此我们在H19过表达24 h后即检测到了其上调,但48 h才观察到了明显的细胞增殖。而siRNA小片段干扰,在24 h就检测到了H19表达下调并且明显抑制细胞的增殖,初步推断siRNA小片段干扰的效率高,不到24 h就干扰了H19从而调控下游元件抑制细胞增殖。而且H19干扰后能抑制细胞增殖,干扰时间太长,细胞都死亡,因此我们实验中只做了24 h的时间点。
综上所述,本文成功的克隆了H19基因,构建了H19的真核表达载体,高效转染HEK-293T细胞和COS-7细胞并检测到H19基因的表达。同时转染入MCF-7细胞中发现H19能够促进细胞的增殖,而干扰H19能抑制细胞增殖,为下一步探讨H19对乳腺癌的影响提供思路和奠定基础。
| [1] | Gibb E A, Brown C J, Lam W L. The functional role of long non-coding RNA in human carcinomas[J]. Mol Cancer, 2011, 10(1):38-44. |
| [2] | Lipovich L, Johnson R, Lin C Y. MacroRNA underdogs in a microRNA world:evolutionary, regulatory, and biomedical significance of mammalian long non-protein-coding RNA[J]. Biochim Biophys Acta, 2010, 1799(9):597-15. |
| [3] | Huarte M, Rinn J L. Large non-coding RNAs:missing links in cancer[J]. Hum Mol Genet, 2010, 19(R2):R152-61. |
| [4] | Brannan C I, Dees E C, Ingram R S,Tilghman S M. The product of the H19 gene may function as an RNA[J]. Mol Cell Biol, 1990, 10(1):28-36. |
| [5] | Castle J C, Armour C D, Löwer M, et al. Digital genome-wide ncRNA expression, including SnoRNAs, across 11 human tissues using polyA-neutral amplification[J]. PLoS One, 2010, 5(7):1779-87. |
| [6] | Poirier F, Chan C T, Tinmons P M, et al. The murine H19 gene is activated during embryonic stem cell differentiation in vitro and at the time of implantation in the developing embryo[J]. Development, 1991, 113(4):1105-14. |
| [7] | Lustig O, Ariel I, Ilan J, et al. Expression of the imprinted gene H19 in the human fetus[J]. Mol Reprod Dev, 1994, 38(3):239-46. |
| [8] | Song H, Sun W, Ye G, et al. Long non-coding RNA expression profile in human gastric cancer and its clinical significances[J]. J Transl Med, 2013, 11:225-35. |
| [9] | Hibi K, Nakamura H, Hirai A, et al. Loss of H19 imprinting in esophageal cancer[J]. Cancer Res, 1996, 56(3):480-2. |
| [10] | Fellig Y, Ariel I, Ohana P, et al. H19 expression in hepatic metastases from a range of human carcinomas[J]. J Clin Pathol, 2005, 58(10):1064-8. |
| [11] | Matouk I J, DeGroot N, Mezan S, et al. The H19 non-coding RNA is essential for human tumor growth[J]. PLoS One, 2007, 2(9):845-60. |
| [12] | Berteaux N, Lottin S, MontéD, et al. H19 mRNA-like noncoding RNA promotes breast cancer cell proliferation through positive control by E2F1[J]. J Biol Chem, 2005, 280(33):29625-36. |
| [13] | Yoshimizu T, Miroqlio A, Ripoche M A, et al. The H19 locus acts in vivo as a tumor suppressor[J]. Proc Natl Acad Sci USA, 2008, 105(34):12417-22. |
| [14] | Hao Y, Crenshaw T, Moulton T, et al. Tumour-suppressor activity of H19 RNA[J]. Nature, 1993, 365(6448):764-7. |
| [15] | Colnot S, Niwa-Kawakita M, Hamard G, et al. Colorectal cancers in a new mouse model of familial adenomatous polyposis:influence of genetic and environmental modifiers[J]. Lab Invest, 2004, 84(12):1619-30. |
| [16] | Tsang W P,Kwok T T. Riboregulator H19 induction of MDR1-associated drug resistance in human hepatocellular carcinoma cells[J].Oncogene, 2007, 26(33):4877-81. |
| [17] | Matouk I J, Raveh E, Abu-lail R, et al. Oncofetal H19 RNA promotes tumor metastasis[J]. Biochim Biophys Acta, 2014, 1843(7):1414-26. |
| [18] | Medrzycki M.Histone H1.3 suppresses H19 noncoding RNA expression and cell growth of ovarian cancer cells[J]. Cancer Res, 2014, 74(20):1158-93. |
| [19] | Yang F, Bi J, Xue X, et al. Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J]. FEBS J, 2012, 279(17):3159-65. |
| [20] | Li H, Yu B, Li J, et al. Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J]. Oncotarget, 2014, 5(8):2318-29. |
| [21] | Doyle L A, Yang W, Rishi A K, et al. H19 gene overexpression in atypical multidrug-resistant cells associated with expression of a 95-kilodalton membrane glycoprotein[J]. Cancer Res, 1996, 56(13):2904-7. |