2. 重庆市中山医院, 重庆 400015;
3. 重庆市三峡医学高等专科学校, 重庆 404100
2. Chongqing Zhongshan Hospital, Chongqing 400015, China;
3. Chongqing Three Gorges Medical College, Chongqing 404100, China
研究的深入,进一步发现氧化/抗氧化应激损伤、下丘脑-垂体-肾上腺轴(hypothalamic- pituitary-adrenal axis,HPA)功能失调、神经营养因子减少及炎症反应等都参与了抑郁症的发生[1,2,3]。其中,“单胺学说”是目前抑郁症发病机制最重要的假说之一。该学说认为突触间隙的5-羟色胺(serotonin,5-HT)及去甲肾上腺素(norepinephrine,NE)水平低下是导致抑郁症的重要原因[1]。单胺神经递质发挥作用需经历递质合成、转运、代谢过程。通过阻止神经末梢对递质再摄取或抑制递质降解而研发出一系列临床行之有效的经典抗抑郁药物,如选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)和单胺氧化酶抑制剂等。但即便如此,作为临床广泛使用的SSRI等治疗抑郁症通常需要几周才能完全发挥作用,并且约有60%~70%的病人治疗无效[4],其原因尚不明确。有报道认为,大脑单胺递质缺乏的小鼠对SSRI治疗无应答[5]。因此,增加突触间隙单胺递质浓度是否可以通过增加递质合成达到抗抑郁治疗值得考虑。TPH和TH分别是合成5-HT以及儿茶酚胺神经递质(去甲肾上腺素、肾上腺素、多巴胺)的限速酶。有研究发现,TPH基因多态性与抑郁症关系密切,并提出将TPH作为抗抑郁治疗的新靶点[6]。抑制TH活性可产生抑郁样行为,增加大脑TH水平可用于治疗抑郁症[7]。因此,本文从单胺递质的合成出发,采用CUS诱导大鼠产生抑郁行为,观察5-HT和NE的合成限速酶表达是否参与了抑郁症的发病机制。
1 材料与方法 1.1 动物清洁级♂Sprague-Dawley(SD)大鼠30只,180~220 g,重庆医科大学动物实验中心提供,医学动物许可证号:SCXK(渝)2007-0001。
1.2 主要试剂与仪器PCR引物(上海鼎安生物技术有限公司);RNA提取试剂盒Total RNA Kit I(OMEGA公司);PrimeScriptTM RT reagent Kit(TaKaRa公司,大连宝生物);逆转录试剂盒(TaKaRa公司,大连宝生物);anti-TH、anti-TPH(美国Millipore公司);WB山羊抗兔IgG二抗(北京中杉);ECL发光液:Super Signal Western Blotting Kits(Pierce公司);实时定量PCR仪:美国Bio-rad公司(型号:MJ7500);凝胶成像系统:Bio-rad公司(型号:170-1870);WB垂直电泳仪:美国Bio-rad公司;低温离心机(Eppendoff)。
1.3 分组及饲养大鼠自由摄食饮水,正常光照节律。在室温(20±3)℃实验环境下适应性喂养7 d后,采用open field法筛选大鼠,选取水平活动得分30~120之间的大鼠随机分为2组,即对照组(CG)和模型组(MG),每组15只;CG组5只/笼,MG组每只大鼠单笼喂养。
1.4 孤养结合CUS方法建立大鼠抑郁模型参照Willner等[8]方法并加以改进,建立实验性大鼠抑郁模型。刺激方式包括禁食禁水24 h,夹尾1 min,间歇照明(光/暗周期为2 h/2 h,时间19 ∶ 00 ~次日7 ∶ 00),通宵(12 h)照明,倾斜鼠笼45°结合禁水24 h,45 ℃热环境5 min,4 ℃冰水游泳5 min,电刺激(36 V,4 Hz)5 min,噪音1 h,空盒无垫料结合禁食24 h,潮湿垫料24 h,共11种刺激,大鼠每天接受一种刺激,每种刺激累计出现2 ~3次,同种刺激不连续出现,使动物不能预料何种刺激会发生,实验周期为28 d。
1.5 开场实验模型建立后,于d 2早上7 ∶ 30进行开场实验。参考文献[9],使用自制100 cm×100 cm×40 cm木箱,底部平均分为5×5个方格,木箱内全部漆成黑色。保持环境安静,将大鼠置于木箱中央,观察大鼠5 min内活动情况,记录大鼠的水平得分(四爪均进入方格的穿越格数)、垂直得分(后肢直立次数)。观察完毕后,酒精清洁敞箱后再进行下一次观察,以免受上次大鼠遗留气味的影响。
1.6 糖水消耗实验参照文献,在模型建立d 26,先训练大鼠试饮10 g·L-1蔗糖水24 h,d 27饮纯水24 h,训练期间正常进食。训练结束后开始正式实验:禁食禁水24 h后,所有大鼠单笼放置,同时给予10 g·L-1蔗糖水和纯水各1瓶,实验前称取带水瓶重。2 h后,再次称量带水瓶重并记算蔗糖水和纯水消耗量,最终计算糖水偏好率(糖水偏好率/%=糖水消耗/总液体消耗×100 %)。
1.7 TPH、TH mRNA表达测定造模结束,每组取5只大鼠,经40 g·L-1水合氯醛(400 mg·kg-1,ip)麻醉后断头取脑组织,冰上分离前脑皮层和海马,置于装有RNAstore组织保存液(每100 mg组织加入1 mlRNAstore)EP管。4℃过夜,移出液体,组织于-80℃保存。TH引物:上游5′-AGAGGACAGCATCCCACAGC-3′,下游5′-ATCACGGGCGGACAGTAGA-3′;TPH引物:上游5′-TTTGTAGCCAACATTCCTCA-3′,下游5′-ACTATTGAAAGTAGAAACCACCTC-3′;β-actin作内参。扩增产物大小分别为100 bp,132 bp和100 bp。以TRIzol法按试剂盒说明书提取样本总RNA,用TIANGEN试剂盒进行逆转录。荧光定量聚合酶链反应参见试剂盒说明书:1 μL DNA样本作为 PCR 扩增模板,阴性对照扩增模板为去离子水;扩增条件为95 ℃预变性2 min; 随后95 ℃ 10 s,退火15 s,72 ℃ 延伸45s,共40个循环;最后72 ℃延伸10 min。本试验采用⊿⊿CT法进行实时定量PCR相对定量反应,样本均采用的三复管。取平均值作为最终试验结果,然后与内参进行比较,计算相对含量。
1.8 TPH、TH蛋白表达测定按“1.7”方法处理大鼠,冰上分离出前脑皮层和海马,剪碎组织,加裂解液处理,提取蛋白,采用BCA法定量蛋白浓度。采用Western blot 方法检测两脑区TH和TPH蛋白表达。每孔上样量为50 μg,进行SDS-PAGE凝胶电泳,转膜,室温封闭1 h,加入一抗4℃过夜、洗膜,加入二抗,室温封闭30 min后洗膜,凝胶成像系统取像,以β-actin蛋白做为内参校正蛋白表达量。
1.9 统计学分析实验数据以x±s表示,采用Graph Pad Prism 5统计软件 (Graph Pad Software,San Diego,CA,USA)进行单因素方差分析(one-way ANOVA)。
2 结果 2.1 大鼠行为变化开场实验结果显示,与CG组相比,CUS致大鼠(MG组)水平得分和垂直得分均明显降低(P<0.01,P<0.05),见Fig 1。糖水实验结果显示,MG组大鼠糖水消耗量明显低于CG组(P<0.05),见Tab 1,提示CUS成功诱导大鼠产生焦虑、兴趣缺失等抑郁样行为。

|
| Fig 1 Effect of CUS on scores of rat in open-field test (x±s,n=5) *P<0.05,**P<0.01 vs CG |
| Group | Sucrose preference/% | ||
| *P<0.05 vs CG | |||
| CG | 71.3±24.9 | ||
| MG | 33.4±34.6* | ||
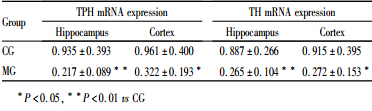
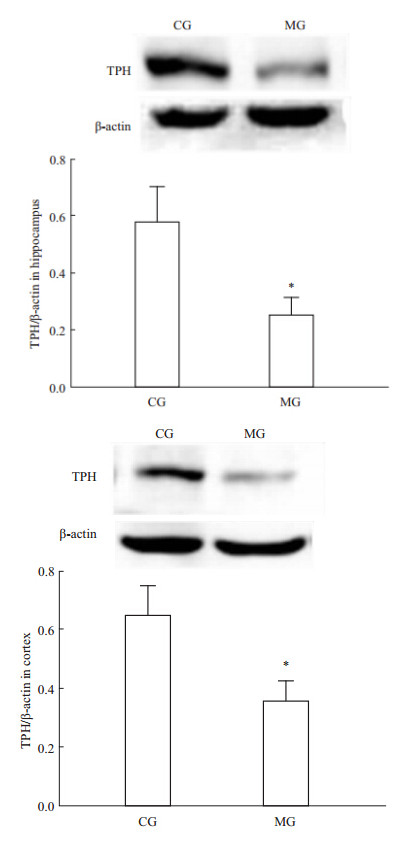
与CG组比,MG组大鼠海马和前脑皮层TPH mRNA表达量明显降低(海马P<0.01,皮层P<0.05),见Tab 2,同时MG组海马和前脑皮层TPH蛋白表达也明显下降(P<0.05),见Fig 2。提示CUS诱导大鼠产生抑郁行为时,使海马和前脑皮层5-HT合成限速酶表达量明显降低。
|
| Fig 2 Effect of CUS on TPH protein expression in rat brain (x±s,n=5) *P<0.05 vs CG |
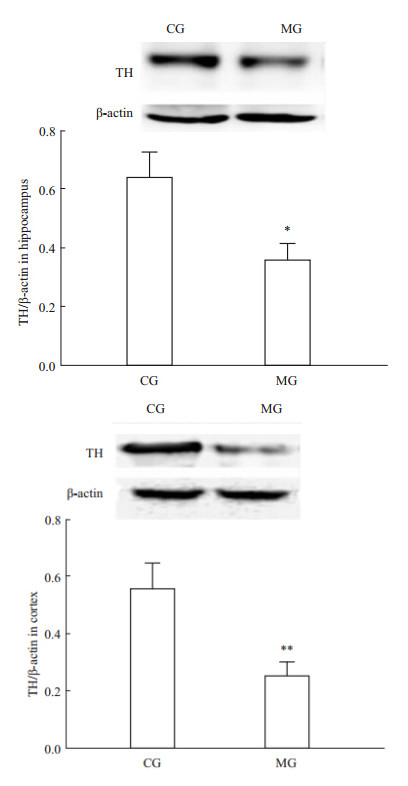
与CG组相比,MG组大鼠海马和前脑皮层TH mRNA表达量明显降低(海马P<0.01,皮层P<0.05),见Tab 2,同时MG组海马和前脑皮层TH蛋白表达也明显下降(海马P<0.05,皮层P<0.01),见Fig 3,结合TPH表达结果,显示CUS能明显抑制大鼠单胺合成限速酶TPH和TH的表达。
|
| Fig 3 Effect of CUS on TH protein expression in rat brain (x±s,n=5) *P<0.05,**P<0.01 vs CG |
CUS是目前经典、常用的实验鼠抑郁模型建立方法。其主要原理是模拟人类抑郁症形成中受到的不同慢性低水平的应激源刺激。开场实验和糖水消耗实验可分别测定实验动物焦虑抑郁行为和是否存在快感缺失。为此本课题组以CUS诱导建立大鼠抑郁模型,对脑内单胺递质合成、再摄取和代谢进行了系列研究。前期工作发现,CUS诱导的抑郁模型 鼠存在转运体表达异常,文拉法辛和瑞波西汀能逆转这种表达异常而改善大鼠抑郁症状[9,10]。然而,针对临床使用SSRI等抗抑郁药物的低治愈率使得人们有理由考虑,抑郁症发生机制是否也与单胺递质合成酶表达异常有关。为此,采用经典的CUS结合孤养方法建立大鼠抑郁症模型是探讨抑郁行为与单胺递质合成酶表达关系的最简洁明了的途径。
本研究结果显示,经CUS刺激的大鼠开场实验水平得分和垂直得分均明显低于对照组;糖水消耗实验也显示CUS大鼠糖水摄取量明显低于对照组,提示CUS诱导大鼠出现焦虑、快感缺失等抑郁行为。本研究还发现,模型组大鼠海马和前脑皮层TPH以及TH mRNA和蛋白表达均明显低于对照组。已知大鼠海马和前脑皮层与认知功能、学习记忆和情感等密切相关,提示CUS致大鼠焦虑抑郁可能涉及该脑区的TPH和TH表达下调。
TPH和TH分别是5-HT和NE合成的限速酶。5-HT作为重要的神经递质作用于HPA轴、参与涉及交感神经系统的压力应答,其功能失调会引起精神障碍。TPH作为5-HT的合成限速酶,有报道认为,5-HT前体物质色氨酸不足或限速酶TPH活性降低可诱发抑郁症状[11]。采用母婴分离方法建立幼鼠抑郁模型,发现其成年后中缝核TPH表达降低。此外,也有多篇TPH基因多态性涉及抑郁症发生的报道,并认为可将TPH作为抗抑郁药物研究的新靶点[6]。这些均支持TPH表达下调与抑郁症发生的确有关。最近报道,传统中药制剂开心丸在升高海马及前脑皮层5-HT水平的同时,明显增加TPH的表达[12]。同样,有报道提升TH表达可改善在强迫游泳和悬尾实验中大鼠的绝望行为[13],电休克抗抑郁治疗与明显提高TH基因表达有关[14]。结合TPH的报道,在本次研究中模型组大鼠海马和前脑皮层TPH、TH mRNA及蛋白表达均降低,意味相关区域的脑神经5-HT、NE递质合成减少,进而释放到突触间隙的5-HT和NE也减少;这可能与抑郁症的“单胺学说”发生机制不谋而合。因此,单胺递质合成酶是否可以作为单胺递质再摄取抑制剂低疗效的补充治疗靶点值得进一步探讨。
| [1] | Iversen L. Neurotransmitter transporters and their impact on the development of psychopharmacology[J]. Br J Pharmacol, 2006, 147(S1):82-8. |
| [2] | Castren E, Rantamaki T. The role of BDNF and its receptors in depression and antidepressant drug action:Reactivation of developmental plasticity[J].Dev Neurobiol, 2010, 70(5):289-97. |
| [3] | Kim Y K,Na K S,Shin K H,et al. Cytokine imbalance in the pathophysiology of major depressive disorder[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2007, 31(5):1044-53. |
| [4] | de Bodinat C, Guardiola L B, Mocaer E, et al. Agomelatine, the first melatonergic antidepressant:discovery, characterization and development[J]. Nat Rev Drug Discov, 2010, 9(8):628-42. |
| [5] | Cryan J F, O'Leary O F, Jin S H, et al. Norepinephrine deficient mice lack responses to antidepressant drugs, including selective serotonin reuptake inhibitors[J].Proc Nat Acad Sci, 2004, 101(21):8186-91. |
| [6] | Chen G L,Miller G M. Tryptophan hydroxylase-2:An emerging therapeutic target for stress disorders[J]. Biochem Pharmacol, 2013, 85(9):1227-33. |
| [7] | Thony B, Auerbach G, Blau N. Tetrahydrobiopterin biosynthesis, regeneration and functions[J]. Biochem J,2000, 347(1):1-16. |
| [8] | Willner P, Benton D, Brown E, et al. Depression increases "craving" for sweet rewards in animal and human models of depression and craving[J]. Psychopharmacol Berl,1998,136(3):272-83. |
| [9] | 李 娜,王 涵,文 威,等. 改善氧化/抗氧化应激平衡及NET和5-HTT表达可能与瑞波西汀抗抑郁作用有关[J].中国药理学通报,2011,27(9):593-7.Li N, Wang H, Wen W, et al. Improvement of oxidative/anti-oxidative stress balance and expressions of NET and 5-HTT involved in antidepressive effect of reboxetine[J]. Chin Pharmacol Bull, 2011, 27(9):593-7. |
| [10] | 胡小娅,费慧芝,蒋心惠,等. 改善氧化应激平衡和逆转NET及5-HTT表达异常涉及文拉法辛的抗抑郁作用[J].中国药理学通报,2014,30(6):848-52. Hu X Y, Fei H Z, Jiang X H, et al. Improvement of oxidative/anti-oxidative stress balance and reversion of NET and 5-HTT abnormal expression involved in the anti-depressive effect of venlafaxine[J]. Chin Pharmacol Bull, 2014, 30(6):848-52. |
| [11] | Yang F Z, Wu Y, Zhang W G, et al. Influence of estradiol on tryptophan hydroxylase and 5-hydroxytryptamine content in raphe nuclei of rats under forced swimming stress[J]. Zhonghua Yi Xue Za Zhi, 2010, 90(27):1929-32. |
| [12] | Dong X Z, Li Z L, Zheng X L, et al. A representative prescription for emotional disease, Ding-Zhi-Xiao-Wan restores 5-HT system deficit through interfering the synthesis and transshipment in chronic mild stress-induced depressive rats [J]. J Ethnopharmacol, 2013, 150(3):1053-61. |
| [13] | Fu A L, Wu S P, Dong Z H, et al. A novel therapeutic approach to depression via supplement with tyrosine hydroxylase[J]. Biochem Biophys Res Com, 2006,351(1):140-5. |
| [14] | Brady L S, Lynn A B, Glowa J R, et al. Herkenham,Repeated electroconvulsive shock produces long-lasting increases in messenger RNA expression of corticotropin-releasing hormone and tyrosine hydroxylase in rat brain [J]. Ther Impl J Clin Invest, 1994, 94(3):1263-8. |
| [15] | Zhang J, Darling R D, Paul I A, et al. Altered expression of tyrosine hydroxylase in the locus coeruleus noradrenergic system in citalopram neonatally exposed rats and monoamine oxidase a knock out mice[J]. Anat Rec (Hoboken), 2011,294(10):1685-97. |