2. 第一医院内分泌科, 山西 太原 030001
2. Dept of Endocrinology of the First Hospital, Shanxi Medical University, Taiyuan 030001, China
Efaroxan属于咪唑啉类药物,具有促进胰岛素分泌的作用[1]。电生理和生物化学研究表明,Efaroxan可与胰岛β细胞的ATP敏感性钾(KATP)通道的Kir6.2亚单位结合,进而对胰岛素分泌的调节发挥作用[2, 3]。因此认为Efaroxan的促胰岛素分泌机制类似于临床常用的磺脲类抗糖尿病药物。但随后的研究发现,Efaroxan的促胰岛素分泌作用具有葡萄糖浓度依赖特性,与磺脲类药物非葡萄糖浓度依赖的促胰岛素分泌特点有明显的不同[4]。因此Efaroxan对KATP通道的阻断作用可能仅仅是其促胰岛素分泌作用的机制之一,应该还有其他更为重要的调控机制参与了Efaroxan对胰岛功能的调控作用,但目前相关的作用机制并不清楚。本研究观察了Efaroxan的促胰岛素分泌特点,并探讨其相关作用机制。
1 材料和方法 1.1 材料高糖DMEM培养基,胎牛血清购自美国Gibco公司;Histopaque 1077、Efaroxan、胶原酶P,多聚赖氨酸及青链霉素购自美国Sigma公司。KU14R购自英国Tocris公司。大鼠胰岛由180~250 g Wistar大鼠分离所得。大鼠胰岛素放射免疫试剂盒购自北京北方生物技术公司。
1.2 主要仪器细胞培养箱(北京博奥恒信);超净工作台(北京世安科林净化技术有限公司);倒置显微镜(OLYMPUS,日本);电子天平(上海精密仪器);台式离心机(长沙湘仪仪器);体式显微镜(上海中恒仪器)。
1.3 方法 1.3.1 胰岛分离及培养分离大鼠胆总管,将胶原酶P经胆总管注入胰腺内,摘除含酶液的胰腺,将其置于离心管中37℃水浴消化,收集消化后的胰腺组织,Histopaque 1077梯度离心,显微镜下挑取胰岛。置于DMEM培养液中培养胰岛。详细步骤参见我们之前报道的方法[5]。
1.3.2 胰岛素分泌实验根据实验要求配制含不同浓度葡萄糖的KRBH孵育液。胰岛置于含KRBH的孵育管中,加入待测药物,培养箱中孵育60 min,收集上清,放射免疫法测定胰岛素含量。详细步骤参见我们之前报道的方法[5]。
1.3.3 环磷酸腺苷(cAMP)测定根据实验要求配制含不同浓度葡萄糖的KRBH孵育液。胰岛置于含KRBH的孵育管中,加入待测药物,培养箱中孵育60 min,超声波粉碎胰岛,放射免疫法测定cAMP含量。详细步骤参见我们之前报道的方法[5]。
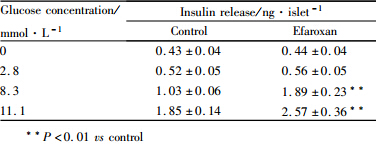
2 结果 2.1 Efaroxan对胰岛素分泌的影响在不同葡萄糖浓度(0、2.8、8.3、11.1 mmol·L-1)条件下,我们发现100 μmol·L-1的Efaroxan对胰岛素分泌的促进作用有明显的葡萄糖浓度依赖特性。与其平行对照组(control)相比,在较低葡萄糖浓度(0、2.8 mmol·L-1)时,Efaroxan对胰岛素分泌并无明显影响;而在较高葡萄糖浓度(8.3、11.1 mmol·L-1)时,Efaroxan则明显的促进了胰岛素的分泌(P<0.01),见Tab 1。
本组实验均在8.3 mmol·L-1葡萄糖浓度条件下完成。同对照组相比,100 μmol·L-1 的Efaroxan明显的促进了胰岛素分泌(P<0.01);给予Efaroxan拮抗剂KU14R(100 μmol·L-1),则明显的抑制了Efaroxan的作用。应用腺苷酸环化酶激动剂forskolin(5 μmol·L-1)也明显的促进了胰岛素分泌,同对照组比差异有显著性(P<0.01)。值得注意的是,forskolin的这一作用也可以被KU14R明显的抑制。Forskolin通过激动腺苷酸环化酶可使细胞内环磷酸腺苷(cAMP)含量增加(见tab 4),因此本实验提示Efaroxan促胰岛素分泌作用可能与cAMP有关,见Tab 2。
 |
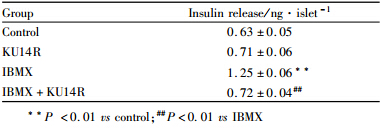
在8.3 mmol·L-1葡萄糖浓度条件下,观察KU14R自身对胰岛素分泌的影响,结果表明KU14R对胰岛素分泌并没有明显的作用(P>0.05 vs control)。给予磷酸二酯酶抑制剂IBMX(3-异丁基-1-甲基黄嘌呤,50 μmol·L-1)则明显促进了胰岛素分泌(P<0.01 vs control)。当给予KU14R后,IBMX的促胰岛素分泌作用则被明显抑制(P<0.01)。IBMX通过抑制磷酸二酯酶减少cAMP的降解,从而使胰岛β细胞内cAMP含量增高而发挥作用(见tab 4),因此本实验结果也表明KU14R通过抑制cAMP信号通路发挥抑制胰岛素分泌的作用,见Tab 3。
 |
应用cAMP放射免疫测定试剂盒,我们检测了在8.3 mmol·L-1葡萄糖条件下所用药物对胰岛cAMP含量的影响。结果表明,在未给予KU14R时,Efaroxan对cAMP含量无明显影响,但forskolin和IBMX均使cAMP含量明显升高(P<0.01 vs control)。当给予KU14R后,与其平行对照组相比,KU14R并没有对cAMP含量产生明显的影响。详见Tab 4。
在本研究中,我们观察到Efaroxan具有葡萄糖依赖性的促进胰岛素分泌作用,其特点是在高浓度葡萄糖条件下增强胰岛素分泌,而在低浓度葡萄糖条件下则没有作用,与此前的文献报道结果一致[2]。应用Efaroxan的拮抗剂KU14R[6, 7],我们对Efaroxan的作用机制进行了研究。结果表明,KU14R可明显抑制Efaroxan对胰岛素分泌的促进作用。同时我们发现,KU14R明显的抑制了forskolin对胰岛素分泌的促进作用。大量研究表明[5],forskolin可通过激动腺苷酸环化酶,升高胰岛β细胞cAMP而发挥促进胰岛素分泌的作用。因此我们的结果提示,Efaroxan亦有可能是通过cAMP信号通路发挥对胰岛素分泌的调控作用。
进一步的研究表明,KU14R自身对胰岛素分泌没有影响,但可以抑制IBMX对胰岛素分泌的促进作用。IBMX是磷酸二酯酶抑制剂,可以抑制磷酸二酯酶对cAMP的降解作用[8],从而提高细胞内的cAMP含量,进而促进胰岛素分泌。因此本实验进一步证明,KU14R是通过阻断药物对cAMP信号通路的激活来发挥抑制胰岛素分泌的作用,提示Efaroxan的促胰岛素分泌作用与cAMP信号通路有关。
在胰岛β细胞,cAMP的生物作用主要是通过其下游的蛋白激酶A(PKA)和Epac (exchange protein directly activated by cAMP) 效应物来完成[9, 10, 11]。通过检测胰岛cAMP含量,我们发现forskolin和IBMX的确明显增加了cAMP含量,但是Efaroxan和KU14R对胰岛cAMP含量没有影响,表明Efaroxan是通过激动cAMP下游信号通路发挥作用的,而KU14R也是通过阻断cAMP下游信号转导通路发挥抑制Efaroxan、forskolin和IBMX的促胰岛素分泌作用。
综上所述,本研究证明了Efaroxan具有葡萄糖依赖性促进胰岛素分泌的作用,其作用机制与胰岛β细胞cAMP下游信号通路有关。进一步的研究需要证实Efaroxan与cAMP下游信号分子PKA和Epac的关系。本研究为深入理解Efaroxan的促胰岛素分泌调控机制提供了理论依据。
| [1] | Morgan N G, Chan S L, Mourtada M, et al. Imidazolines and pancreatic hormone secretion[J]. An N Y Acad Sci, 1999, 881:217-28. |
| [2] | Chan S L, Dunne M J, Stillings M R, et al. The alpha 2-adrenoceptor antagonist efaroxan modulates K+ATP channels in insulin-secreting cells[J]. Europ J Pharmacol, 1991, 204(1):41-8. |
| [3] | Monks L K, Cosgrove K E, Dunne M J, et al. Affinity isolation of imidazoline binding proteins from rat brain using 5-amino-efaroxan as a ligand[J]. FEBS letters, 1999, 447(1):61-4. |
| [4] | Efanov A M, Hoy M, Branstrom R, et al. The imidazoline RX871024 stimulates insulin secretion in pancreatic beta-cells from mice deficient in K(ATP) channel function[J]. Biochem Biophys Res Commun, 2001, 284(4):918-22. |
| [5] | Li X, Guo Q, Gao J, et al. The adenylyl cyclase inhibitor MDL-12,330A potentiates insulin secretion via blockade of voltage-dependent K(+) channels in pancreatic beta cells[J]. PloS One, 2013, 8(10):e77934. |
| [6] | Chan S L, Pallett A L, Clews J, et al. Characterisation of new efaroxan derivatives for use in purification of imidazoline-binding sites[J]. European J Pharmacol, 1998, 355(1):67-76. |
| [7] | Mourtada M, Chan S L, Smith S A, et al. Multiple effector pathways regulate the insulin secretory response to the imidazoline RX871024 in isolated rat pancreatic islets[J]. British J Pharmacol, 1999, 127(5):1279-87. |
| [8] | Freitag A, Wessler I, Racke K. Phosphodiesterase inhibitors suppress alpha2-adrenoceptor-mediated 5-hydroxytryptamine release from tracheae of newborn rabbits[J]. Europ J Pharmacol, 1998, 354(1):67-71. |
| [9] | Cheng X, Ji Z, Tsalkova T, et al. Epac and PKA:a tale of two intracellular cAMP receptors[J]. Acta Biochm Biophys Sin, 2008, 40(7):651-62. |
| [10] | 高维娟, 许顺江, 丛 斌, 等. CCK-8抗炎作用中DAG-PKC信号通路对cAMP-PKA信号通路的影响[J]. 中国药理学通报, 2008,20(9):1156-60.Gao W J, Xu S J, Cong B, et al. Effects of DAG-PKC signaling pathway on cAMP-PKA signaling pathway in anti inflammatory effects of CCK-8[J]. Chin Pharmacol Bull,2008,20(9):1156-60. |
| [11] | 刘 健,谢军明,嵇 晴,等. 环磷腺苷通路对内毒素刺激的小胶质细胞分泌细胞因子的影响[J]. 中国药理学通报, 2012,28(4):478-82.Liu J,Xie J M,Ji Q, et al. The effect of cAMP signaling pathway on the expression of cytokines by the microglia stimulated with endotoxin[J]. Chin Pharmacol Bull,2012,28(4):478-82. |