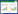文章信息
- 夏嘉鼎, 滑立伟, 徐敏, 李国斌, 郑欣, 张坤
- XIA Jiading, HUA Liwei, XU Min, LI Guobin, ZHENG Xin, ZHANG Kun
- 脓毒症休克相关心房颤动患者的临床特征及预后危险因素
- Clinical characteristics and prognostic risk factors of patients with atrial fibrillation related to septic shock
- 中国医科大学学报, 2025, 54(7): 631-637
- Journal of China Medical University, 2025, 54(7): 631-637
-
文章历史
- 收稿日期:2024-08-08
- 网络出版时间:2025-07-07 10:25:52
脓毒症休克导致的器官功能障碍是目前重症监护病房(intensive care unit,ICU)关注的重要问题。心脏是脓毒症休克损害的重要靶器官之一,ICU中部分既往未患心律失常的脓毒症休克患者会初次发生心房颤动(简称房颤),即脓毒症休克相关房颤。房颤能加重休克患者的血流动力学异常,可出现脑卒中、心力衰竭、猝死等并发症,进而危及生命[1-3]。因此,早期识别和预后判断是脓毒症休克相关房颤治疗的关键。
目前,针对脓毒症休克相关房颤的危险因素及预后评估的研究相对较少,其作用机制亦不十分明确,有研究[4]显示可能与炎症反应、血流动力学不稳定、左心室舒张和收缩期功能障碍等因素有关。本研究收集我院ICU脓毒症休克患者的临床资料并进行分析,探讨脓毒症休克相关房颤患者的临床特征及预后危险因素,旨在为脓毒症休克相关房颤的临床诊治提供依据。
1 材料与方法 1.1 临床资料及分组收集2020年1月至2023年12月于承德医学院附属医院ICU住院的脓毒症休克患者的临床资料。纳入标准:(1)年龄≥18岁;(2)符合脓毒症休克诊断标准[5],即感染导致的危及生命的器官功能障碍,出现心血管功能障碍。排除标准:(1)脓毒症休克诊断48 h内死亡;(2)既往存在慢性房颤(长期持续性房颤及永久性房颤);(3)ICU住院期间未进行实验室检查、床旁超声心动图以及心电图检查。本研究已获得医院伦理委员会批准(审批号CYFYLL2022510),患者或家属均知情同意并签署知情同意书。共纳入152例,男95例,女57例;平均年龄(64.76±16.32)岁;肺部感染67例,腹腔内感染55例,皮肤软组织感染9例,泌尿系感染16例,中枢神经系统感染2例,其他部位感染3例。根据ICU住院期间是否发生房颤分为房颤组(n = 48)和非房颤组(n = 104),房颤发生率为31.58%。根据28 d时患者是否存活分为生存组(n = 103)与死亡组(n = 49),病死率为32.24%。
1.2 观察指标记录患者年龄,性别,合并症,感染部位,平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、脉搏氧饱和度(pulse oxygen saturation,SpO2)等生命体征,急性生理学与慢性健康状况评分系统-Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分、序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分、累积血管活性药物使用量及预后(脓毒症休克发生、ICU住院时间、28 d生存情况)等。
患者入ICU后记录房颤[6]发作时间,是否反复发作或自行终止,经过治疗是否可转复为窦性心律。房颤患者生化指标选取房颤发生后48 h内的最差值,非房颤患者生化指标选取入住ICU后48 h内的最差值。生化指标包括白细胞计数(white blood cells,WBC)、N末端脑钠肽前体(N-terminal brain natriuretic peptide precursor,NT-proBNP)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)、肌钙蛋白Ⅰ(troponin Ⅰ,cTnⅠ)、血乳酸(lactic acid,Lac)等。
患者超声心动图检查均由经过重症超声专项技术培训资质认证的医师完成并记录。指标主要包括左室射血分数(left ventricular ejection fraction,LVEF)、二尖瓣舒张早期血流峰值速度与二尖瓣环舒张早期运动速度比值(E/e’)等。
1.3 统计学分析应用SPSS 25.0软件进行统计分析,符合正态分布的计量资料采用x±s表示,组间比较采用t检验;非正态分布的计量资料以M(P25~P75)表示,组间比较采用非参数秩和检验。计数资料比较采用χ2检验。将2组比较差异有统计学意义(P < 0.05)指标纳入多因素logistic回归分析房颤发生或脓毒症休克预后的危险因素。将是否房颤作为二分类变量,纳入Kaplan-Meier生存曲线分析并采用log-rank法进行比较。P < 0.05为差异有统计学意义。
2 结果 2.1 房颤组与非房颤组临床指标比较结果显示,与非房颤组比较,房颤组患者年龄更大,APACHEⅡ评分、SOFA评分更高;Lac、NT-proBNP、cTnI、TNF-α、CRP水平,E/e’、LVEF及28 d病死率更高,累积血管活性药物使用量更多,差异均有统计学意义(均P < 0.05)。而2组性别,MAP,HR,SpO2,IL-6,ICU住院时间,合并症、感染发生率比较差异无统计学意义(均P > 0.05)。见表 1。
| Item | AF group(n = 48) | Non-AF group(n = 104) | χ2/t/Z | P |
| Age(year) | 71.40±12.55 | 61.70±16.99 | 3.532 | 0.001 |
| Male [n (%)] | 30(62.5) | 65(62.5) | 0.000 | 1.000 |
| APACHEⅡ score | 28.79±8.97 | 23.34±8.76 | 3.542 | 0.001 |
| SOFA score | 12.90±1.96 | 8.50±3.02 | 9.234 | < 0.001 |
| MAP(mmHg) | 80.5(60.0-99.0) | 73.00(62.5-91.0) | 1.356 | 0.176 |
| HR(beats/min) | 113.81±31.36 | 109.17±23.89 | 0.910 | 0.366 |
| SpO2(%) | 98.0(93.0-100.0) | 96.0(87.0-99.0) | 1.912 | 0.056 |
| Lac(mmol/L) | 5.08(3.24-8.61) | 2.89(1.80-4.52) | 4.717 | < 0.001 |
| NT-proBNP(ng/mL) | 6 710.0(2 495.0-14 600.0) | 3 040.0(867.5-9 935.0) | 2.380 | 0.017 |
| cTnI(ng/mL) | 6.76(0.10-24.29) | 0.21(0.10-11.41) | 2.284 | 0.022 |
| IL-6(ng/L) | 2 371.11(348.63-2 718.61) | 2 386.05(722.12-3 173.90) | -0.792 | 0.430 |
| TNF-α(ng/L) | 164.12(119.71-231.95) | 81.58(46.89-124.34) | 5.991 | < 0.001 |
| CRP(mg/L) | 245.64(127.29-355.21) | 148.50(82.11-241.64) | 3.762 | < 0.001 |
| E/e’ | 16.40(15.45-17.15) | 12.00(10.30-15.50) | 6.333 | < 0.001 |
| LVEF(%) | 55.0(50.0-63.0) | 51.0(41.5-59.0) | 1.967 | 0.049 |
| Vasoactive drug dosage [μg/(min·kg)] | 1.50(0.69-3.10) | 0.20(0.09-0.32) | 6.976 | < 0.001 |
| Length of ICU stay(d) | 13.5(4.0-26.0) | 18.0(8.5-28.0) | -1.499 | 0.134 |
| 28-day mortality [n (%)] | 22(45.8) | 27(26.0) | 5.937 | 0.017 |
| Complications [n(%)] | ||||
| Cardiovascular/cerebrovascular | 18(17.30) | 11(22.90) | 0.669 | 0.506 |
| Diabetes | 12(25.0) | 18(17.3) | 1.227 | 0.280 |
| Hypertension | 26(54.2) | 45(43.3) | 1.567 | 0.226 |
| COPD | 5(10.4) | 5(4.8) | 1.681 | 0.289 |
| Site of infection [n (%)] | 6.053 | 0.302 | ||
| Lung | 24(50.0) | 43(41.3) | ||
| Abdominal | 15(31.3) | 40(38.5) | ||
| Skin and soft tissue | 2(4.2) | 7(6.7) | ||
| Urinary system | 4(8.3) | 12(11.5) | ||
| CNS | 2(4.2) | 0(0.0) | ||
| Others | 1(2.1) | 2(1.9) | ||
| AF,atrial fibrillation;COPD,chronic obstructive pulmonary disease;CNS,central nervous system. | ||||
2.2 脓毒症休克相关房颤的危险因素分析
将房颤组与非房颤组比较差异有统计学意义(P < 0.05)的指标纳入多因素logistic回归分析。结果显示,年龄大(OR = 1.060,P = 0.015),SOFA评分高(OR = 1.525,P = 0.001),TNF-α(OR = 1.009,P = 0.026)、CRP(OR = 1.008,P = 0.002)水平高,E/e’值大(OR = 1.363,P = 0.023)均是房颤发生的危险因素,见表 2。
| Item | B | SE | Wald | P | OR | 95%CI |
| Age | 0.058 | 0.024 | 5.922 | 0.015 | 1.060 | 1.011-1.110 |
| APACHEⅡ score | -0.017 | 0.039 | 0.165 | 0.684 | 0.984 | 0.913-1.062 |
| SOFA score | 0.422 | 0.132 | 10.173 | 0.001 | 1.525 | 1.177-1.976 |
| Lac | -0.070 | 0.082 | 0.730 | 0.393 | 0.932 | 0.794-1.095 |
| NT-proBNP | 0.000 | 0.000 | 1.172 | 0.279 | 1.000 | 1.000-1.000 |
| cTnI | 0.020 | 0.030 | 0.456 | 0.499 | 1.021 | 0.962-1.083 |
| TNF-α | 0.009 | 0.004 | 4.971 | 0.026 | 1.009 | 1.001-1.017 |
| CRP | 0.008 | 0.003 | 10.071 | 0.002 | 1.008 | 1.003-1.014 |
| E/e’ | 0.310 | 0.136 | 5.169 | 0.023 | 1.363 | 1.044-1.780 |
| LVEF | -0.014 | 0.034 | 0.165 | 0.685 | 0.986 | 0.924-1.053 |
| Dosage of vasoactive drug | 0.361 | 0.187 | 3.739 | 0.053 | 1.435 | 0.995-2.068 |
| Constant | -15.637 | 3.656 | 18.297 | < 0.001 | - | - |
2.3 生存组与死亡组各项临床指标比较
结果显示,与生存组比较,死亡组患者Lac、cTnI、E/e’、LVEF、TNF-α水平增高,APACHEⅡ评分、SOFA评分增加,ICU住院时间延长,房颤发生率也明显增高(均P < 0.05)。2组年龄、性别、MAP、HR、SpO2、NT-proBNP、IL-6及CRP比较差异均无统计学意义(均P > 0.05)。见表 3。
| Item | Death group(n = 49) | Survival group(n = 103) | χ2/Z | P |
| Age(year) | 68.0(56.0-79.0) | 67.00(57.0-75.5) | 0.621 | 0.535 |
| Male [n(%)] | 35(36.8) | 60(63.2) | 2.460 | 0.152 |
| APACHEⅡ score | 29.0(22.0-34.0) | 22.0(17.0-29.0) | 3.496 | < 0.001 |
| SOFA score | 13.0(12.0-14.0) | 8.0(6.0-10.0) | 8.273 | < 0.001 |
| MAP(mmHg) | 77.0(63.0-99.0) | 73.0(60.0-97.0) | 0.639 | 0.525 |
| HR(beat/min) | 110.0(92.0-130.0) | 112.0(93.0-125.0) | -0.335 | 0.739 |
| SpO2(%) | 93.0(87.0-100.0) | 96.0(88.0-99.0) | -0.916 | 0.361 |
| Lac(mmol/L) | 5.60(2.41-12.08) | 3.24(2.23-4.56) | 2.933 | 0.003 |
| NT-proBNP(ng/mL) | 7 072.0(867.5-10 940.0) | 6 940.0(2 104.0-14 600.0) | 0.980 | 0.616 |
| cTnI(ng/mL) | 12.38(1.23-25.85) | 0.10(0.10-2.31) | 3.148 | < 0.001 |
| IL-6(ng/L) | 2 332.07(612.00-4 905.84) | 2 390.25(632.93-2 601.69) | -0.824 | 0.068 |
| TNF-α(ng/L) | 163.05(120.53-232.00) | 82.48(46.98-122.98) | 5.426 | < 0.001 |
| CRP(mg/L) | 164.64(102.68-295.14) | 173.00(99.01-266.10) | -0.037 | 0.970 |
| E/e’ | 16.60(15.40-17.40) | 12.30(10.30-15.45) | 6.443 | < 0.001 |
| LVEF(%) | 59.0(53.0-64.0) | 50.0(40.5-56.5) | 4.623 | < 0.001 |
| Length of ICU stay(d) | 24.0(16.0-32.5) | 5.0(2.0-9.0) | 7.712 | < 0.001 |
| Incidence of AF [n(%)] | 22(54.2) | 26(45.8) | 5.937 | 0.017 |
2.4 脓毒症休克患者死亡的危险因素分析
将生存组与死亡组比较差异有统计学意义(P < 0.05)的指标纳入logistic回归分析。结果显示,SOFA评分、cTnI、E/e’增高和发生房颤是脓毒症休克患者28 d死亡的独立危险因素(均P < 0.05)。见表 4。进一步将脓毒症休克患者是否发生房颤作为二分类变量,Kaplan-Meier生存曲线分析结果显示脓毒症休克相关房颤患者生存率随时间推移显著下降(χ2=6.747,P = 0.009)。见图 1。提示房颤与脓毒症休克患者预后相关,发生房颤的脓毒症休克患者死亡风险更高,预后更差。
| Item | B | SE | Wald | P | OR | 95%CI |
| APACHEⅡ score | 0.110 | 0.093 | 1.397 | 0.237 | 1.117 | 0.930-1.341 |
| SOFA score | 1.948 | 0.871 | 4.999 | 0.025 | 7.012 | 1.272-38.665 |
| Lac | -0.252 | 0.163 | 2.409 | 0.121 | 0.777 | 0.565-1.069 |
| cTnI | 0.282 | 0.125 | 5.050 | 0.025 | 1.325 | 1.037-1.695 |
| TNF-α | 0.005 | 0.010 | 0.231 | 0.631 | 1.005 | 0.986-1.024 |
| E/e’ | 0.930 | 0.450 | 4.275 | 0.039 | 2.535 | 1.050-6.122 |
| LVEF | -0.011 | 0.060 | 0.032 | 0.859 | 0.989 | 0.880-1.112 |
| Length of ICU stay | -0.223 | 0.142 | 2.467 | 0.116 | 0.800 | 0.606-1.057 |
| AF | 2.137 | 1.094 | 3.816 | 0.049 | 8.475 | 0.993-72.333 |
| Constant | -9.777 | 3.928 | 6.194 | 0.013 | - | - |

|
| 图 1 Kaplan-Meier生存曲线分析房颤对脓毒性休克患者预后的影响 Fig.1 Effect of atrial fibrillation on prognosis in patents with septic shock by Kaplan-Meier survival curve |
3 讨论
心脏是脓毒症受累的重要器官之一,表现为心肌损伤和心律失常。近期研究[7-10]表明,危重症患者心律失常的发生与脓毒症休克关系密切,是脓毒症休克心脏功能受累的表现形式之一。最常见的心律失常是房颤,占室上性心律失常的70%。危重症患者房颤发生率较高,即使给予保护心脏功能等相关治疗,仍有相当比例的脓毒症休克患者出现房颤,ICU住院时间明显延长 [11]。本研究结果显示,ICU脓毒症休克相关房颤发生率为31.58%,与以往研究[7]结果相近。与非房颤组比较,房颤组患者年龄较大,血管活性药物累积用量较多,Lac、NT-proBNP、cTnI、TNF-α、CRP水平,LVEF和E/e’,APACHEⅡ、SOFA评分,28 d病死率均显著增高(均P < 0.05)。提示脓毒症休克相关房颤患者在器官灌注、心肌损伤程度、心脏收缩和舒张功能以及病情危重程度方面较非房颤患者更为严重。预后分析结果显示,与生存组比较,死亡组患者房颤发生率更高,而且心肌损伤标志物和炎性细胞因子水平也更高。logistic回归分析结果显示,SOFA评分、cTnI水平、E/e’和房颤是脓毒症休克患者28 d内死亡的独立危险因素(均P < 0.05),提示房颤、心肌损伤和心脏舒张功能不全的脓毒症休克患者预后更差。有临床研究[12-13]报道,脓毒症休克患者若在ICU期间新发房颤,会加重原发疾病的严重程度,延长ICU住院时间,此类临床情况在合并心血管及呼吸系统疾病的老年患者中更为常见,与本研究结果一致。
本研究结果显示,年龄、SOFA评分、TNF-α、CRP和E/e’是脓毒症休克相关房颤的独立危险因素(均P < 0.05)。本研究中房颤患者年龄较非房颤患者大,同样有研究表明老年患者心血管疾病发生风险高于非老年患者,年龄大的危重症患者房颤出现比例更高[14]。脓毒症休克患者血流动力学不稳定,进而导致器官功能障碍,SOFA评分升高,因此需应用血管活性药物维持循环功能。本研究中脓毒症休克相关房颤患者较非房颤患者累积血管活性药物使用量更多。另外,应用的血管活性药物以儿茶酚胺最为常见,此类药物作用于心肌细胞膜肾上腺素能α/β受体,提高了心肌细胞兴奋性和自律性,借此机制可触发房颤[15]。
机体受到感染等因素刺激时,单核细胞和巨噬细胞会释放大量细胞因子(TNF-α、IL-6、干扰素、转化生长因子等)[16-17]。脓毒症休克时存在全身性炎症反应,而且因炎症系统及抗炎系统失衡导致包括心脏在内的器官功能障碍。TNF-α是感染后最早释放的关键促炎性细胞因子,其核心作用是在炎症反应中激活细胞因子级联反应,诱发多种炎性细胞因子分泌,由此激发炎症瀑布样反应[18]。本研究结果显示,与无房颤组比较,房颤组TNF-α水平增高;logistic回归分析结果显示TNF-α是脓毒症休克相关房颤的独立危险因素。炎症反应和房颤之间关系复杂,以TNF-α为代表的炎性细胞因子通过诱导心房电重构及结构重构参与房颤的发生。应用肿瘤坏死因子抑制剂有可能减轻左心房重构和房颤易感性,而房颤也可能促进炎症的进展,两者相互作用,导致危重患者病情恶化[19-20]。
心脏舒张功能异常在脓毒症休克中并不少见。已有研究[21-23]证实,心脏舒张功能不全在脓毒症休克初期即可发生,并伴有心肌损伤,早于收缩功能受损,且恢复较为缓慢。在评估心脏舒张功能指标中,E/e’与左心室僵硬程度及左心房纤维化相关,被用于评估左心室充盈压和心脏舒张功能。本研究结果显示,E/e’水平房颤组高于非房颤组;死亡组也高于生存组,另外死亡组与生存组LVEF比较也存在统计学差异。logistic回归分析发现E/e’既是影响脓毒症休克预后的独立危险因素,也是脓毒症休克相关房颤的独立危险因素,提示心脏舒张功能可能会更好地预测脓毒症休克相关房颤的发生以及脓毒症休克的预后。分析原因可能是因为脓毒症休克过程中炎性细胞因子作用于心肌组织,氧供需失衡及小血管栓塞损害了心脏功能,进而发生心肌抑制,左心室充盈压增高、心肌顺应性下降,出现心脏舒张功能异常,导致心脏节律改变而引起心律失常。因此,临床治疗脓毒症休克过程中应优化液体管理,避免液体过负荷,从而减轻左心室充盈压来降低心脏舒张功能异常、减少房颤发生的可能。
综上所述,ICU脓毒症休克相关房颤发生率较高;年龄、器官功能障碍情况、炎性细胞因子水平和心脏舒张功能障碍是脓毒症休克相关房颤发生的主要临床特征。器官功能障碍情况、心肌损伤、心脏舒张功能障碍及房颤是影响脓毒症休克预后的独立危险因素。发生房颤的脓毒症休克患者死亡风险更高,预后更差。本研究数据仅来源于一家医院,可能存在选择偏倚,未来将扩大样本量,开展多中心研究来进一步论证。
| [1] |
WU L, FENG Q, AI ML, et al. Dynamic changes in serum S100B levels from day 1 to 3 are associated with sepsis-associated encephalopathy[J]. Sci Rep, 2020, 10(1): 7718. DOI:10.1038/s41598-020-64200-3 |
| [2] |
GUNDLUND A, OLESEN JB, BUTT JH, et al. One-year outcomes in atrial fibrillation presenting during infections: a nationwide registry-based study[J]. Eur Heart J, 2020, 41(10): 1112-1119. DOI:10.1093/eurheartj/ehz873 |
| [3] |
王玉红, 张玉真. 脓毒症中新发心房纤颤的研究进展[J]. 中国循证心血管医学杂志, 2015, 7(3): 431-432. DOI:10.3969/j.1674-4055.2015.03.51 |
| [4] |
杨建中, 汤宝鹏. 脓毒症和脓毒症休克新发心房颤动的发生机制和抗心律失常治疗[J]. 中国全科医学, 2018, 21(20): 2409-2413. DOI:10.12114/j.issn.1007-9572.2018.00.085 |
| [5] |
SINGER M, DEUTSCHMAN CS, SEYMOUR CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. Jama, 2016, 315(8): 801. DOI:10.1001/jama.2016.0287 |
| [6] |
葛均波, 徐永健, 王辰. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018: 188-190.
|
| [7] |
MOHAMED MW, RIYAD MK, KHAMIS AM, et al. New onset of atrial fibrillation"as an outcome predictor in critically ill patients with sepsis: a systemic review[J]. QJM, 2021, 114(Supplement_1): hcab086.071. DOI:10.1093/qjmed/hcab086.071 |
| [8] |
SHAHREYAR M, FAHHOUM R, AKINSEYE O, et al. Severe sepsis and cardiac arrhythmia[J]. Ann Transl Med, 2018, 6(1): 6. DOI:10.21037/atm.2017.12.26 |
| [9] |
KLEIN KLOUWENBERG PMC, FRENCKEN JF, KUIPERS S, et al. Incidence, predictors, and outcomes of new-onset atrial fibrillation in critically ill patients with sepsis. Cohort study[J]. Am J Respir Crit Care Med, 2017, 195(2): 205-211. DOI:10.1164/rccm.201603-0618OC |
| [10] |
AIBAR J, SCHULMAN S. New-onset atrial fibrillation in sepsis: a narrative review[J]. Semin Thromb Hemost, 2021, 47(1): 18-25. DOI:10.1055/s-0040-1714400 |
| [11] |
付建宇, 毕红英, 夏云松, 等. 危重症患者心房颤动发生的危险因素分析[J]. 中华危重病急救医学, 2018(4): 337-341. DOI:10.3760/cma.j.issn.2095-4352.2018.04.010 |
| [12] |
BALIK M, KOLNIKOVA I, MALY M, et al. Propafenone for supraventricular arrhythmias in septic shock compared with amiodarone and metoprolol[J]. J Crit Care, 2017, 41: 16-23. DOI:10.1016/j.jcrc.2017.04.027 |
| [13] |
GANDHI S, LITT D, NARULA N. New-onset atrial fibrillation in sepsis is associated with increased morbidity and mortality[J]. Neth Heart J, 2015, 23(2): 82-88. DOI:10.1007/s12471-014-0641-x |
| [14] |
周业庭, 童道明, 王少丹, 等. ICU老年与非老年危重患者死亡风险比较: 一项连续3年的回顾性队列研究[J]. 中华危重病急救医学, 2017, 29(5): 448-452. DOI:10.3760/cma.j.issn.2095-4352.2017.05.012 |
| [15] |
LIU WC, LIN WY, LIN CS, et al. Prognostic impact of restored sinus rhythm in patients with sepsis and new-onset atrial fibrillation[J]. Crit Care, 2016, 20(1): 373. DOI:10.1186/s13054-016-1548-2 |
| [16] |
GEORGESCU AM, BANESCU C, AZAMFIREI R, et al. Evaluation of TNF-α genetic polymorphisms as predictors for sepsis susceptibility and progression[J]. BMC Infect Dis, 2020, 20(1): 1-11. DOI:10.1186/s12879-020-4910-6 |
| [17] |
CHEN WR, LIU HB, SHA Y, et al. Effects of statin on arrhythmia and heart rate variability in healthy persons with 48-hour sleep deprivation[J]. J Am Heart Assoc, 2016, 5(11): e003833. DOI:10.1161/JAHA.116.003833 |
| [18] |
ZHANG GZ, WANG JY, ZHAO ZR, et al. Regulated necrosis, a proinflammatory cell death, potentially counteracts pathogenic infections[J]. Cell Death Dis, 2022, 13(7): 637. DOI:10.1038/s41419-022-05066-3 |
| [19] |
MUHAMMET RS, AHMET Ö, ALI HK, et al. The use of systemic immune-inflammation index to predict new onset atrial fibrillation in the context of acute coronary syndrome[J]. Kardiologiia, 2022, 62(8): 59-64. DOI:10.18087/cardio.2022.8.n1986 |
| [20] |
周姝冶, 谢美丽, 王智昊. 炎症与心房颤动相关性研究进展[J]. 国际老年医学杂志, 2022, 43(6): 742-746. DOI:10.3969/j.issn.1674-7593.2022.06.022 |
| [21] |
夏嘉鼎, 苏震, 郑辉宇, 等. 脓毒症性心脏功能障碍患者肌钙蛋白Ⅰ表达水平的变化及预后评估价值[J]. 中国医科大学学报, 2017, 46(11): 1001-1004. DOI:10.12007/j.issn.0258-4646.2017.11.009 |
| [22] |
呼邦传, 王宇佳, 葛伟东, 等. 脓毒症休克患者左心室舒张功能不全相关因素分析及其预后影响[J/OL]. 中华危重症医学杂志(电子版), 2017, 10 (2): 92-97. DOI: 10.3877/cma.j.issn.1674-6880.2017.02.005.
|
| [23] |
XIA JD, HUA LW, KANG DW, et al. Association between higher cardiac troponin levels and the development of left ventricular diastolic dysfunction in patients with sepsis and diabetes mellitus[J]. Int J Cardiovasc Imag, 2024, 40(1): 27-34. DOI:10.1007/s10554-023-02963-2 |
 2025, Vol. 54
2025, Vol. 54