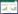文章信息
- 关冀弛, 杨金雨, 刘丹, 李磊, 李东华, 汪海峰
- GUAN Jichi, YANG Jinyu, LIU Dan, LI Lei, LI Donghua, WANG Haifeng
- 丙泊酚作用NLRP3/ASC/caspase-1通路对肺癌A549细胞焦亡的影响
- Effect of propofol on pyroptosis of lung cancer A549 cells by NLRP3/ASC/caspase-1 pathway
- 中国医科大学学报, 2024, 53(2): 132-135, 141
- Journal of China Medical University, 2024, 53(2): 132-135, 141
-
文章历史
- 收稿日期:2023-03-02
- 网络出版时间:2024-01-10 16:29:01
原发性肺癌是最常见的恶性肿瘤,在全球大部分国家中其发病率、死亡率最高。寻找高效低毒性的化疗药物或方案对治疗肺癌有重要意义 [1-3]。丙泊酚是一种烷基酸类的短效静脉麻醉药,研究发现丙泊酚在肺癌[4]和结直肠癌[5]等的发生与转移中起抑制作用,可以影响肿瘤细胞的增殖、分化等途径。细胞焦亡是一种细胞程序性死亡方式,通过激活半胱氨酸天冬氨酸蛋白水解酶(caspase)家族的部分蛋白,使其切割并激活焦孔素蛋白(gasdermin,GSDM),活化的GSDM转移到细胞膜上形成孔洞,胞质外流,胞内炎性细胞因子释放,最终导致细胞膜破裂、细胞死亡[6-7]。NLRP3/ASC/caspase-1通路构成了炎症小体激活的经典通路,在多种危险信号刺激下被激活。三维培养的肿瘤细胞可以获得持续自我复制、肿瘤血管生成等生物学特性,在肿瘤疾病的治疗和耐药机制等方面具有广泛的应用前景[8]。本研究以超低吸附培养法建立肺癌A549细胞三维培养模型,研究丙泊酚通过激活NLRP3/ASC/caspase-1通路促进细胞焦亡而抑制肺癌A549细胞增殖的作用机制,为肺癌疾病的研究和治疗提供实验依据。
1 材料与方法 1.1 细胞株人肺癌A549细胞株,购自中国科学院细胞库。
1.2 主要药物、试剂与仪器RPMI1640培养基(美国Gibco公司),TBD优级胎牛血清(中国苏州瑞诺德生物科技有限公司),HyClone双抗(中国上海华雅思创生物科技有限公司),胰蛋白酶(美国Gibco公司),ULA 24、96孔板(美国Corning公司),CCK-8、白细胞介素(interleukin,IL)-1β、IL-18、酶联免疫吸附试剂盒、BCA蛋白浓度测定试剂盒、兔抗人NLRP3、ASC、caspase-1、GSDMD-N、IL-1β、GAPDH一抗及二抗均购自中国上海碧云天生物技术有限公司。低速台式离心机(中国上海安亭科学仪器厂),酶标仪(中国深圳雷杜生命科学股份有限公司),超净工作台(中国苏州安泰空气技术有限公司),二氧化碳培养箱(日本三洋公司),倒置显微镜(中国沈阳禾光科技有限公司)。
1.3 三维细胞培养倒置显微镜下观察A549细胞生长至细胞培养瓶底约90 %时,加入PBS溶液清洗,胰蛋白酶消化,离心,血球计数板计数,制成浓度为1×105/mL细胞悬液,3D细胞培养基质胶50 μL/孔加入96孔板,置于37 ℃烘箱过夜烘干,即可得到ULA96孔板,而后100 μL/孔加入ULA 96孔板中,放置于37 ℃、5 % 培养箱中培养,隔天换液。
1.4 药物处理空白对照组肺癌A549细胞在RPMI 1640培养基中培养;根据丙泊酚浓度分为低浓度组(20 μmol/L)、中浓度组(60 μmol/L)和高浓度组(100 μmol/L),分别处理细胞[9],每组设置6个平行样品。
1.5 CCK-8法检测细胞增殖A549细胞于ULA 96孔板培养48 h后,小心吸除各孔培养基,每孔加入20 μL药物,空白组加入同等体积的培养基。继续培养24、48、72 h,小心吸出孔内液体,每孔加入20 μL CCK-8溶液作用2 h,酶标仪520 nm记录吸光度值,计算细胞存活率。
1.6 ELISA检测细胞上清炎性细胞因子将A549细胞以每孔5×105/mL接种于ULA 24孔板,培养24 h后,按照1.4中方法分组处理细胞,培养48 h,12 000 r/min离心30 min,收集上清,ELISA试剂盒检测上清IL-18、IL-1β、IL-6水平。
1.7 蛋白免疫印迹法检测细胞焦亡蛋白表达水平按照1.4中方法分组处理细胞,48 h后弃培养液,将细胞收集于EP管内离心3 min,预冷PBS清洗细胞3次,加入含蛋白酶抑制剂RIPA裂解液,冰上裂解30 min,12 000 r/min离心10 min,收集上清即为细胞总蛋白,BCA蛋白测定试剂盒测定蛋白总浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,转移至聚偏氟乙烯膜后,脱脂奶粉封闭2 h,加入兔抗人NLRP3、ASC、caspase-1、GSDMD-N、IL-1β、GAPDH一抗(1∶2 000稀释),4 ℃冰箱孵育过夜,PBST洗涤30 min后加入相应二抗(1∶4 000稀释)孵育2 h,配制ECL显影液,以GAPDH为内参,分析目的蛋白表达水平。
1.8 统计学分析采用SPSS 26.0软件进行统计分析,符合正态分布的数据以x±s表示,组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 A549细胞三维生物学行为三维培养A549细胞于光学显微镜下呈悬浮聚集式生长,细胞间有聚拢黏附趋势,在培养12 h即可清晰观察到细胞成球,且细胞球形状、大小不一。随着培养时间的增长,细胞球体积逐渐增大,且逐渐圆滑。见图 1。

|
| A, 12 h; B, 24 h; C, 48 h; D, 72 h. 图 1 不同培养时间段A549细胞形态 ×200 Fig.1 Morphology of A549 cells in different culture periodsS ×200 |
2.2 丙泊酚对A549细胞增殖的影响
与空白对照组相比,低、中、高浓度丙泊酚组A549细胞存活率随着处理时间和丙泊酚剂量的增加逐渐降低(P < 0.05)。见表 1。
| Group | Cell viability | ||
| 24 h | 48 h | 72 h | |
| Control | 100.0±0.0 | 100.0±0.0 | 100.0±0.0 |
| Low concentration | 95.6±13.51) | 89.1±11.71) | 76.8±14.31) |
| Medium concentration | 72.8±10.41),2) | 61.3±10.31),2) | 49.7±12.21),2) |
| High concentration | 58.3±11.81),2),3) | 45.7±12.71),2),3) | 25.9±13.51),2),3) |
| 1)compared with control group,P < 0.05;2)compared with low concentration group,P < 0.05;3)compared with medium concentration group,P < 0.05. | |||
2.3 丙泊酚对A549细胞上清炎性细胞因子的影响
与空白对照组相比,低、中、高浓度丙泊酚组A549细胞上清炎性细胞因子IL-18、IL-1β、IL-6水平随着药物剂量的增加而增加(P < 0.05)。见表 2。
| Group | IL-18(ng/L) | IL-1β(μg/L) | IL-6(pg/mL) |
| Control | 64.28±6.33 | 1.06±0.59 | 110.36±11.25 |
| Low concentration | 118.49±11.751) | 2.36±0.751) | 135.48±16.531) |
| Medium concentration | 159.64±20.181),2) | 3.14±0.841),2) | 187.64±20.361),2) |
| High concentration | 276.38±35.571),2),3) | 4.36±0.911),2),3) | 228.41±29.671),2),3) |
| 1)compared with control group,P < 0.05;2)compared with low concentration group,P < 0.05;3)compared with medium concentration group,P < 0.05. | |||
2.4 丙泊酚对A549细胞NLRP3、ASC、caspase-1、GSDMD-N、IL-1β蛋白表达的影响
与空白对照组相比,低、中、高浓度丙泊酚组A549细胞NLRP3、ASC、caspase-1、GSDMD-N、IL-1β蛋白表达水平依次增加(P < 0.05)。见图 2、表 3。

|
| 1, control group; 2, low concentration group; 3, medium concentration group; 4;high concentration group. 图 2 各组A549细胞NLRP3、ASC、caspase-1、GSDMD-N、IL-1β蛋白表达 Fig.2 Expression of NLRP3, ASC, caspase-1, GSDMD-N, and IL-1β in A549 cells of each group |
| Group | NLRP3 | ASC | Caspase-1 | GSDMD-N | IL-1β |
| Control | 0.63±0.04 | 1.12±0.11 | 0.87±0.09 | 1.36±0.19 | 1.42±0.21 |
| Low concentration | 1.24±0.121) | 1.51±0.191) | 1.34±0.131) | 1.93±0.251) | 2.01±0.291) |
| Medium concentration | 1.67±0.151),2) | 2.15±0.251),2) | 1.96±0.191),2) | 2.64±0.311),2) | 2.98±0.371),2) |
| High concentration | 2.01±0.191),2),3) | 2.97±0.291),2),3) | 2.61±0.241),2),3) | 3.28±0.451),2),3) | 3.57±0.491),2),3) |
| 1)compared with control group,P < 0.05;2)compared with low concentration group,P < 0.05;3)compared with medium concentration group,P < 0.05. | |||||
3 讨论
肺癌作为最常见的恶性肿瘤,其发病率、死亡率高,选择合适的化疗药物及治疗手段有助于肺癌疾病的治疗和预后,肿瘤细胞与微环境的相互作用直接影响肿瘤的生长、转移、侵袭和复发,肿瘤细胞间及与细胞质基质间的相互作用将产生肿瘤黏附耐药,导致肿瘤细胞对化疗药物的敏感性降低,影响化疗药物的疗效[10]。
超低吸附培养法为肿瘤细胞三维培养方法,细胞培养板孔底附着与表面共价键结合的水凝胶,能最大限度地减少肿瘤细胞附着、细胞活化、蛋白质吸收和酶活化,使肿瘤细胞以三维模型成球生长 [11]。TOFANI等[12]采用ULA法培养卵巢癌细胞并使用紫杉醇进行药物反应分析,结果表明卵巢癌细胞以球形发育,球体表面存在微绒毛,凋亡细胞更高,耐药性也更高。
丙泊酚一直以麻醉剂形式广泛应用于手术麻醉过程。丙泊酚在作为非麻醉剂应用时,是癌症进展的新兴调节剂,可调控肿瘤细胞增殖、凋亡、焦亡、转移与侵袭等信号通路,广泛应用于人类多种癌症研究[13]。本研究结果显示,不同浓度丙泊酚处理后,A549细胞存活率随着丙泊酚浓度的增加而依次降低,证明丙泊酚可抑制肺癌A549细胞增殖。
细胞焦亡是一种新型细胞程序性死亡方式,在病毒、细菌、炎症等病理刺激下,NLRP3炎症小体形成,进而激活caspase-1。活化的caspase-1作用于GSDMD-N端,在细胞膜上形成孔洞,细胞肿胀破裂,细胞内容物释放,细胞焦亡会释放炎性细胞因子,激发人体免疫系统进而产生抗炎作用,细胞焦亡发生在肿瘤细胞中时,IL-18、IL-1β、IL-6等炎性细胞因子在肿瘤细胞中起抑制作用[6]。
NLRP3/ASC/caspase-1通路是细胞焦亡经典通路,NLRP3炎症小体的形成促进caspase-1激活,caspase-1活化水解后产生IL-18、IL-1β等炎性细胞因子,同时caspase-1激活GSDMD,使其转移到细胞膜上形成孔洞,将IL-1β、IL-18等炎性细胞因子释放到胞外,IL-18、IL-1β等炎性细胞因子又可以作用于肿瘤细胞发挥抗癌作用[14]。本研究中,丙泊酚作用于肺癌A549细胞后,蛋白免疫印迹检测细胞焦亡蛋白表达,结果显示,丙泊酚激发了肿瘤细胞的细胞焦亡过程,促进了细胞焦亡相关蛋白表达;通过酶联免疫吸附法测定上清炎性细胞因子,结果显示,细胞焦亡会促进炎性细胞因子的释放,证明了肺癌A549细胞焦亡的发生,且肿瘤细胞生长受到抑制。
综上所述,本研究通过超低吸附培养法成功建立肺癌A549三维培养模型,丙泊酚可能通过激活NLRP3/ASC/caspase-1细胞焦亡通路促进肺癌A549细胞焦亡,从而抑制A549细胞增殖。本研究重点研究三维培养肺癌A549细胞的细胞焦亡过程,为肺癌的治疗和研究提供了一定的依据。
| [1] |
LI X, SHI H, ZHANG W, et al. Immunotherapy and targeting the tumor microenvironment: current place and new insights in primary pulmonary NUT carcinoma[J]. Front Oncol, 2021, 11: 690115. DOI:10.3389/fonc.2021.690115 |
| [2] |
RODAK O, PERIS-DÍAZ MD, OLBROMSKI M, et al. Current landscape of non-small cell lung cancer: epidemiology, histological classification, targeted therapies, and immunotherapy[J]. Cancers, 2021, 13(18): 4705. DOI:10.3390/cancers13184705 |
| [3] |
YANG TF, ZHU MH, JIANG M, et al. Current status of iridium-based complexes against lung cancer[J]. Front Pharmacol, 2022, 13: 1025544. DOI:10.3389/fphar.2022.1025544 |
| [4] |
CUI C, ZHANG DW, SUN K, et al. Propofol maintains Th17/Treg cell balance in elderly patients undergoing lung cancer surgery through GABAA receptor[J]. BMC Immunol, 2022, 23(1): 1-15. DOI:10.1186/s12865-022-00490-8 |
| [5] |
WU ZC, WANG H, SHI ZA, et al. Propofol prevents the growth, migration, invasion, and glycolysis of colorectal cancer cells by downregulating lactate dehydrogenase both in vitro and in vivo[J]. J Oncol, 2022, 2022: 1-11. DOI:10.1155/2022/8317466 |
| [6] |
TONG XH, TANG R, XIAO MM, et al. Targeting cell death pathways for cancer therapy: recent developments in necroptosis, pyroptosis, ferroptosis, and cuproptosis research[J]. J Hematol Oncol, 2022, 15(1): 174. DOI:10.1186/s13045-022-01392-3 |
| [7] |
何欢欢, 宋新强, 王帅. 细胞焦亡在癌症发生发展及治疗中作用的研究进展[J]. 中国药理学与毒理学杂志, 2022, 36(7): 536-543. DOI:10.3867/j.issn.1000-3002.2022.07.008 |
| [8] |
CADAVID VARGAS JF, VILLA PEREZ C, SORIA DB, et al. Enhanced antitumor effect of l-buthionine sulfoximine or ionizing radiation by copper complexes with 2, 2'-biquinoline and sulfonamides on A5492D and 3D lung cancer cell models[J]. JBIC J Biol Inorg Chem, 2022, 27(3): 329-343. DOI:10.1007/s00775-022-01933-8 |
| [9] |
张永强, 刘俊, 陈胜阳, 等. 异丙酚影响基质金属蛋白酶对肺腺癌细胞株增殖侵袭能力的作用[J]. 实用医学杂志, 2018, 34(3): 357-361. DOI:10.3969/j.issn.1006-5725.2018.03.005 |
| [10] |
WALIA HK, SHARMA P, SINGH N, et al. Immunotherapy in small cell lung cancer treatment: a promising headway for future perspective[J]. Curr Treat Options Oncol, 2022, 23(2): 268-294. DOI:10.1007/s11864-022-00949-1 |
| [11] |
GAVA F, FARIA C, GRAVELLE P, et al. 3D model characterization by 2D and 3D imaging in t (14;18)-positive B-NHL: perspectives for in vitro drug screens in follicular lymphoma[J]. Cancers, 2021, 13(7): 1490. DOI:10.3390/cancers13071490 |
| [12] |
TOFANI LB, ABRIATA JP, LUIZ MT, et al. Establishment and characterization of an in vitro 3D ovarian cancer model for drug screening assays[J]. Biotechnol Prog, 2020, 36(6): e3034. DOI:10.1002/btpr.3034 |
| [13] |
裴圣林, 荆忍, 潘灵辉. 全身麻醉药对癌症转移、复发的影响研究进展[J]. 中国癌症防治杂志, 2021, 13(2): 113-120. DOI:10.3969/j.issn.1674-5671.2021.02.01 |
| [14] |
杜洋, 邱鹏程, 王媛媛, 等. 海星皂苷CN-3激活NLRP3/Caspase-1/GSDMD信号通路诱导胶质瘤细胞焦亡的作用[J]. 环球中医药, 2022, 15(11): 2022-2029. DOI:10.3969/j.issn.1674-1749.2022.11.005 |
 2024, Vol. 53
2024, Vol. 53