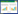文章信息
- 吴振涛, 祝立丽, 刘运峰, 徐学刚, 高兴华, 郭雅欣
- SERPINB7复合杂合突变所致长岛型掌跖角化症家系1例报道
- A family with Nagashima-type palmoplantar keratosis owing to a compound heterozygous mutation in the SERPINB7 gene: a case report
- 中国医科大学学报, 2024, 53(12): 1142-1145
- Journal of China Medical University, 2024, 53(12): 1142-1145
-
文章历史
- 收稿日期:2023-11-16
- 网络出版时间:2024-12-09 12:15:52
2. 辽宁省人民医院皮肤科, 沈阳 110016;
3. 辽宁省人民医院应急办, 沈阳 110016;
4. 中国医科大学附属第一医院皮肤科, 教育部和国家卫生健康委员会免疫皮肤病学重点实验室, 免疫性皮肤病诊疗国家地方联合工程研究中心, 沈阳 110001
长岛型掌跖角化症(Nagashima-type palmoplantar keratosis,NPPK)是一种罕见的常染色体隐性遗传性皮肤病,以掌跖部位对称性弥漫性红斑、丘疹、斑块、角化过度、脱屑为特征,可扩展至手背、手指、腕部、足背及跟腱区皮肤,常伴手足多汗、异味及真菌感染,也可累及肘膝等受摩擦部位[1]。病情变化不受季节影响,患病率无性别差异[2]。已报道的患者绝大多数来自日本及中国,日本人群的估计患病率约为1.2/10 000,我国人群约为3.1/10 000[3]。本研究报道了1例丝氨酸蛋白酶抑制剂B7(serine protease inhibitor B7,SERPINB7)基因突变所致NPPK的患儿家系。
1 临床资料患儿,男,8岁,以“手足红斑、脱屑伴瘙痒5年”为主诉就诊。5年来患儿出现手足部弥漫性红斑、脱屑,境界清楚,始于足部,有时瘙痒,夏季加重。近1周来左膝伸侧红斑、脓疱,有时瘙痒。手足易出汗。未行规律或系统治疗。患儿发育正常,无牙齿、指/趾甲、毛发等外胚层受累,既往健康,否认其他器官系统异常。皮肤科查体:双手掌(图 1A、1B)、足跖(图 1C)弥漫红斑、斑片、角化,左膝伸侧(图 1D )红斑、丘疹、脓疱、轻度角化。足臭明显。手部在水中浸泡10 min后变白,呈海绵状改变(图 1A、1B)。双侧口角红斑、脱屑(图 1E)。辅助检查:左膝、足跖真菌镜检阴性。口角真菌镜检阳性。患儿父母非近亲结婚,患儿父亲既往诊断为“足癣”,双手掌及足底可见弥漫性红斑(图 1F、1G),母亲及其他家族成员无相关表现。予患儿手足部葡萄糖酸氯己定浸泡2次/d,硼酸水杨酸软膏外涂2次/d,左膝皮疹夫西地酸外涂2次/d,双侧口角皮疹硝酸咪康唑乳膏外涂2次/d。45 d后双手皮肤角化缓解、变软,手足异味略缓解,左膝及双侧口角皮疹消退。

|
| A,患儿双手弥漫性境界清楚的红斑,左手于水中浸泡10 min后红斑处变白,呈海绵状改变;B,患儿双手掌弥漫性红斑;C,患儿双足跖弥漫性境界清楚的红斑;D,患儿左膝伸侧红斑、丘疹、脓疱、轻度角化;E,患儿双口角红斑、脱屑;F,患儿父亲双手掌弥漫性红斑;G,患儿父亲双足跖弥漫性红斑. 图 1 患儿家系临床表现 |
经患儿及其监护人同意并签署知情同意书,抽取患儿及其父母共3人的外周血各4 mL,置于EDTA二甲盐抗凝管中,-20 ℃保存,提取总DNA,行全外显子组测序。使用Illumina HiSeq2500测序平台高通量测序后进行生物信息学分析,数据分析流程参照既往文献[4-5]。本研究已获得中国医科大学附属第一医院医学科学研究伦理委员会批准(2017-112-2)。
全外显子组测序结果显示,患儿SERPINB7基因复合杂合突变,8号外显子核苷酸序列第796位碱基由C突变为T(c.796C > T)(图 2A),导致其编码蛋白质在第266位氨基酸终止(p.R266*),为无义突变,根据ACMG指南,此变异评级为致病;6号外显子核苷酸序列第455位核苷酸由G突变为T(c.455G > T)(图 2D),导致其编码的第152位蛋白质由甘氨酸变为缬氨酸(p.G152V),为错义突变,变异评级为可疑致病。患儿父亲携带c.796C > T(图 2B),p.R266*杂合突变,患儿母亲携带c.455G > T(图 2F),p.G152V杂合突变。

|
| A,患儿SERPINB7基因8号外显子核苷酸序列第796位碱基由C突变为T(c.796C > T);B,患儿父亲SERPINB7基因亦携带c.796C > T突变;C,患儿母亲SERPINB7基因第796位碱基无突变;D,患儿SERPINB7基因6号外显子核苷酸序列第455位碱基由G突变为T(c.455G > T);E,患儿父亲SERPINB7基因第455位碱基无突变;F,患儿母亲SERPINB7基因亦携带c.455G > T突变. 图 2 患儿家系基因测序峰图 |
2 讨论
掌跖角化症(palmoplantar keratosis,PPK)是一组以显著的手掌和足跖皮肤角化过度为特征的皮肤病,可为先天性或后天获得,分为弥漫性、局灶性及点状PPK。NPPK属于弥漫性非表皮松解性非残毁性PPK,属常染色体隐性遗传模式,表现为出生至3岁以内出现手足部皮肤境界清楚的弥漫性红斑、脱屑、角化过度,面积通常不会超过手足背的1/2,常伴手足多汗症及真菌感染,皮疹进展缓慢,远期预后良好[6]。该病于1977年在日本长岛被首次报道,故命名为NPPK。NPPK组织病理无特异性,主要表现为表皮角化过度,棘层及颗粒层增厚,无表皮松解,真皮浅层可见少量炎症细胞浸润及毛细血管扩张[1]。NPPK目前尚缺乏规范的诊断标准。
KUBO等[3]于2013年通过全外显子测序分析确定了SERPINB7是NPPK的致病基因[2],迄今已发现24个突变位点。SERPINB7位于常染色体18q21.3,编码由8个外显子、380个氨基酸组成的SERPINB7蛋白,发挥抑制丝氨酸蛋白酶的作用[3]。SERPINB7的突变可能导致SERPINB7蛋白酶抑制活性的丧失,引起角质层及颗粒层中目标蛋白酶过度激活而致病。此外,表皮受到的细菌、真菌、病毒等外界环境刺激及来自浸润细胞的内源性攻击均参与本病的发病过程。2014年至2022年,我国学者以病例报道或病例系列的形式报道了约34例NPPK病例。2022年LIU等[7]完成了1项我国NPPK患者的横断面研究,纳入234例基因诊断的患者,是目前报道的样本量最大的NPPK相关研究,重新估计了我国NPPK的患病率约为0.975/10 000,发现纯合突变占65.8%,余34.2%为复合杂合突变,且与国际报道数据一致,SERPINB7 c.796C > T(75.9%)纯合或合并其他功能缺失性杂合突变是最常见的突变方式[7],提示此突变存在祖先效应。c.522dupT(14.1%)、c.650_653delCTGT(5.1%)、c.455G > T(2.6%)的突变频率仅低于c.796C > T,可能是我国人群的潜在创始人突变[7-8],既往报道的其余突变位点包括c.2T > C、c.122_127delTGGTCC、c.218_219del2ins12、c.271delC、c.309delT、c.336+2T > G、c.382C > T、c.434delG、c.455-1G > A、c.455-16A > G、c.522_523insT、c.530T > C、c.635delG、c.643A > G、c.656T > C、c.754-553T > G、c.830C > T、c.832C > T、c.1036G > T、c.1136G > A、c.5252T [8-10],未发现明显的基因型-表型相关性。2020年芬兰学者[11]报道了3例非亚洲NPPK患者携带亚洲人群中未检测出的c.1136G > A突变位点,可能是非亚洲患者的一个始祖突变。
NPPK需与非典型轻型Mal de Meleda(MDM)、进行性对称性红斑角化症及其他类型弥漫性PPK等相鉴别。MDM是由SLURP1基因突变引起的常染色体隐性遗传病,属于弥漫性非表皮松解性残毁性PPK,好发于克罗地亚的梅勒达岛,患者出生不久即可出现进行性越线角化过度,病程呈进展性,可出现多汗、浸渍、严重恶臭和皲裂,手指的角化过度可导致指端硬化及指/趾缢痕,可伴频繁的重叠感染、甲受累、口角炎等[12]。KRT9/KRT1突变引起的Vorner-Unna-Thost型PPK、KRT1基因突变引起的Kimonis型PPK和AQP5基因突变引起的Bothnia型PPK均为常染色体显性遗传所致的弥漫性PPK,可通过基因检测进行鉴别诊断。后者受累面积超过手足背的1/2,一般不累及手足外的其他部位,多汗、浸水后发白、肿胀等表现较NPPK更严重,也可伴轻度甲改变。进行性对称性红斑角化症也属于常染色体显性遗传病,常先出现掌跖对称性红斑、角化表现,后可蔓延至手足背、胫前、四肢连接处伸侧等身体其他部位,多呈进行性病程,我国汉族人少见。
本例患儿根据其临床表现及基因变异,即可诊断为NPPK,并未完善皮肤病理学检查。近十年来,随着基因检测的普及,越来越多的NPPK患者确诊并被报道。本研究利用全外显子测序技术从基因水平上诊断了NPPK,使患儿避免了皮肤组织病理等有创检查,基因诊断也有助于为患者提供遗传咨询。但仍有不少患者可能因临床医师对NPPK认识不足而误诊为其他疾病,这也体现了基因检测的价值。
我国的大样本研究[7]发现儿童患者主要表现为掌跖脱皮,可作为早期识别NPPK的标志,成人患者主要表现为掌跖鳞屑。40.0%NPPK患者合并甲真菌病,36.8%合并湿疹或特应性皮炎,30.3%合并足癣,14.2%合并手癣,也有个别患者伴有荨麻疹、鼻炎、哮喘及黑色素瘤[7]。成人患者较儿童患者足癣、甲真菌病及跟腱红斑角化的发病率更高,儿童则更易合并湿疹或特应性皮炎[7]。本例患儿除经典的手足部弥漫性红斑、角化外,单侧膝部也出现类似皮疹,且双口角红斑、脱屑,真菌镜检阳性。既往文献[7, 13-14]报道,个别患者可合并耳角化过度和趾甲营养不良,但未曾报道口角受累,故其是否与NPPK相关有待商榷。该患儿皮疹处存在瘙痒感,夏季加重,这与既往报道的表型不一致,有待后续进一步观察。患儿父亲携带c.796C > T杂合突变,但也有手足部弥漫性红斑的轻微表型。既往报道[5, 15-16]NPPK符合常染色体隐性遗传模式,SERPINB7纯合或复合杂合突变致病,而单一杂合突变多不发病,但也有少数单等位基因突变病例的报道,这与患儿父亲情况一致,这种伪显性遗传模式被认为可能是由于当前检测技术局限,以致未能检测出另一等位基因的突变。
NPPK患者的生活质量出现中度下降,几乎所有患者在病程中均曾接受过治疗,但仅能暂时缓解,停药后很快复发,故早期诊断和临床干预非常重要[7]。目前NPPK尚无特效的治疗方法,主要应用维甲酸乳膏、他扎罗汀或激素软膏等外用治疗缓解角化过度症状,局部外用10%硫酸铝钾洗剂及2.5%过氧化苯甲酰凝胶缓解手足多汗及异味[10]。由于皮损部位T细胞浸润,有研究[17]证明免疫抑制疗法,如0.1%他克莫司软膏,可能较外用激素更具有治疗潜力,改善红斑角化症状的效果更佳。合并真菌感染的患儿,给予外用抗真菌药可好转,但停药后易复发。研究[17]发现庆大霉素可促进SERPINB7 cDNA中c.796C > T的通读,缓解NPPK患者皮肤角化过度及手足异味,但对红斑无明显疗效。总之,皮肤科医生需提高对NPPK的认识,其标准化诊疗也有待进一步完善。
| [1] |
KABASHIMA K, SAKABE JI, YAMADA Y, et al. "Nagashima-type" keratosis as a novel entity in the palmoplantar keratoderma category[J]. Arch Dermatol, 2008, 144(3): 375-379. DOI:10.1001/archderm.144.3.375 |
| [2] |
HUANG C, YANG YL, HUANG XY, et al. Nagashima-type palmoplantar keratosis: clinical characteristics, genetic characterization, and clinical management[J]. Biomed Res Int, 2021, 2021: 8841994. DOI:10.1155/2021/8841994 |
| [3] |
KUBO A, SHIOHAMA A, SASAKI T, et al. Mutations in SERPINB7, encoding a member of the serine protease inhibitor superfamily, cause Nagashima-type palmoplantar keratosis[J]. Am J Hum Genet, 2013, 93(5): 945-956. DOI:10.1016/j.ajhg.2013.09.015 |
| [4] |
GONG L, LIU CC, LI YH, et al. Whole exome sequencing identified two point mutations of COL7A1 and FLG in a Chinese family with dystrophic epidermolysis bullous pruriginosa and ichthyosis vulgaris[J]. J Dermatol, 2019, 46(2): 158-160. DOI:10.1111/1346-8138.14731 |
| [5] |
曹聪慧, 曹艳丽, 王晓黎. SCN4A基因突变导致的低钾性周期性麻痹2例报道并文献复习[J]. 中国医科大学学报, 2023, 52(8): 761-765. DOI:10.12007/j.issn.0258-4646.2023.08.017 |
| [6] |
ZHANG J, ZHANG GL, NI C, et al. Nagashima-type palmoplantar keratosis in a Chinese Han population[J]. Mol Med Rep, 2016, 14(5): 4049-4054. DOI:10.3892/mmr.2016.5757 |
| [7] |
LIU J, CHEN ZM, HU LH, et al. Investigation of Nagashima-type palmoplantar keratoderma in China: a cross-sectional study of 234 patients[J]. J Dermatol, 2023, 50(3): 375-382. DOI:10.1111/1346-8138.16621 |
| [8] |
HIDA T, OKURA M, KAMIYA T, et al. Nagashima-type palmoplantar keratosis caused by compound heterozygous mutations in SERPINB7[J]. Eur J Dermatol, 2015, 25(2): 202-203. DOI:10.1684/ejd.2014.2515 |
| [9] |
XIAO T, LIU Y, WANG T, et al. Two novel mutations of SERPINB7 in eight cases of Nagashima-type palmoplantar keratosis in the Chinese population[J]. J Dermatol, 2022, 49(5): 539-544. DOI:10.1111/1346-8138.16310 |
| [10] |
王昕怡, 李明. 长岛型掌跖角化症的研究进展[J]. 中国麻风皮肤病杂志, 2022, 38(9): 646-649. DOI:10.12144/zgmfskin202209646 |
| [11] |
HANNULA-JOUPPI K, HARJAMA L, EINARSDOTTIR E, et al. Nagashima-type palmoplantar keratosis in Finland caused by a SERPINB7 founder mutation[J]. J Am Acad Dermatol, 2020, 83(2): 643-645. DOI:10.1016/j.jaad.2019.11.004 |
| [12] |
BAKIJA-KONSUO A. Mal de meleda - through history and today[J]. Acta Dermatovenerol Croat, 2014, 22(2): 79-84. |
| [13] |
NONOMURA Y, OTSUKA A, MIYACHI Y, et al. Suspected Nagashima-type palmoplantar keratosis with atypical hyperkeratotic lesions on the ears[J]. Eur J Dermatol, 2012, 22(3): 392-393. DOI:10.1684/ejd.2012.1676 |
| [14] |
NAKAMIZO S, KATOH N, MIYACHI Y, et al. Atypical nail dystrophy in a possible case of Nagashima-type palmoplantar keratosis[J]. J Dermatol, 2012, 39(5): 470-471. DOI:10.1111/j.1346-8138.2011.01326.x |
| [15] |
HASHIMOTO T, TEYE K, NUMATA S, et al. Detection of SERPINB7 mutation can distinguish Nagashima-type palmoplantar keratoderma from other keratodermas with palmoplantar lesions[J]. Clin Exp Dermatol, 2017, 42(3): 342-345. DOI:10.1111/ced.13059 |
| [16] |
MIZUNO O, NOMURA T, SUZUKI S, et al. Highly prevalent SERPINB7 founder mutation causes pseudodominant inheritance pattern in Nagashima-type palmoplantar keratosis[J]. Br J Dermatol, 2014, 171(4): 847-853. DOI:10.1111/bjd.13076 |
| [17] |
OHGUCHI Y, NOMURA T, SUZUKI S, et al. Gentamicin-induced readthrough and nonsense-mediated mRNA decay of SERPINB7 nonsense mutant transcripts[J]. J Invest Dermatol, 2018, 138(4): 836-843. DOI:10.1016/j.jid.2017.10.014 |
 2024, Vol. 53
2024, Vol. 53