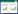文章信息
- 蔡琳琳, 马晶茹
- CAI Linlin, MA Jingru
- 组织蛋白酶D在急性ST段抬高型心肌梗死后心血管事件中的作用
- Role of cathepsin D in cardiovascular events following acute ST-segment elevation myocardial infarction
- 中国医科大学学报, 2024, 53(10): 929-933
- Journal of China Medical University, 2024, 53(10): 929-933
-
文章历史
- 收稿日期:2024-06-07
- 网络出版时间:2024-10-10 14:52:51
急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是临床上最严重的心血管疾病之一[1]。经皮冠状动脉介入术(percuta-neous coronary intervention,PCI)是治疗STEMI的有效手段[2],但开通血管时会发生再灌注损伤,伴随一定程度的自噬通量升高。然而,心肌细胞高度依赖完整的自噬维持其生理功能并应对损伤[3-5]。组织蛋白酶D(cathepsin D,CTSD)是胃蛋白酶家族中的一种溶酶体酶[6],与自噬密切相关,并存在于自噬过程中的自溶酶体中[7]。CTSD升高时,可通过参与自噬过程使心肌细胞对应激性损伤表现出良好的适应性,抵消损伤后细胞坏死或凋亡[8-9]。也有研究[10]表明,过度自噬会对机体产生不良影响。关于STEMI患者心肌损伤不同时期CTSD的表达情况,以及能否根据其表达量制定STEMI治疗方案并判断预后,目前尚无明确结论。因此,本研究拟探讨全血CTSD表达量在STEMI患者心肌损伤及PCI治疗后6个月心血管事件中的作用。
1 材料与方法 1.1 研究对象选取2022年11月至2023年7月沈阳医学院附属第二医院心血管内科收治的STEMI患者96例作为STEMI组,所有患者符合《2023 ESC急性冠脉综合征治疗指南》[11]中STEMI的诊断及治疗标准,首次确诊且于发病12 h内行急诊PCI治疗,其中,男79例,女13例。另选取同期冠状动脉造影(coronary arterio-graphy,CAG)正常住院患者20例作为对照组,所有患者CAG无任意一条冠状动脉管腔直径狭窄≥50%,排除冠状动脉粥样硬化性心脏病[12]。纳入标准:年龄18~85岁,临床资料及生化检测结果完整。排除标准:患有心脏相关疾病(既往STEMI、心力衰竭、心肌病、中度至重度心脏瓣膜病、心包疾病);近6个月内有严重外伤或外科手术史;颅脑退行性疾病;免疫相关疾病(如类风湿关节炎);恶性肿瘤;肾功能异常。本研究获得沈阳医学院附属第二医院医学伦理委员会批准(2023-沈医二院-083)。所有研究对象签署知情同意书。
1.2 研究方法 1.2.1 临床资料收集及随访通过我院院内医疗系统软件查询及电话随访方式,收集患者的临床资料。(1)一般临床资料:年龄、性别、吸烟史、饮酒史、既往病史。(2)实验室血生化指标:C反应蛋白(C-reactive protein,CRP),白细胞计数(white blood cell,WBC),血小板计数(platelet count,PLT),肌钙蛋白T(troponin T,cTnT),N末端B型利尿钠肽(N-terminal pro-B-type natriuretic peptide,NT-proBNP),高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C),低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。(3)超声心动图指标:左室射血分数(left ventricular ejection fraction,LVEF)。(4)冠状动脉Gensini评分[13]:评分=病变节段的狭窄评分×病灶部位系数之和。(5)心肌梗死院外发病时间[14]。回访患者自PCI术后起6个月内,发生主要不良心血管事件(major adverse cardiovascular event,MACE)[15]情况,包括再发非计划内的心绞痛住院,复发性非致死性心肌梗死,再次非计划内的血运重建,新发心力衰竭和心源性死亡。本研究中共3例失访,1例非心源性死亡,最终共92例患者纳入分析。
1.2.2 血液样本收集STEMI组及对照组均在术前完善检查。在CAG术中经造影导管分别采集冠状动脉血3 mL,术后立即放置-80℃冰箱保存。所有标本未出现溶血、脂血。
1.2.3 实时定量PCR检测全血CTSD mRNA表达使用TRIzol试剂提取全血总RNA,用NanoDrop2000检测RNA浓度,用逆转录试剂盒逆转录生成cDNA。实时定量PCR检测CTSD mRNA表达。PCR反应体系:冰浴条件下加入TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus 2×)10 μL、正向/反向引物各0.8 μL、ROX Reference DyeⅡ(50×)0.4 μL、cDNA模板1 μL、ddH2O 2 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火/延伸30 s,共45个循环;实验重复3次。CTSD引物序列:正向5’-GACATCCACTATGGCTCGGG-3’,反向5’-TAGTGGAAGTAGCGTCGGTT-3’。GAPDH引物序列:正向5’-GACAGTCAGCCGCATCTTCT-3’,反向5’-CTAAACCAGCATAACCCGCG-3’。用2-ΔΔCt法计算mRNA相对表达量。
1.3 统计学分析采用SPSS 28.0软件对数据进行统计学分析。检验计量资料的正态性及方差齐性,正态分布计量资料用x±s表示,并用两独立样本t检验或单因素方差分析比较;偏态分布计量资料用M (P25~P75)表示,并用Mann-Whitney U检验或Kuskal-Wallis H检验比较,事后两两比较用Bonferroni检验校正。计数资料用率(%)表示,并用χ2检验比较,优势比(odds ratio,OR)以其95%可信区间(confidence interval,CI)计算,绘制受试者操作特征(receiver operating characteristic,ROC)曲线评价其预测值。经双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 不同CTSD表达水平STEMI患者一般资料比较按照CTSD表达量三分位数,将STEMI组92例患者分为低CTSD(< 1.18)组(31例)、中CTSD(1.18~1.62)组(31例)及高CTSD(> 1.62)组(30例)。3组患者年龄、性别、吸烟史、饮酒史、高血压史、糖尿病史、心肌梗死院外发病时间、LVEF、CRP、WBC、LDL-C、Gensini评分比较,差异无统计学意义(P > 0.05);3组患者PLT、cTnT、NT-proBNP、HDL-C比较,差异有统计学意义(P < 0.05)。见表 1。
| Item | Low CTSD group(n = 31) | Medium CTSD group(n = 31) | High CTSD group(n = 30) | Z/H | P |
| CTSD mRNA expression level | < 1.18 | 1.18-1.62 | > 1.62 | - | - |
| Age(year) | 60(49-67) | 65(45-70) | 59(45-67) | 0.977 | 0.614 |
| Male[n(%)] | 27(34.20) | 27(34.20) | 25(31.60) | 0.233 | 0.890 |
| Smoking history[n(%)] | 10(33.30) | 9(30.00) | 11(36.70) | 0.309 | 0.857 |
| Drinking history[n(%)] | 9(36.00) | 6(24.00) | 10(40.00) | 1.380 | 0.501 |
| History of hypertension[n(%)] | 17(35.40) | 16(33.30) | 15(31.30) | 0.148 | 0.929 |
| History of diabetes[n(%)] | 12(41.40) | 11(37.90) | 6(20.70) | 2.900 | 0.235 |
| LVEF(%) | 56.50(54.50-58.25) | 58(53.75-59.00) | 58(54.75-59.00) | 1.705 | 0.426 |
| PLT(×109/L) | 11.54±3.56 | 11.28±4.06 | 11.19±3.721) | 3.825 | 0.025 |
| cTnT(ng/mL) | 4.35(2.69-8.15) | 5.38(2.90-8.75) | 2.02(0.49-4.04)1),2) | 11.839 | 0.003 |
| NT-proBNP(ng/mL) | 1 302.90(820.55-4 528.00) | 1 307.65(467.30-2 045.65) | 802(417.40-1 566.05)1),2) | 6.470 | 0.039 |
| HDL-C(mmol/L) | 0.91(0.78-0.97) | 0.92(0.81-1.20) | 1.09(0.96-1.37)2) | 14.494 | 0.001 |
| LDL-C(mmol/L) | 2.44(1.90-2.70) | 2.75(2.28-3.63) | 2.86(1.86-3.70) | 2.328 | 0.312 |
| CRP(mg/dL) | 10.00(9.00-13.82) | 12.50(3.98-23.75) | 10.00(3.91-15.00) | 3.003 | 0.223 |
| WBC(×109/L) | 220.00±51.42 | 208.42±57.22 | 246.90±57.90 | 0.071 | 0.931 |
| Gensini score | 70.00(46.00-102.00) | 69.00(50.00-96.00) | 55.50(42.75-90.00) | 2.059 | 0.357 |
| Out-of-hospital onset time of myo-cardial infarction < 4 h[n(%)] | 24(36.90) | 24(36.90) | 17(26.20) | 4.154 | 0.125 |
| 1)P < 0.05 vs. the medium CTSD group;2)P < 0.05 vs. the low CTSD group. CTSD,cathepsin D;LVEF,left ventricular ejection fractions;PLT,platelet;cTnT,troponin T;NT-proBNP,N-terminal pro-B-type natriuretic peptide;HDL-C,high-density lipoprotein cholesterol;LDL-C,low-density lipoprotein cholesterol;CRP,C-reactive protein;WBC,white blood cell. | |||||
2.2 STEMI组与对照组全血CTSD表达水平比较
STEMI组全血CTSD表达量[1.31(1.03~1.75)]高于对照组[1.02(0.67~1.48)],差异有统计学意义(Z = -2.443,P = 0.015)。
2.3 不同CTSD表达水平STEMI患者MACE发生率随访6个月,STEMI组患者发生MACE共20例(21.74%)。发生的MACE中,因再发非计划内心绞痛住院8例,新发心力衰竭6例,因复发性非致死性心肌梗死2例,心源性死亡4例。不同CTSD表达水平STEMI患者随访结果显示,低、中、高CTSD组分别发生MACE 13、5、2例。高CTSD组与低CTSD组MACE发生率比较有统计学差异(P < 0.05)。见表 2。
| MACE | Low CTSD group(n=31) | Medium CTSD group(n=31) | High CTSD group(n=30) | Total |
| Recurrent unplanned angina hospitalization | 5(38.5) | 2(50.0) | 1(50.0) | 8(40.0) |
| New-onset heart failure | 5(38.5) | 1(20.0) | 0(0) | 6(30.0) |
| Cardiac death | 2(15.3) | 1(20.0) | 1(50.0) | 4(20.0) |
| Recurrent non-fatal myocardial infarction | 1(7.7) | 1(20.0) | 0(0.0) | 2(10.0) |
| Total | 13(100.0) | 5(100.0) | 2(100.0)1) | 20(100.0) |
| χ2 | 12.012 | |||
| P | 0.002 | |||
| 1)P < 0.05 vs. low CTSD group. | ||||
2.4 STEMI患者全血CTSD表达量对MACE的预测价值
以全血CTSD表达量为检测变量,以STEMI患者PCI治疗后6个月的MACE为状态变量,绘制ROC曲线。根据约登指数确定,截断值为1.214时,预测MACE的灵敏度为0.750,特异度为0.708。ROC曲线下面积为0.765(95%CI:0.658~0.872,P < 0.001)。见图 1。

|
| 图 1 全血CTSD预测PCI治疗后STEMI患者预后的ROC曲线 Fig.1 ROC curve of whole blood CTSD in predicting the prognosis of patients with STEMI after PCI |
3 讨论
心肌梗死是死亡的重要原因,也是导致患者残疾、死亡和生活质量下降的最严重的疾病之一[16]。随着胸痛中心的建设,STEMI的救治成功率在过去几十年中不断提高[17],但是还有相当多的患者在PCI治疗后会出现反复发生的心血管事件[18]。因此,STEMI患者的全程管理,尤其是早期诊疗,还有待进一步优化。
CTSD是一种重要的溶酶体天冬氨酸蛋白酶,可在多种炎症条件下释放,在动脉粥样硬化斑块中的表达增加。不同修饰阶段的CTSD参与不同的炎症过程。急性冠脉综合征患者单核细胞蛋白质组学研究[6]及STEMI小鼠RNA测序研究[19]发现,CTSD水平均持续升高。心肌梗死小鼠模型研究[20-22]发现,CTSD与心肌损伤密切相关。本研究结果显示,STEMI组患者早期动脉全血CTSD表达量显著高于对照组。分析其原因考虑为在心肌梗死后缺血缺氧的初始炎症阶段,组织炎症反应被触发,促使大量单核细胞向巨噬细胞转化[23],CTSD作为外周血来源的巨噬细胞分化良好标志物,可随外周血来源的巨噬细胞分化而表达;此外,CTSD表达上调能够补偿心肌梗死时机体增加的蛋白需求[24],细胞内溶酶体营养感应复合物感知机体处于营养物质缺乏时,诱导自噬途径和溶酶体降解机制激活。本研究中,CTSD的表达与cTnT、NT-proBNP呈负相关,提示CTSD表达诱导心肌细胞自噬且与心肌梗死的疾病严重程度有关。
本研究根据CTSD表达量对纳入STEMI患者进一步分组,发现年龄、性别、血压、吸烟史等潜在危险因素对动脉血CTSD浓度无显著影响,这与MOHAMMADPOUR等[25]的研究结果一致。WU等[26]研究发现,小鼠心肌梗死诱导的CTSD上调增加自噬通量,可部分防止心脏重塑和功能障碍。本研究中,不同CTSD表达水平STEMI患者超声心动图参数未见明显差异,推测原因可能与随访时间较短有关。心肌梗死后心肌重塑是一个缓慢的过程,应进一步随访超声心动图复查情况,探究CTSD表达量对心脏结构改变的影响。在针对调节HDL-C水平的基因的研究[27]中发现,CTSD表达降低可能导致血浆HDL-C水平降低,与本研究结果一致。其机制可能与抑制CTSD表达可使载脂蛋白A-I介导的脂质外排中ABCA1表达降低,减少其向质膜的运输,进而导致血浆HDL-C水平降低有关。
本研究通过对STEMI患者PCI治疗后6个月MACE回访发现,低CTSD组患者中MACE显著增加。进一步绘制ROC曲线评估CTSD对STEMI患者术后出现MACE的诊断价值,结果显示,当全血CTSD表达量 > 1.214时,STEMI患者术后发生MACE概率降低。研究[28]发现,敲低CTSD表达可进一步加剧溶酶体功能障碍和细胞死亡。因此,在STEMI早期促进循环细胞中CTSD表达,可通过提高自噬通量进一步抵御缺血缺氧导致的损伤。
综上所述,STEMI患者早期动脉血中CTSD的表达水平对STEMI患者术后发生MACE有较高的预测价值。但是否能将CTSD作为药物干预靶点,用于早期治疗及预防急性心肌梗死,还需更深入的多中心临床研究。
| [1] |
OZAKI Y, HARA H, ONUMA Y, et al. CVIT expert consensus do- cument on primary percutaneous coronary intervention (PCI) for acute myocardial infarction (AMI) update 2022[J]. Cardiovasc Interv Ther, 2022, 37(1): 1-34. DOI:10.1007/s12928-021-00829-9 |
| [2] |
FAZEL R, JOSEPH TI, SANKARDAS MA, et al. Comparison of re- perfusion strategies for ST-segment-elevation myocardial infarction: a multivariate network meta-analysis[J]. J Am Heart Assoc, 2020, 9(12): e015186. DOI:10.1161/JAHA.119.015186 |
| [3] |
LAHIRI V, HAWKINS WD, KLIONSKY DJ. Watch what you (self-) eat: autophagic mechanisms that modulate metabolism[J]. Cell Metab, 2019, 29(4): 803-826. DOI:10.1016/j.cmet.2019.03.003 |
| [4] |
MORISHITA H, MIZUSHIMA N. Diverse cellular roles of autophagy[J]. Annu Rev Cell Dev Biol, 2019, 35: 453-475. DOI:10.1146/annurev-cellbio-100818-125300 |
| [5] |
LAVANDERO S, CHIONG M, ROTHERMEL BA, et al. Autophagy in cardiovascular biology[J]. J Clin Invest, 2015, 125(1): 55-64. DOI:10.1172/JCI73943 |
| [6] |
DI YQ, HAN XL, KANG XL, et al. Autophagy triggers CTSD (cathepsin D) maturation and localization inside cells to promote apoptosis[J]. Autophagy, 2021, 17(5): 1170-1192. DOI:10.1080/15548627.2020.1752497 |
| [7] |
MARQUES ARA, DI SPIEZIO A, THIEßEN N, et al. Enzyme replacement therapy with recombinant pro-CTSD (cathepsin D) corrects defective proteolysis and autophagy in neuronal ceroid lipofuscinosis[J]. Autophagy, 2020, 16(5): 811-825. DOI:10.1080/15548627.2019.1637200 |
| [8] |
HENNING RH, BRUNDEL BJJM. Proteostasis in cardiac health and disease[J]. Nat Rev Cardiol, 2017, 14(11): 637-653. DOI:10.1038/nrcardio.2017.89 |
| [9] |
SCIARRETTA S, MAEJIMA Y, ZABLOCKI D, et al. The role of autophagy in the heart[J]. Annu Rev Physiol, 2018, 80: 1-26. DOI:10.1146/annurev-physiol-021317-121427 |
| [10] |
NAH J, ZHAI PY, HUANG CY, et al. Upregulation of Rubicon promotes autosis during myocardial ischemia/reperfusion injury[J]. J Clin Invest, 2020, 130(6): 2978-2991. DOI:10.1172/JCI132366 |
| [11] |
BYRNE RA, ROSSELLO X, COUGHLAN JJ, et al. 2023 ESC guidelines for the management of acute coronary syndromes[J]. Eur Heart J, 2023, 44(38): 3720-3826. DOI:10.1093/eurheartj/ehad191 |
| [12] |
ARBAB-ZADEH A, FUSTER V. The risk continuum of atherosclerosis and its implications for defining CHD by coronary angiography[J]. J Am Coll Cardiol, 2016, 68(22): 2467-2478. DOI:10.1016/j.jacc.2016.08.069 |
| [13] |
RAMPIDIS GP, BENETOS G, BENZ DC, et al. A guide for Gensini score calculation[J]. Atherosclerosis, 2019, 287: 181-183. DOI:10.1016/j.atherosclerosis.2019.05.012 |
| [14] |
GENÇ Ö, YILDIRIM A, KURT İH, et al. Relationship between work mode, time of admission, and mortality in st-segment elevation myocardial infarction: results from the TURKMI registry[J]. Angiology, 2023, 74(6): 553-562. DOI:10.1177/00033197221113139 |
| [15] |
QIU RJ, WAN SQ, ZHONG CM, et al. Core outcome sets for myocardial infarction in clinical trials of traditional Chinese medicine and Western medicine[J]. J Evid Based Med, 2024, 17(1): 86-94. DOI:10.1111/jebm.12579 |
| [16] |
GACH O, EL HZ, LANCELLOTTI P. Acute coronary syndrome[J]. Rev Med Liege, 2018, 73(5/6): 243-250. DOI:10.7748/en.17.8.6.59 |
| [17] |
WANG Y, LEIFHEIT EC, KRUMHOLZ HM. Trends in 10-year outcomes among medicare beneficiaries who survived an acute myo- cardial infarction[J]. JAMA Cardiol, 2022, 7(6): 613-622. DOI:10.1001/jamacardio.2022.0662 |
| [18] |
VOGEL B, CLAESSEN BE, ARNOLD SV, et al. ST-segment elevation myocardial infarction[J]. Nat Rev Dis Primers, 2019, 5(1): 39. DOI:10.1038/s41572-019-0090-3 |
| [19] |
CHEN QX, YIN QJ, SONG JX, et al. Identification of monocyte-associated genes as predictive biomarkers of heart failure after acute myocardial infarction[J]. BMC Med Genomics, 2021, 14(1): 44. DOI:10.1186/s12920-021-00890-6 |
| [20] |
THRASHER PR, SCOFIELD SLC, DALAL S, et al. Ataxia telan- giectasia mutated kinase deficiency impairs the autophagic response early during myocardial infarction[J]. Am J Physiol Heart Circ Phy- siol, 2018, 315(1): H48-H57. DOI:10.1152/ajpheart.00042.2018 |
| [21] |
SIVASANGARI S, ASAIKUMAR L, VENNILA L. Arbutin prevents alterations in mitochondrial and lysosomal enzymes in isoprote- renol-induced myocardial infarction: an in vivo study[J]. Hum Exp Toxicol, 2021, 40(1): 100-112. DOI:10.1177/0960327120945790 |
| [22] |
GANAPATHY R, RAMACHANDRAN A, SHIVALINGAIAH SB, et al. Cardioprotective potential of polyphenols rich Thraatchathi Chooranam against isoproterenol induced myocardial necrosis in experimental rats[J]. BMC Complement Med Ther, 2020, 20(1): 356. DOI:10.1186/s12906-020-03124-x |
| [23] |
LAFUSE WP, WOZNIAK DJ, RAJARAM MVS. Role of cardiac macrophages on cardiac inflammation, fibrosis and tissue repair[J]. Cells, 2020, 10(1): 51. DOI:10.3390/cells10010051 |
| [24] |
KAKIMOTO Y, SASAKI A, NIIOKA M, et al. Myocardial cathepsin D is downregulated in sudden cardiac death[J]. PLoS One, 2020, 15(3): e0230375. DOI:10.1371/journal.pone.0230375 |
| [25] |
MOHAMMADPOUR AH, SALEHINEJAD Z, ELYASI S, et al. Evaluation of serum cathepsin D concentrations in coronary artery disease[J]. Indian Heart J, 2018, 70(4): 471-475. DOI:10.1016/j.ihj.2018.01.003 |
| [26] |
WU PL, YUAN X, LI FQ, et al. Myocardial upregulation of cathepsin D by ischemic heart disease promotes autophagic flux and protects against cardiac remodeling and heart failure[J]. Circ Heart Fail, 2017, 10(7): e004044. DOI:10.1161/CIRCHEARTFAILURE.117.004044 |
| [27] |
JEON H, KIM YJ, HWANG SK, et al. Restoration of cathepsin D level via L-serine attenuates PPA-induced lysosomal dysfunction in neuronal cells[J]. Int J Mol Sci, 2022, 23(18): 10613. DOI:10.3390/ijms231810613 |
| [28] |
LANG JD, SUN BY, FENG SY, et al. Impaired autophagic flux in the human brain after traumatic brain injury[J]. Neuroreport, 2024, 35(6): 387-398. DOI:10.1097/WNR.0000000000002020 |
 2024, Vol. 53
2024, Vol. 53