文章信息
- 姜艳华, 赵磊, 陈琳琳, 左韬
- JIANG Yanhua, ZHAO Lei, CHEN Linlin, ZUO Tao
- 基于PI3K/AKT通路探讨青光增视方对过氧化氢诱导的视网膜神经节细胞损伤的保护机制
- Protective effect of Qingguang Zengshi prescription on hydrogen peroxide-induced injuries of retinal ganglion cell in vitro based on PI3K/AKT pathway
- 中国医科大学学报, 2023, 52(8): 706-710, 717
- Journal of China Medical University, 2023, 52(8): 706-710, 717
-
文章历史
- 收稿日期:2022-12-02
- 网络出版时间:2023-07-28 11:42:53
2. 中国医科大学沈阳市第四人民医院眼科, 沈阳 110031;
3. 辽宁中医药大学附属第二医院眼科, 沈阳 110034
2. Department of Ophthalmology, The Fourth People's Hospital of Shenyang, China Medical University, Shenyang 110031, China;
3. Department of Ophthalmology, The Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110034, China
青光眼是一种以视网膜神经节细胞(retinal ganglion cell,RGC)和视神经进行性变性为特征的眼部神经退行性疾病[1]。全球40岁及以上人群中青光眼的患病率为3.54%[2]。研究[3]显示,氧化应激参与青光眼RGC的损伤机制。寻找合适的药物抑制RGC氧化应激损伤是治疗青光眼的关键[4]。
中医药在治疗视神经萎缩方面由来已久,并深具独特优势。青光增视方是辽宁省名中医左韬教授基于30多年治疗青光眼临床经验总结出的经验方,能有效改善青光眼患者视力、视野,临床效果显著。
本研究基于磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKT)信号通路研究青光增视方对过氧化氢(hydrogen peroxide,H2O2)诱导的RGC损伤的保护作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物及细胞SPF级SD大鼠60只,雌雄不限,体质量(200±20)g,购自辽宁长生生物技术有限公司。RGC-5细胞株(批号CP-M122)购自武汉普诺赛科技公司。
1.1.2 试剂青光增视方(熟地黄20 g、山药9 g、白芍9 g、菟丝子9 g、茯苓6 g、当归9 g、夏枯草9 g、泽泻6 g、菊花6 g、香附9 g)购自北京康仁堂药业。甲钴胺片(0.5 mg)购自扬子江药业集团。RGC完全培养基(批号:CM-M122)购自武汉普诺赛科技公司。蛋白Marker购自赛默飞世尔科技(中国)公司;Tris购自中国医药集团有限公司;SDS-PAGE蛋白上样缓冲液、ECL发光液均购自上海碧云天生物技术有限公司;PVDF膜购自美国密理博公司;CCK-8试剂盒、AnnexinV-FITC/PE细胞凋亡试剂盒购自江苏凯基生物科技公司;兔抗大鼠PI3K检测试剂盒(ab140307)、磷酸化PI3K(p-PI3K)检测试剂盒(ab278545)、兔抗大鼠AKT检测试剂盒(ab8805)、p-AKT检测试剂盒(ab38449)、兔抗大鼠磷酸酶-张力蛋白同源物(phosphatase and tensin homolog,PTEN)检测试剂盒(ab267787)、兔抗大鼠内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)检测试剂盒(ab252439)购自英国Abcam公司。
1.2 方法 1.2.1 动物分组及处理适应性喂养大鼠2 d,禁食12 h后,空白血清组大鼠(12只)给予蒸馏水灌胃,青光增视方高、中、低剂量含药血清组大鼠(每组12只)给予高、中、低剂量青光增视方颗粒蒸馏水冲服灌胃。1剂青光增视方生药折合成免煎颗粒为16 g,根据《药理实验方法学》,按成人(60 kg体质量)日剂量(0.267 g·kg-1·d-1)的6.36倍计算,折算后大鼠等效剂量为1.70 g·kg-1·d-1。高剂量=等效剂量×2,低剂量=等效剂量×0.5,计算出高、中、低剂量分别为3.40、1.70、0.85 g·kg-1·d-1。甲钴胺血清组大鼠(12只)按照体质量进行甲钴胺(0.159 mg·kg-1)灌胃。灌胃2次/d,每组均干预5 d。末次灌胃1 h后采血。离心以分离血清,56 ℃水浴灭活30 min,0.22 µm滤膜过滤除菌,-80 ℃冻存备用。本研究获得辽宁中医药大学实验动物中心伦理委员会审批(伦理批号210000420200010)。
1.2.2 细胞培养、造模用细胞完全培养基,于37 ℃、5%CO2、相对湿度95%孵箱中培养RGC-5。通过加入含H2O2(终浓度为30 μmol/L)培养基制作氧化应激细胞模型,培养24 h;弃培养基,收集细胞进行后续检测。
1.2.3 细胞分组与给药(1)空白(CON)组,正常条件培养的RGC-5细胞;(2)模型(H2O2)组,模型细胞加入15%空白血清15 μL;(3)甲钴胺(H2O2+P)组,模型细胞加入甲钴胺含药血清15 μL;(4)青光增视方低剂量(H2O2+L)组,模型细胞加入15%青光增视方低剂量含药血清15 μL;(5)青光增视方中剂量(H2O2+M)组,模型细胞加入15%青光增视方中剂量含药血清15 μL;(6)青光增视方高剂量(H2O2+H)组,模型细胞加入15%青光增视方高剂量含药血清15 μL。
1.2.4 CCK-8法检测RGC-5存活率将细胞以2×104/mL、200 μL/孔的密度接种于96孔板中,在37 ℃、5%CO2孵箱中培养24 h;分别加入相应血清,培养24 h后,添加CCK-8反应溶液(10 μL/孔),继续培养2 h;检测450 nm吸光度值(A)。计算细胞存活率=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.5 流式细胞仪检测收集漂浮在培养基上的细胞,胰酶消化并收集贴壁细胞,PBS洗涤细胞1次,离心5 min;染色,加入250 μL Binding Buffer重悬细胞,加入5 μL Annexin V-FITC,5 μL propidium idodide,混匀,避光反应15 min;流式细胞仪检测RGC-5凋亡情况。
1.2.6 实时定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)提取各组细胞总RNA,逆转录合成cDNA,qRT-PCR检测相关基因表达情况。PCR反应体系20 μL,反应条件:95 ℃ 10 min,95 ℃ 15 s,55 ℃ 50 s,55 ℃ 50 s,45个循环。β-actin作内参照。2-ΔΔCt法计算目的基因相对表达量,重复检测3次,取平均值。引物序列见表 1。
| Gene | PCR primer sequence(5’-3’) | Product length(bp) |
| PI3K | 120 | |
| Sense | TCACTGGTACGATGACGAG | |
| Antisense | CATAGCAGCCCTGCTTACTG | |
| Akt | 154 | |
| Sense | CACAGGTCGCTACTATGCCA | |
| Antisense | GTAAGGAAGGGATGCCTAGAG | |
| PTEN | 186 | |
| Sense | CTGAGAGACATTATGACACCGC | |
| Antisense | TTACACCAGTCCGTCCTTTCC | |
| eNOS | 217 | |
| Sense | GCAACAAACCGAGGCAATC | |
| Antisense | GGTCCAGCCATGTTGAATACAG | |
| β-actin | 150 | |
| Sense | CCCATCTATGAGGGTTACGC | |
| Antisense | TTTAATGTCACGCACGATTTC |
1.2.7 Western blotting
裂解细胞后提取总蛋白,BCA法检测蛋白浓度;采用SDS-PAGE凝胶电泳分离,转移至PVDF膜;用含5%脱脂奶粉的TBST封闭2 h,加入一抗。4 ℃孵育过夜;TBST清洗后,加入二抗,室温下孵育1 h;ECL化学发光,Imaging System成像。用Quantity-one软件对蛋白条带行吸光度定量分析。
1.3 统计学分析采用SPSS 17.0软件行统计分析。计量资料以X±s表示。多组间比较采用one-way ANOVA,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组RGC-5存活率比较与CON组比较,各组RGC-5存活率均降低(P < 0.05);与H2O2组相比,H2O2+P、H2O2+M、H2O2+H组RGC-5存活率增加(P < 0.05);与H2O2+P组相比,H2O2+L组RGC-5存活率减少(P < 0.05),H2O2+M、H2O2+H组RGC-5存活率未见明显差异(P > 0.05)。见表 2。
| Group | Survival rate |
| CON | 1.110±0.051 5 |
| H2O2 | 0.674±0.012 51) |
| H2O2+P | 0.965±0.014 01),2) |
| H2O2+L | 0.742±0.025 11),3) |
| H2O2+M | 0.879±0.023 41),2),4) |
| H2O2+H | 0.935±0.020 71),2),4) |
| F | 65.254 |
| P | < 0.001 |
| 1)P < 0.05 vs CON group;2)P < 0.05 vs H2O2 group;3)P < 0.05 vs H2O2+P group;4)P < 0.05 vs H2O2+L group. | |
2.2 各组RGC-5凋亡率比较
流式细胞检测结果显示,CON组、H2O2组、H2O2+P组、H2O2+L、H2O2+M、H2O2+H组RGC-5凋亡率分别为9.4%、19.1%、10.9%、15.9%、9.6%、7.0%。
2.3 各组RGC-5中PI3K、AKT、PTEN、eNOS mRNA表达水平比较与CON组比较,H2O2组PI3K、eNOS mRNA表达水平降低,PTEN mRNA表达升高(均P < 0.05);与H2O2组比较,H2O2+P、H2O2+H组PI3K mRNA及H2O2+P、H2O2+M、H2O2+H组eNOS mRNA表达升高,各给药组PTEN mRNA表达均降低(均P < 0.05);与H2O2+P组相比,H2O2+L、H2O2+M组PTEN mRNA表达升高,而eNOS mRNA表达降低(均P < 0.05),见表 3。
| Group | PI3K | AKT | PTEN | eNOS |
| CON | 1.000±0.080 | 1.000±0.050 | 1.000±0.100 | 1.000±0.090 |
| H2O2 | 0.575±0.0701) | 1.124±0.081 | 2.266±0.0591) | 0.537±0.0681) |
| H2O2+P | 0.847±0.1542) | 1.245±0.124 | 1.284±0.0891),2) | 1.068±0.1472) |
| H2O2+L | 0.644±0.1251) | 1.275±0.135 | 1.876±0.0741),2),3) | 0.648±0.0981),3) |
| H2O2+M | 0.763±0.152 | 1.129±0.114 | 1.535±0.0811),2),3),4) | 0.746±0.1541),2),3) |
| H2O2+H | 0.864±0.2012) | 1.175±0.124 | 1.214±0.0741),2),4),5) | 0.987±0.1952),4),5) |
| F | 3.808 | 2.458 | 102.017 | 8.047 |
| P | 0.027 | 0.094 | < 0.001 | 0.002 |
| 1)P < 0.05 vs CON group;2)P < 0.05 vs H2O2 group;3)P < 0.05 vs H2O2+P group;4)P < 0.05 vs H2O2+L group;5)P < 0.05 vs H2O2+M group. | ||||
2.4 各组RGC-5中PI3K、AKT、p-AKT、PTEN、eNOS蛋白表达比较
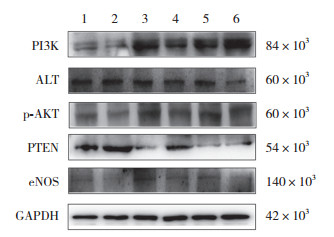
与CON组比较,H2O2组PI3K、p-AKT/AKT、eNOS蛋白表达水平降低,PTEN蛋白表达升高(均P < 0.05);与H2O2组比较,各给药组的PI3K、p-AKT/AKT、eNOS表达升高,PTEN表达降低(均P < 0.05);与H2O2+P组相比,H2O2+H组的PI3K及H2O2+M、H2O2+H组p-AKT/AKT蛋白表达升高,H2O2+M、H2O2+H组PTEN蛋白表达降低(均P < 0.05)。见表 4、图 1。
| Group | PI3K | p-AKT/AKT | PTEN | eNOS |
| CON | 0.520±0.026 | 0.528±0.030 | 0.940±0.039 | 0.457±0.029 |
| H2O2 | 0.371±0.0261) | 0.395±0.0211) | 1.348±0.0461) | 0.291±0.0151) |
| H2O2+P | 0.706±0.0321),2) | 0.936±0.0461),2) | 0.662±0.0951),2) | 0.590±0.0351),2) |
| H2O2+L | 0.585±0.0282),3) | 0.826±0.0391),2),3) | 0.864±0.0442),3) | 0.526±0.0112) |
| H2O2+M | 0.701±0.0351),2),4) | 0.976±0.0501),2),3),4) | 0.329±0.0231),2),3),4) | 0.550±0.0231),2) |
| H2O2+H | 0.813±0.0311),2),3),4),5) | 1.062±0.0171),2),3),4),5) | 0.412±0.0121),2),3),4) | 0.380±0.0261),2),3),4),5) |
| F | 28.189 | 54.916 | 55.841 | 21.298 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| 1)P < 0.05 vs CON group;2)P < 0.05 vs H2O2 group;3)P < 0.05 vs H2O2+P group;4)P < 0.05 vs H2O2+L group;5)P < 0.05 vs H2O2+M group. | ||||
|
| 1,CON group;2,H2O2 group;3,H2O2+P group;4,H2O2+L group;5,H2O2+M group;6,H2O2+H group. 图 1 各组RGC-5中PI3K、AKT、p-AKT、PTEN、eNOS蛋白表达水平比较 Fig.1 Comparison of expression levels of PI3K, AKT, p-AKT, PTEN, and eNOS in RGC-5 of each group |
3 讨论
中医药在治疗青光眼方面有很多优势,其具体作用机制值得深入研究[5]。青光增视方具有补益肝肾、健脾利水、解郁明目之功效,能够有效改善青光眼患者的视力和视野。通过抑制RGC凋亡可以有效延缓青光眼病情发展[6]。本研究基于PI3K/AKT通路探讨青光增视方对H2O2诱导的RGC损伤的保护作用。本研究中,青光增视方高、中剂量组RGC-5存活率均高于模型组(P < 0.05);而在凋亡率方面,西药组(10.9%)、青光增视方高(7.0%)、中(9.6%)、低(15.9%)剂量组RGC-5均低于模型组(19.1%),表明青光增视方对H2O2诱导的RGC损伤具有保护作用。
本研究中,青光增视方可上调H2O2诱导的RGC损伤模型PI3K mRNA及蛋白表达,上调p-AKT/AKT蛋白比率。PI3K/AKT通路是研究RGC凋亡的重要调控通路[7-8]。通过激活PI3K/AKT信号通路可有效减轻RGC损伤和氧化应激,上调RGC损伤模型AKT的磷酸化表达可促进RGC自我保护和修复效应[9-10]。ZHONG等[11]还发现,基于PI3K/AKT通路调控小胶质细胞的极化还可调节促炎和抗炎因子的产生。
本研究显示,青光增视方还可下调H2O2诱导的RGC损伤模型的PTEN mRNA及蛋白表达。PTEN与RGC存活和轴突再生具有一定的关系,下调PTEN mRNA不仅能抑制RGC凋亡,还能促进视神经轴突再生[12]。TAKAHIKO等[13]也发现,PTEN为PI3K/AKT信号通路的负反馈调节因子,通过抑制PTEN靶向调节细胞内信号通路增强RGC再生。
此外,本研究还发现,青光增视方可上调H2O2诱导的RGC损伤模型eNOS mRNA及蛋白表达。eNOS可促进细胞增殖,PI3K、AKT可作为eNOS的上游调控机制,抑制细胞凋亡。p-AKT可激活eNOS,促进内皮细胞合成一氧化氮,增加血流量及细胞摄氧量,保护视神经[14]。通过激活PI3K/Akt/eNOS信号通路可以保护RGC-5细胞免受氧化应激损伤[15-16]。
综上所述,本研究结果显示,青光增视方对H2O2诱导的RGC损伤具有保护作用,其机制可能是通过调控视网膜PI3K、AKT、PTEN、eNOS mRNA及蛋白的表达,从而减少RGC凋亡。
| [1] |
吴姗姗, 田庆梅, 高延娥, 等. 青光眼视神经节细胞凋亡的作用机制研究进展[J]. 眼科新进展, 2019, 39(9): 882-885. DOI:10.13389/j.cnki.rao.2019.0201 |
| [2] |
ADDEPALLI UK, JONNADULA GB, GARUDADRI CS, et al. Prevalence of primary glaucoma as diagnosed by study optometrists of L. V. prasad eye institute -glaucoma epidemiology and molecular genetics study[J]. Ophthalmic Epidemiol, 2019, 26(3): 150-154. DOI:10.1080/09286586.2018.1551961 |
| [3] |
FAN GASKIN JC, SHAH MH, CHAN EC. Oxidative stress and the role of NADPH oxidin glaucoma[J]. Antioxidants (Basel), 2021, 10(2): 238. DOI:10.3390/antiox10020238 |
| [4] |
李晓勇, 孟凡颖, 白赫南. 阿克替苷通过激活血红素加氧酶-1抑制H2O2诱导的视网膜神经节细胞氧化损伤[J]. 眼科新进展, 2022, 42(9): 694-698. DOI:10.13389/j.cnki.rao.2022.0142 |
| [5] |
吴虎强, 罗燕, 夏泽梅, 等. 基于络病理论探讨疏肝通络法治疗青光眼[J]. 天津中医药大学学报, 2021, 40(5): 583-586. DOI:10.11656/j.issn.1673-9043.2021.05.10 |
| [6] |
CHEN QB, XI XT, ZENG Y, et al. Acteoside inhibits autophagic apoptosis of retinal ganglion cells to rescue glaucoma-induced optic atrophy[J]. J Cell Biochem, 2019, 120(8): 13133-13140. DOI:10.1002/jcb.28586 |
| [7] |
林惠军, 杨倩, 龚潇. 野黄芩素经Akt/FoxO1信号通路抑制视网膜神经节细胞凋亡[J]. 中南医学科学杂志, 2022, 50(4): 482-485, 490. DOI:10.15972/j.cnki.43-1509/r.2022.04.004 |
| [8] |
LEE K, CHOI JO, HWANG A, et al. Ciliary neurotrophic factor derived from astrocytes protects retinal ganglion cells through PI3K/AKT, JAK/STAT, and MAPK/ERK pathways[J]. Invest Ophthalmol Vis Sci, 2022, 63(9): 4. DOI:10.1167/iovs.63.9.4 |
| [9] |
XI XT, CHEN QB, MA J, et al. Acteoside protects retinal ganglion cells from experimental glaucoma by activating the PI3K/AKT signaling pathway via caveolin 1 upregulation[J]. Ann Transl Med, 2022, 10(6): 312. DOI:10.21037/atm-22-136 |
| [10] |
DU HY, WANG R, LI JL, et al. Ligustrazine induces viability, suppresses apoptosis and autophagy of retinal ganglion cells with ischemia/reperfusion injury through the PI3K/Akt/mTOR signaling pathway[J]. Bioengineered, 2021, 12(1): 507-515. DOI:10.1080/21655979.2021.1880060 |
| [11] |
ZHONG ZZ, CHEN A, FA ZQ, et al. Adipose-derived stem cells modulate BV2 microglial M1/M2 polarization by producing GDNF[J]. Stem Cells Dev, 2020, 29(11): 714-727. DOI:10.1089/scd.2019.0235 |
| [12] |
LIU QH, HUANG ZR, CHEN HY, et al. PTEN knockdown with the Y444F mutant AAV2 vector promotes axonal regeneration in the adult optic nerve[J]. Neural Regen Res, 2018, 13(1): 135. DOI:10.4103/1673-5374.224381 |
| [13] |
NORO T, SHAH SH, YIN YQ, et al. Elk-1 regulates retinal ganglion cell axon regeneration after injury[J]. Sci Rep, 2022, 12(1): 17446. DOI:10.1038/s41598-022-21767-3 |
| [14] |
ZAKI HF, ABDELSALAM RM. Vinpocetine protects liver against ischemia-reperfusion injury[J]. Can J Physiol Pharmacol, 2013, 91(12): 1064-1070. DOI:10.1139/cjpp-2013-0097 |
| [15] |
LI L, SU Y, LIU JJ, et al. Efficacy of vincamine treatment in a rat model of anterior ischemic optic neuropathy[J]. Eur J Ophthalmol, 2021, 31(6): 3442-3449. DOI:10.1177/1120672120974283 |
| [16] |
WANG RK, PENG LZ, ZHAO JQ, et al. Gardenamide A protects RGC-5 cells from H2O2-induced oxidative stress insults by activating PI3K/Akt/eNOS signaling pathway[J]. Int J Mol Sci, 2015, 16(9): 22350-22367. DOI:10.3390/ijms160922350 |
 2023, Vol. 52
2023, Vol. 52