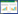文章信息
- 白诗瑶, 包慧静, 马琳, 麻雪晴, 李丹玲, 苏新明
- BAI Shiyao, BAO Huijing, MA Lin, MA Xueqing, LI Danling, SU Xinming
- miR-23b-5p通过靶向下调FN1缓解支气管哮喘气道重塑
- miR-23b-5p relieves airway remodeling in bronchial asthma through targeted downregulation of FN1
- 中国医科大学学报, 2023, 52(6): 481-486
- Journal of China Medical University, 2023, 52(6): 481-486
-
文章历史
- 收稿日期:2022-11-22
- 网络出版时间:2023-05-25 15:31:43
支气管哮喘(简称哮喘) 是以气道炎症、气道重塑和气道高反应性为主要病理改变的慢性气道疾病,其中气道重塑主要表现为各种结构改变所致的气道壁增厚,包括气道平滑肌细胞的炎症、肥大和(或) 增生,上皮下纤维化,杯状细胞增生,胶原沉积以及血管增多等[1-2]。微RNA (microRNA,miRNA) 是一种小分子非编码RNA,通过与mRNA的3’非翻译区(3’-untranslated region,3’-UTR) 不完全结合,启动靶基因mRNA降解程序并抑制其翻译,在过敏性哮喘的发生、发展中起重要作用,被认为是过敏性哮喘的潜在生物标志物之一[3]。miR-23b可通过结合不同的靶基因,参与细胞的增殖、迁移和分化以及上皮-间质转化等多种生物学过程[4-6]。研究[7]表明,miR-23b过表达能够促进气道平滑肌细胞的凋亡并抑制其增殖。本研究制备哮喘小鼠模型,检测miR-23b在正常和哮喘小鼠肺组织中的表达差异,获得miR-23b可能影响哮喘气道重塑的靶基因,进一步探讨miR-23b参与哮喘气道重塑的具体机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂鸡卵白蛋白,购自美国Sigma公司;原代平滑肌细胞培养体系,购自赛百慷(上海) 生物技术股份有限公司;Lipofectamine 2000,购自美国Invitrogen公司;miR-23b-5p模拟物(miR-23b-5p mimic)、抑制剂(miR-23b-5p inhibitor) 及阴性对照(miR-NC),miRNA实时荧光定量PCR (real-time fluorescence quantitative PCR,qRT-PCR) 引物、U6引物、反转录试剂盒,购自广州锐博生物科技有限公司;纤维连接蛋白1 (fibronectin1,FN1) 兔源多克隆抗体,购自武汉赛维尔生物科技有限公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA) 兔源单克隆抗体,购自美国Abcam公司;β-actin兔源单克隆抗体,购自美国CST公司;AG RNAex Pro RNA提取试剂、SYBR Green Pro Taq HS预混型qRT-PCR试剂盒,购自湖南艾科瑞生物工程有限公司;Masson三色染色试剂盒和免疫组织化学显色试剂盒,购自福州迈新生物技术开发有限公司;小鼠白细胞介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、转化生长因子-β1 (transforming growth factor-β1,TGF-β1)、血管内皮生长因子(vascular endothelial growth factor,VEGF) ELISA检测试剂盒,购自美国R & D公司;双荧光素酶报告基因检测试剂盒,购自美国Promega公司。
1.1.2 实验动物分组和模型制备健康SPF级雌性BALB/c小鼠12只,6~8周龄,体质量(20±2) g,购自北京华阜康生物科技股份有限公司。将12只小鼠随机分为正常对照组和哮喘组,每组6只。于SPF级动物房适应性饲养1周后,哮喘组于第0、7、14天给予含Ⅴ级卵白蛋白(20 μg) 和氢氧化铝(2 mg) 的卵白蛋白致敏液0.2 mL腹腔注射,于第21天应用压缩空气式雾化器雾化2% Ⅱ级卵白蛋白激发液,3次/周,30 min/次,连续8周。正常对照组致敏和激发均给予生理盐水替代卵白蛋白。
1.1.3 细胞培养、转染和分组人支气管平滑肌细胞(human bronchial smooth muscle cell,HBSMC) 购自美国组织培养库,接种在含10%胎牛血清、100 U/mL链霉素-青霉素的平滑肌细胞培养基中,置于37 ℃、含5%CO2的细胞培养箱中培养。按照Lipofectamine 2000说明书,将miR-NC (miR-NC组)、miR-23b-5p模拟物(miR-23b-5p mimic组)、miR-23b-5p抑制剂(miR-23b-5p inhibitor组) 转染HBSMC。
1.2 方法 1.2.1 肺组织病理染色取各组小鼠左侧肺组织,用4%多聚甲醛固定后,全自动脱水机脱水,石蜡包埋,制备切片,切片厚度4 μm,65 ℃烤箱中烘烤3 h后,室温保存备用。切片脱蜡至水后,使用Masson三色染色试剂盒,根据说明书,应用Masson复合染液染5 min,蒸馏水洗去染液后滴加磷钼酸,5 min后甩干。苯胺蓝染1 min,蒸馏水稍洗,滴加分化液分化,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察气道壁周围胶原沉积水平,应用ImageJ软件分析胶原沉着区占基底膜区面积的百分比。
1.2.2 血清细胞因子检测应用ELISA检测血清中IL-6、TNF-α、TGF-β1、VEGF水平。操作方法参照试剂盒说明书。
1.2.3 qRT-PCR检测肺组织miR-23b-5p表达水平提取肺组织总RNA,按说明书配置反转录反应体系。反应条件:42 ℃ 60 min;70 ℃ 10 min。使用梯度PCR仪进行反转录反应,获得cDNA并分装保存于-80℃冰箱内备用。SYBR Green Mix配置qRT-PCR反应体系,使用Roche LightCycler 480 Ⅱ型qRT-PCR仪进行两步法qRT-PCR。反应结束后,检测并确认扩增曲线和溶解曲线,记录Ct值。以U6为对照,采用Livak法进行qRT-PCR相对定量分析。
1.2.4 SP法免疫组织化学染色石蜡切片复温后脱蜡至水,柠檬酸钠抗原修复缓冲液微波修复30 min,放凉至室温后PBS洗3次,3 min/次。擦干切片上多余水分,应用免疫组织化学试剂盒,内源性过氧化物酶阻断剂处理10 min,PBS冲洗;非特异性染色阻断剂封闭30 min,甩干;一抗FN1、α-SMA (PBS稀释,稀释比为1∶1 000) 4 ℃孵育过夜;过夜后室温下复温45 min,PBS洗去抗体,滴加辣根酶标记山羊抗兔/鼠二抗10 min,PBS冲洗;链霉亲和素-过氧化酶复合物染10 min,PBS冲洗;滴加DAB显色液后于显微镜下观察显色,自来水下冲洗10 min,苏木素复染核5 min,流水振洗,盐酸乙醇分化10 s,返蓝10 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察FN1、α-SMA在肺组织中表达分布,ImageJ软件半定量分析FN1、α-SMA平均光密度。
1.2.5 Western blotting提取蛋白并使用BCA试剂盒定量后,加入上样缓冲液,100 ℃水浴加热5 min使蛋白质变性,-80 ℃冰箱冻存备用。PAGE蛋白凝胶电泳(120 V,60 min),转膜(0.25 A,90 min),快速封闭液室温封闭30 min,FN1、α-SMA、β-actin以1∶1 000稀释比稀释后4 ℃孵育过夜,TBST洗去生物膜表面抗体后,辣根酶标记山羊抗兔IgG (H+L) 以1∶5 000稀释比稀释后室温孵育1 h,ECL法检测蛋白表达,UVP系统成像,应用ImageJ软件对所得蛋白条带进行灰度值分析。
1.2.6 双荧光素酶实验检测miR-23b-5p是否靶向FN1通过TargetScan网站(https://www.targetscan.org/vert_80/) 预测miR-23-5p与FN1 mRNA的3’-UTR存在结合位点。采用阳离子脂质体法转染细胞,按照双荧光素酶报告基因检测试剂盒说明书,检测双荧光素酶活性。
1.3 统计学分析应用GraphPad Prism 9.0软件进行统计分析。计量资料用x±s表示,组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 哮喘小鼠肺组织病理改变Masson染色结果显示,哮喘组小鼠气道壁周围大量蓝色胶原沉积,气道平滑肌增厚、塌陷。与正常对照组相比,哮喘组小鼠气道壁周围胶原面积显著增加(P < 0.001)。见图 1。
|
| A, Masson staining (×200);B, percentage of collagen deposition area. ** P < 0.001 vs control group. 图 1 哮喘小鼠肺组织病理变化 Fig.1 Pathological changes in the lung tissues of asthmatic mice |
2.2 哮喘小鼠血清中炎性细胞因子水平变化
ELISA检测结果显示,与正常对照组相比,哮喘组小鼠血清中炎性细胞因子IL-6、TNF-α、TGF-β1、VEGF表达水平显著升高(P < 0.001)。见图 2。

|
| A, IL-6;B, TNF-α; C, TGF-β1;D, VEGF. ** P < 0.001 vs control group. 图 2 哮喘小鼠血清中炎性细胞因子表达水平 Fig.2 Levels of inflammatory cytokine in the serum of asthmatic mice |
2.3 哮喘小鼠肺组织中miR-23b-5p表达降低
qRT-PCR结果表明,哮喘组与正常对照组小鼠肺组织中miR-23b-5p表达水平分别为0.000 4±0.000 12和0.001 0±0.000 27;与正常对照组相比,哮喘组小鼠肺组织中miR-23b-5p显著下调(P < 0.05)。
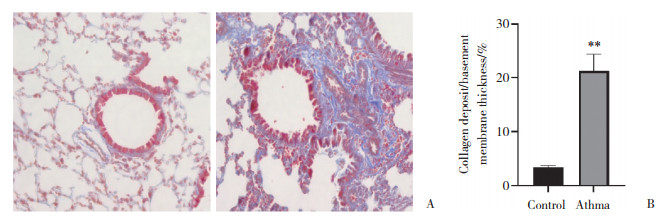
2.4 哮喘小鼠肺组织中的FN1和α-SMA表达升高免疫组织化学染色和Western blotting结果均显示,正常对照组小鼠肺组织中可见FN1和α-SMA的表达,与正常对照组相比,哮喘组小鼠肺组织FN1和α-SMA表达显著增加(P < 0.05)。见图 3。
|
| A, immunohistochemical staining (×200);B, Western blotting; C, immunohistochemical staining results; D, Western blotting results. *P < 0.05 vs control group; **P < 0.001 vs control group. AOD, average optical density. 图 3 哮喘小鼠肺组织中FN1和α-SMA表达水平 Fig.3 Levels of FN1 and α-SMA expression in asthmatic mice IL-6/pg·mL-1 |
2.5 FN1是miR-23b-5p的直接靶点
TargetScan预测表明,FN1 3’-UTR是miR-23-5p靶向结合序列。双荧光素酶检测结果表明,与miR-NC组及miR-23b-5p inhibitor组相比,miR-23b-5p mimic组野生型FN1荧光素酶活性强度显著下调(P < 0.05),miR-23b-5p与FN1间存在靶向作用关系。见图 4。

|
| A, TargetScan result; B, dual luciferase reporter results. * P < 0.05 vs miR-23b-5p mimic group. 图 4 哮喘小鼠肺组织中miR-23b-5p的靶向分析 Fig.4 Targeting analysis of miR-23b-5p in asthmatic mice |
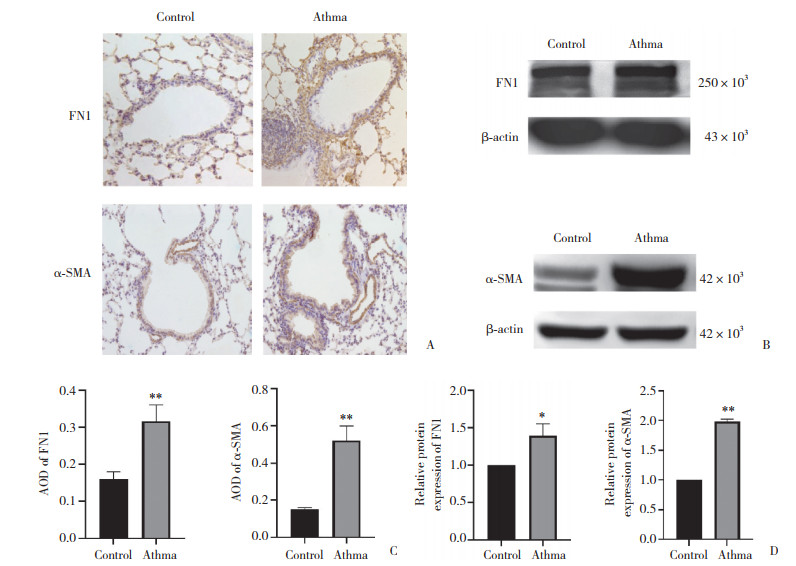
2.6 miR-23b-5p抑制HBSMC中FN1的表达
与miR-NC组相比,miR-23b-5p mimic组HBSMC中FN1表达水平显著下调(P < 0.05),而miR-23b-5p inhibitor组HBSMC中FN1表达水平显著升高(P < 0.01)。见图 5。
|
| A, Western blotting; B, Western blotting results. * P < 0.05 vs miR-NC group; ** P < 0.01 vs miR-NC group. 图 5 HBSMC中FN1的表达水平 Fig.5 Levels of FN1 in HBSMC |
3 讨论
气道平滑肌层增厚是哮喘患者气道壁重塑最显著的病理表现之一,与哮喘严重程度密切相关[8]。研究[2]表明,大多数气道重塑的特征表现会在一定程度上依赖炎症,当发生气道重塑时,气道炎症能够进一步促进气道过度狭窄,从而维持或增加气道重塑水平,而气道平滑肌的重塑改变也可以部分独立于气道炎症。本研究通过制备哮喘小鼠模型,发现在长期的卵白蛋白刺激下,哮喘小鼠的气道发生了明显的重塑性改变,主要表现为气道平滑肌增厚,气道壁周围胶原纤维沉积,血清中气道重塑相关因子IL-6、TNF-α、TGF-β1、VEGF的表达水平升高,这也与本课题组的前期研究[9]结果一致,表明哮喘小鼠模型构建成功。
miR-23b是由染色体9q22.32区域编码的miR-23b/27b/24-1基因簇产生的一种多效性转录后调节因子,参与发育过程中正常的生长和分化、肿瘤、病毒感染、自身免疫性疾病等多种生物学过程和疾病的转录调节[10]。miR-23b在许多免疫过程中通过调节细胞因子(如IL-17、TNF-α) 的表达,参与炎症反应的反馈调控过程[3, 10],但其在哮喘气道重塑中的作用及具体机制尚不明确。本研究结果表明,miR-23b-5p在哮喘小鼠肺组织中表达明显下调。而miR-23b-5p也被认为是影响平滑肌细胞增殖的重要因素,是支气管哮喘的潜在生物标志物和治疗靶点[11]。miR-23b可通过结合不同的靶基因发挥其功能。本研究通过TargetScan预测到FN1可能是miR-23b-5p的靶基因,采用双荧光素酶法进一步证实了FN1是miR-23b-5p的直接靶点。纤维连接蛋白是主要的细胞外基质蛋白,调控细胞的增殖、迁移等生物学行为。研究[12]发现FN1在哮喘患者的气道中高表达,是过敏性哮喘气道炎症和气道重塑的重要影响因素之一。本研究采用免疫组织化学染色和Western blotting半定量分析哮喘小鼠模型肺组织中FN1和α-SMA的表达水平,发现在哮喘发生时FN1和α-SMA表达升高,而过表达miR-23b-5p的气道平滑肌细胞中FN1表达降低,说明miR-23b-5p可以通过靶向抑制FN1,从而在一定程度上抑制哮喘发生时的气道重塑改变。
综上所述,miR-23b-5p在哮喘小鼠肺组织中表达下调,上调miR-23b-5p的表达能够抑制气道平滑肌的重塑改变,其机制可能与miR-23b-5p直接靶向抑制FN1的表达有关。但这一机制还有待进一步研究,以明确miR-23b-5p调控哮喘发生时气道重塑的具体机制,从而为哮喘的治疗提供新靶点。
| [1] |
BANNO A, REDDY AT, LAKSHMI SP, et al. Bidirectional interaction of airway epithelial remodeling and inflammation in asthma[J]. Clin Sci (Lond), 2020, 134(9): 1063-1079. DOI:10.1042/CS20191309 |
| [2] |
ELLIOT JG, NOBLE PB, MAUAD T, et al. Inflammation-dependent and independent airway remodelling in asthma[J]. Respirology, 2018, 23(12): 1138-1145. DOI:10.1111/resp.13360 |
| [3] |
WEIDNER J, BARTEL S, KILIÇ A, et al. Spotlight on microRNAs in allergy and asthma[J]. Allergy, 2021, 76(6): 1661-1678. DOI:10.1111/all.14646 |
| [4] |
LI H, CHEN Z, CHEN W, et al. MicroRNA-23b-3p deletion induces an IgA nephropathy-like disease associated with dysregulated mucosal IgA synthesis[J]. J Am Soc Nephrol, 2021, 32(10): 2561-2578. DOI:10.1681/asn.2021010133 |
| [5] |
KADOTA T, YOSHIOKA Y, FUJITA Y, et al. Extracellular vesicles from fibroblasts induce epithelial-cell senescence in pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2020, 63(5): 623-636. DOI:10.1165/rcmb.2020-0002OC |
| [6] |
SI X, CHEN Q, ZHANG J, et al. MicroRNA-23b prevents aortic aneu-rysm formation by inhibiting smooth muscle cell phenotypic swit-ching via FoxO4 suppression[J]. Life Sci, 2022, 288: 119092. DOI:10.1016/j.lfs.2021.119092 |
| [7] |
CHEN M, SHI J, ZHANG W, et al. MiR-23b controls TGF-β1 induced airway smooth muscle cell proliferation via direct targeting of Smad3[J]. Pulm Pharmacol Ther, 2017, 42: 33-42. DOI:10.1016/j.pupt.2017.01.001 |
| [8] |
JAMES AL, NOBLE PB, DREW SA, et al. Airway smooth muscle proliferation and inflammation in asthma[J]. J Appl Physiol (1985), 2018, 125(4): 1090-1096. DOI:10.1152/japplphysiol.00342.2018 |
| [9] |
任媛, 苏新明, 李孟露, 等. 急性期和慢性期哮喘小鼠模型在哮喘致病过程中的对比研究[J]. 国际呼吸杂志, 2017, 37(14): 1067-1072. DOI:10.3760/cma.j.issn.1673-436X.2017.14.004 |
| [10] |
WANG W, WANG Y, LIU W, et al. Regulation and biological roles of the multifaceted miRNA-23b (MIR23B)[J]. Gene, 2018, 642: 103-109. DOI:10.1016/j.gene.2017.10.085 |
| [11] |
GUO Y, YUAN X, HONG L, et al. Promotor hypomethylation mediated upregulation of miR-23b-3p targets PTEN to promote bronchial epithelial-mesenchymal transition in chronic asthma[J]. Front Immunol, 2022, 12: 771216. DOI:10.3389/fimmu.2021.771216 |
| [12] |
JANULAITYTE I, JANUSKEVICIUS A, KALINAUSKAITE-ZUKAUSKE V, et al. In vivo allergen-activated eosinophils promote collagenⅠ and fibronectin gene expression in airway smooth muscle cells via TGF-β1 signaling pathway in asthma[J]. Int J Mol Sci, 2020, 21(5): 1837. DOI:10.3390/ijms21051837 |
 2023, Vol. 52
2023, Vol. 52