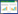文章信息
- 迂金洋, 杨向红
- YU Jinyang, YANG Xianghong
- 基于生物信息学分析胰腺导管腺癌中SPP1的表达与预后的关系及其作用机制
- Relationship between SPP1 expression and the prognosis and its mechanism in pancreatic ductal adenocarcinoma based on bioinformatics
- 中国医科大学学报, 2023, 52(2): 103-109
- Journal of China Medical University, 2023, 52(2): 103-109
-
文章历史
- 收稿日期:2022-08-17
- 网络出版时间:2023-01-31 14:56:03
胰腺癌是常见的消化系统肿瘤,恶性程度高,是预后最差的恶性肿瘤之一[1]。胰腺癌发病隐匿,80%以上患者确诊时已是中晚期,5年生存率不足6%[2]。胰腺肿瘤中胰腺导管腺癌最常见,约占90%以上[3]。因此,明确胰腺导管腺癌发生发展的分子机制十分重要。近年来研究[4]表明胰腺癌微环境在肿瘤进展中起到重要作用。免疫相关细胞是微环境的重要组成部分,不仅可以通过破坏突变细胞来抑制肿瘤的发展或进展,阻止其发展成肿瘤细胞,还可以通过建立有利的免疫抑制条件来促进胰腺癌的进展转移[5-6]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)在肿瘤相关微环境中具有重大意义,它可诱导T细胞表面表达PD-L1促进T细胞凋亡。TAM可以通过和胰腺星状细胞相互作用促进结缔组织增生。M2巨噬细胞可以促进胰腺纤维化[7],巨噬细胞可以通过PI3Kγ途径促进胰腺癌纤维化、免疫抑制和转移[8]。体外共培养巨噬细胞和胰腺星状细胞已经证明巨噬细胞与星状细胞的相互作用是胰腺导管腺癌中结缔组织增生的关键组成部分[9]。研究[10]已经证明TAM可以上调胰腺星状细胞功能,TAM可以通过转化生长因子-β1(transforming growth factor-β1,TGF-β1)和血小板衍生生长因子(platelet derived growth factor,PDGF)刺激胰腺星状细胞的增殖和细胞外基质分泌。
分泌磷蛋白1(secreted phosphoprotein 1,SPP1)位于4号染色体长臂2区2带1亚带(4q22.1),编码一种磷酸化蛋白,分泌到细胞外后通过与其他细胞表面受体结合发挥作用。诸多研究表明SPP1通过不同的作用途径参与了不同疾病过程。WANG等[11]证实SPP1可以在神经损伤后与CD44或αvβ3结合,通过PKCα通路促进施万细胞增殖和生长,抑制其凋亡。SHIRAKAWA等[12]检测出SPP1在心肌梗死后表达活性增加,并且通过诱导巨噬细胞极化来促进组织修复。KOLB等[13]通过实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)证实SPP1在胰腺癌中表达水平增加,并且通过沉默SPP1抑制了胰腺癌细胞的侵袭。本研究基于生物信息学探讨SPP1在胰腺导管腺癌组织中的表达、与预后的关系及其可能的作用机制。
1 材料与方法 1.1 生物信息学分析高通量基因表达数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo)下载胰腺导管腺癌相关数据集GSE15471和GSE16515,应用GEO2R分析胰腺癌和癌旁组织的差异基因,并以调整P < 0.05,∣logFC∣≥1为条件进行差异基因的筛选。将筛选出的差异表达基因选取交集后,在STRING网站(https://cn.string-db.org)中进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析,经Cytoscape可视化后,通过MCODE算法计算基于节点评分的共表达网络簇,以cut-off值=0.2,K=2为条件,计算分析PPI网络中的亚簇。利用Kaplan-Meier Plotter数据库(https://kmplot.com/analysis),对上调表达基因中的1个亚簇中所有基因进行预后相关分析,选取对胰腺癌患者的生存期有影响的基因作为目标基因。同时应用DAVID网站(https://david.ncifcrf.gov/)对上调表达基因进行生物学进程(biological process,BP)、细胞组分(cellular component,CC)及分子功能(molecular function,MF)等富集分析。选择胰腺导管腺癌中SPP1作为高表达的差异基因进行后续分析。通过基因表达谱动态分析在线网站(Gene Expression Profiling Interactive Analysis,GEPIA;https://gepia.cancer-pku.cn/index.html)[14]验证癌症基因组图谱(The Cancer Genome Atlas,TGCA;https://portal.gdc.cancer.gov)和基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库https://commonfund.nih.gov/GTEx)中SPP1在胰腺导管腺癌中的表达及其与患者生存期的关系。
1.2 标本来源选取2017年1月至2019年8月中国医科大学附属盛京医院病理科临床资料完整的胰腺导管腺癌石蜡标本56例,所有患者均行胰腺十二指肠切除术,术前均未接受放疗、化疗。选取癌旁正常胰腺导管组织作为对照(共39例)。根据肿物病理学组织分级标准,高分化16例、中分化27例、低分化13例。按照美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版[15]TNM分期标准,Ⅰ期22例、Ⅱ期24例、Ⅲ期6例、Ⅳ期4例。根据肿物大小分期标准,1期7例、2期26例、3期18例、4期5例。有淋巴结转移16例,其中N分期1期11例,2期5例;无淋巴结转移40例。有远处转移4例,无远处转移52例。本研究已获得医院伦理委员会批准(2022PS403K)。
1.3 主要试剂和仪器鼠抗人SPP1(也称Osteopontin,OPN)单克隆抗体(sc-21742)购自美国Santa公司,鼠兔通用二步法检测试剂盒(PV-9000)和DAB显色试剂盒购自北京中杉金桥生物技术有限公司,组织切片机和光学显微镜购自德国Leica公司。
1.4 免疫组化检测制备4 μm石蜡组织切片,切片在二甲苯溶液中脱蜡2次,10 min/次,随后经100%、100%、95%、80%和75%乙醇溶液梯度各水化5 min,置于磷酸盐缓冲溶液(phosphate-buffered saline,PBS)中5 min;将组织切片置于pH 6.0的柠檬酸钠修复液中。高压锅加热保持7 min进行抗原修复,冷却后用PBS冲洗切片;滴加内源性过氧化物酶阻断剂,室温孵育40 min,PBS冲洗切片;滴加一抗鼠抗人SPP1单克隆抗体(体积稀释比例1∶200),于4 ℃冰箱孵育过夜;次日滴加二抗,室温孵育30 min,PBS冲洗切片;DAB显色,苏木素复染,封片。用PBS替代一抗作为阴性对照。
1.5 免疫组化结果判读标准SPP1主要表达在细胞质中,随机选取10个高倍视野(×400),由2名病理科医生独立阅片。按照阳性细胞染色强度计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。按照阳性细胞染色面积计分:≤5%为0分,> 5%~25%为1分,> 25%~50%为2分,> 50%~75%为3分,> 75%~100%为4分。染色评分结果取染色强度与染色面积评分乘积,≤2分为阴性表达,> 2分为阳性表达[16]。
1.6 随访56例患者中有49例(87.5%)得到有效随访。随访方式为电话随访,随访终点为患者死亡。随访时间为28.8~59.7个月,平均随访时间46.7个月。
1.7 统计学分析采用SPSS 26.0及GraphPad Prism 9.0软件进行统计学处理,采用χ2检验比较胰腺导管腺癌与正常胰腺导管组织中SPP1表达阳性率,采用Kaplan-Meier法进行生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 SPP1在胰腺导管腺癌及正常对照组织中的表达GEO数据库中GSE15471和GSE16515数据集取交集分析得出胰腺导管腺癌中上调的差异表达基因(differentially expressed gene,DEG)703个,下调的DEG 143个,见图 1。
|
| A, up-regulated DEGs; B, down-regulated DEGs. 图 1 GSE15471和GSE16515数据集中上调和下调DEGs的韦恩图 Fig.1 Venn diagrams for up- and down-regulated DEGs in the GSE15471 and GSE16515 databases |
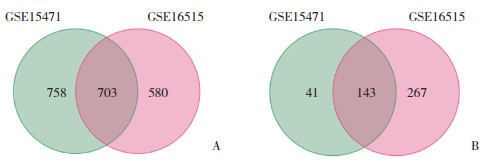
上调的DEG在STRING中进行PPI网络分析,随后将PPI网络通过Cytoscape可视化,在Cytoscape中经过MCODE计算后获得排名前三位的共表达网络簇,见图 2A。下调的DEG经过STRING构建PPI网络,再通过cytoscape进行可视化,见图 2B。
|
| A, top three co-expression PPI in up-regulated DEGs calculated by MCODE and where SPP1 locates was marked as yellow; B, PPI of down-regulated DEGs visualized by cytoscape. 图 2 部分上调和下调表达的DEG蛋白互作网络构建 Fig.2 Protein-protein interaction network of partially up-regulated DEGs and down-regulated DEGs |
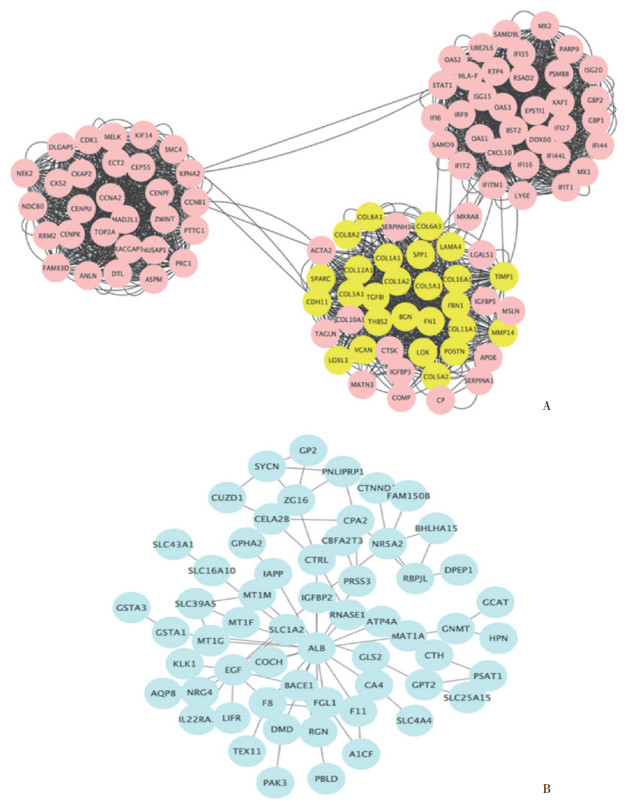
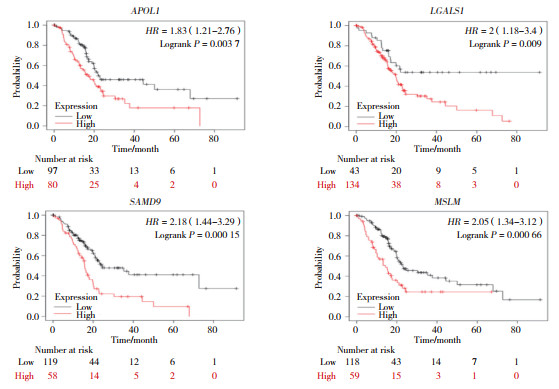
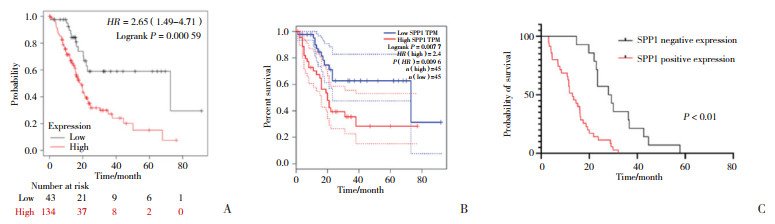
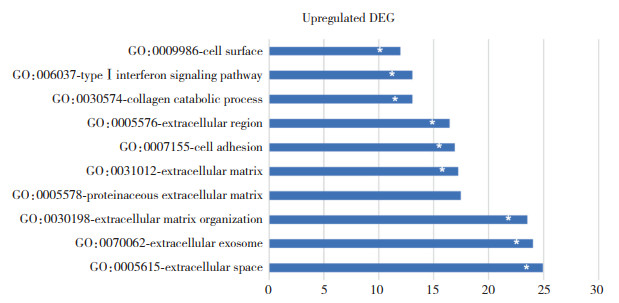
在Kaplan-Meier Plotter数据库中共检索到胰腺导管腺癌177例,按照mRNA表达水平截断值的75%为高表达,截断值的25%为低表达,将上调的DEG经筛选后发现,APOL1、LGALS1、SAMD9、SPP1、MSLN基因高表达时,患者生存期缩短(P < 0.01)。APOL1、LGALS1、SAMD9、SPP1、MSLN基因的表达与胰腺癌预后不良相关(图 3、图 4A)。而在基因功能富集分析中,上调的DEG根据P值排在前五位的依次为细胞外区域、细胞外泌体、细胞外基质形成、蛋白质的细胞外基质、细胞外基质(图 5)。其中SPP1被富集在细胞外区域、细胞外泌体、细胞外基质形成、细胞外基质、细胞黏附、胶原降解代谢过程等过程中。
|
| 图 3 Kaplan-Meier Plotter数据库中APOL1、LGALS1、SAMD9、MSLN基因与胰腺癌预后相关分析 Fig.3 Correlation analysis between APOL1, LGALS1, SAMD9, and MSLN genes and the prognosis of patients with pancreatic ductal adenocarcinoma on Kaplan-Meier Plotter |
|
| A, based on Kaplan-Meier Plotter; B, based on GEPIA; C, Kaplan-Meier survival curve. 图 4 SPP1蛋白表达与胰腺导管腺癌患者预后的关系 Fig.4 Relationship between SPP1 expression and the prognosis of patients with pancreatic ductal adenocarcinoma |
|
| GO, gene ontology. *in which SPP1 locates 图 5 DAVID数据库中上调的DEG细胞功能富集分析 Fig.5 Cellular function enrichment analysis of up-regulated DEGs from DAVID |
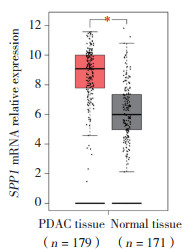
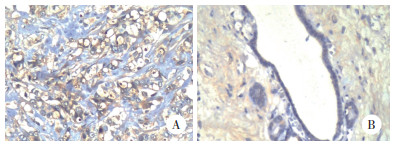
GEPIA数据库中检索到179例胰腺导管腺癌肿瘤组织和171例肿瘤旁正常组织,肿瘤组织中SPP1 mRNA表达显著高于正常组织(P < 0.01,图 6)。免疫组化结果显示,SPP1蛋白在胰腺导管腺癌的癌细胞胞质中表达(图 7)。胰腺导管腺癌中SPP1阳性表达40例(71.43%),正常胰腺导管组织中SPP1阳性表达4例(10.26%),2者比较差异有统计学意义(χ2 = 34.60,P < 0.01)。
|
| *P < 0.01. PDAC, pancreatic ductal adenocarcinoma. 图 6 GEPIA数据库中胰腺癌组织和正常组织中SPP1 mRNA表达情况 Fig.6 SPP1 mRNA expression in pancreatic ductal adenocarcinoma and normal tissues from the GEPIA database |
|
| A, pancreatic ductal adenocarcinoma; B, pancreatic ductal tissue. 图 7 胰腺导管腺癌和正常组织中SPP1表达的免疫组化染色结果×200 Fig.7 Immunohistochemical staining for SPP1 expression in pancreatic ductal adenocarcinoma and pancreatic ductal tissue×200 |
SPP1在胰腺导管腺癌中的阳性表达与临床病理参数的相关性分析结果显示,高分化的胰腺导管腺癌中的阳性表达率为50.00%(8/16),中分化的阳性表达率为74.07%(20/27),低分化的阳性表达率为92.31%(12/13),SPP1的阳性表达与组织分化程度相关(P < 0.05)。
2.2 SPP1表达与胰腺导管腺癌预后的关系GEPIA数据库中90例胰腺导管腺癌患者同样按照mRNA表达水平截断值的75%为高表达,截断值的25%为低表达来分组,结果显示SPP1高表达患者预后不佳(P < 0.05,图 4B)。
本研究随访截止日期为2022年1月。截止随访时间为止,SPP1阴性表达组死亡10例(62.50%),而SPP1阳性表达组死亡32例(80.00%)。Kaplan-Meier法分析SPP1的表达与胰腺导管腺癌患者生存期的相关性结果显示,SPP1阳性表达患者总生存期较SPP1阴性表达患者短,差异有统计学意义(P < 0.01,图 4C)。
3 讨论胰腺癌具有“三高三低”的特点,即发病率高、复发转移率高、死亡率高,早期诊断率低、治疗有效率低、5年生存率低,是公认的“癌中之王”[17]。因此明确胰腺癌高度恶性生物学行为的可能原因至关重要。
本研究通过GEO数据库筛选出胰腺癌上调的DEG 703个,下调的DEG 143个。DEG中APOL1、LGALS1、SAMD9、SPP1、MSLN等基因的表达与胰腺癌患者预后不良相关。对上调的DEG进行富集分析后,发现基因在细胞外区域、细胞外泌体、细胞外基质形成、细胞黏附等过程富集。提示胰腺癌的高度恶性生物学行为可能与细胞外丰富的基质形成、肿瘤的微环境形成高度相关。而SPP1表达既参与细胞外基质,也与胰腺癌患者预后不良相关,值得研究者高度关注。
本研究结果显示,GEO和GEPIA数据库中与正常对照比较,胰腺导管腺癌中SPP1 mRNA表达上调。而免疫组化结果显示SPP1蛋白在胰腺导管腺癌中的阳性表达率显著高于正常胰腺导管组织,与生物信息学分析结果一致。分析SPP1表达与胰腺癌患者临床病理学特征之间的关系发现,SPP1在高、中、低不同分化的胰腺导管腺癌中的阳性表达率差异有统计学意义(P < 0.05),并且分化程度越低,SPP1的表达率越高(P < 0.05)。Kaplan-Meier生存分析显示,SPP1阳性表达患者总生存期较SPP1阴性表达患者短,差异有统计学意义(P < 0.01)。说明SPP1在胰腺导管腺癌中的表达与预后不良显著相关。
Kaplan-Meier Plotter及GEPIA数据库分析结果显示,SPP1 mRNA表达对患者的生存期存在影响,当SPP1呈现高表达时,患者生存期缩短,这与本研究的生存分析结果一致。富集分析结果显示,SPP1可以存在于细胞外区域,并且参与胶原降解代谢过程及细胞黏附过程。细胞外基质改变和细胞黏附过程是肿瘤侵袭和转移的重要步骤,提示SPP1可能通过此途径影响胰腺癌患者预后。
有研究[18-23]表明SPP1参与了诸多肿瘤的进程,促进了肿瘤的增殖、侵袭等功能。PANG等[18]证实在前列腺癌中,沉默SPP1可抑制p-PI3K及磷酸化蛋白激酶(phosphorylated protein kinase,p-AKT)的表达,提示SPP1可以通过PI3K/AKT途径促进肿瘤的增殖侵袭。XU等[19]证实在结直肠癌组织中SPP1表达升高,沉默SPP1的表达抑制结直肠癌细胞系的细胞增殖、侵袭、转移及上皮-间质转化(epithelial-mesenchymal transition,EMT)等功能。此外,SPP1还参与了肿瘤微环境形成,WEI等[20]通过单细胞测序发现SPP1在TAM中表达,并且通过实验证实与肿瘤细胞存在相互作用,促进肿瘤细胞EMT。ZENG等[21]通过细胞功能实验及调控卵巢癌细胞系中SPP1的表达,检测整合素β1亚基、黏着斑激酶、p-AKT B的表达水平,结果表明SPP1可以通过整合素β1亚基/FAK/AKT途径促进卵巢癌进展。WANG等[22]证实SPP1可以作为下游靶蛋白,上调后通过NF-κB途径,促进肾细胞癌细胞的细胞黏附、侵袭。LIU等[23]通过生物信息学分析和RNA测序发现SPP1在肝细胞癌细胞和TAM中表达升高,促进了TAM的M2极化,并且可能通过CD44或者PTGER4受体发挥作用。诸多证据表明,在前列腺癌、结肠癌、卵巢癌等恶性肿瘤中,SPP1表达升高时肿瘤的恶性生物学行为(增殖、侵袭、转移等)增加。而且SPP1表达与肿瘤微环境中的巨噬细胞M2极化相关,抑制了肿瘤微环境中的炎症反应,间接促进了肿瘤的恶性生物学行为,与本研究结果一致。
综上所述,胰腺导管腺癌中SPP1表达升高,并且与组织学分级、患者预后密切相关,其作用机制可能是通过改变细胞外基质组成、增加细胞黏附、促进肿瘤细胞增殖、改变TAM等途径来实现的,SPP1可能是胰腺癌不良预后的潜在生物学标志物。
| [1] |
SIEGEL RL, MILLER KD, FUCHS HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
YING HQ, DEY P, YAO WT, et al. Genetics and biology of pancreatic ductal adenocarcinoma[J]. Genes Dev, 2016, 30(4): 355-385. DOI:10.1101/gad.275776.115 |
| [3] |
LIANG C, SHI S, MENG QC, et al. Complex roles of the stroma in the intrinsic resistance to gemcitabine in pancreatic cancer: where we are and where we are going[J]. Exp Mol Med, 2017, 49(12): e406. DOI:10.1038/emm.2017.255 |
| [4] |
CHRONOPOULOS A, ROBINSON B, SARPER M, et al. ATRA mechanically reprograms pancreatic stellate cells to suppress matrix remodelling and inhibit cancer cell invasion[J]. Nat Commun, 2016, 7: 12630. DOI:10.1038/ncomms12630 |
| [5] |
PERDIGUERO EG, GEISSMANN F. Cancer immunology. Identifying the infiltrators[J]. Science, 2014, 344(6186): 801-802. DOI:10.1126/science.1255117 |
| [6] |
KITAMURA T, QIAN BZ, POLLARD JW. Immune cell promotion of metastasis[J]. Nat Rev Immunol, 2015, 15(2): 73-86. DOI:10.1038/nri3789 |
| [7] |
XUE J, SHARMA V, HSIEH MH, et al. Alternatively activated macrophages promote pancreatic fibrosis in chronic pancreatitis[J]. Nat Commun, 2015, 6: 7158. DOI:10.1038/ncomms8158 |
| [8] |
KANEDA MM, CAPPELLO P, NGUYEN AV, et al. Macrophage PI3Kγ drives pancreatic ductal adenocarcinoma progression[J]. Cancer Discov, 2016, 6(8): 870-885. DOI:10.1158/2159-8290.CD-15-1346 |
| [9] |
SHI CJ, WASHINGTON MK, CHATURVEDI R, et al. Fibrogenesis in pancreatic cancer is a dynamic process regulated by macrophage-stellate cell interaction[J]. Lab Invest, 2014, 94(4): 409-421. DOI:10.1038/labinvest.2014.10 |
| [10] |
SCHMID-KOTSAS A, GROSS HJ, MENKE A, et al. Lipopolysaccharide-activated macrophages stimulate the synthesis of collagen type I and C-fibronectin in cultured pancreatic stellate cells[J]. Am J Pathol, 1999, 155(5): 1749-1758. DOI:10.1016/S0002-9440(10)65490-9 |
| [11] |
WANG JB, ZHANG Z, LI JN, et al. SPP1 promotes Schwann cell proliferation and survival through PKCα by binding with CD44 and αvβ3 after peripheral nerve injury[J]. Cell Biosci, 2020, 10: 98. DOI:10.1186/s13578-020-00458-4 |
| [12] |
SHIRAKAWA K, ENDO J, KATAOKA M, et al. IL (interleukin)-10-STAT3-galectin-3 axis is essential for osteopontin-producing reparative macrophage polarization after myocardial infarction[J]. Circulation, 2018, 138(18): 2021-2035. DOI:10.1161/CIRCULATIONAHA.118.035047 |
| [13] |
KOLB A, KLEEFF J, GUWEIDHI A, et al. Osteopontin influences the invasiveness of pancreatic cancer cells and is increased in neoplastic and inflammatory conditions[J]. Cancer Biol Ther, 2005, 4(7): 740-746. DOI:10.4161/cbt.4.7.1821 |
| [14] |
TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(w1): W98-W102. DOI:10.1093/nar/gkx247 |
| [15] |
AMIN MB, GREENE FL, EDGE SB, et al. The Eighth Edition AJCC Cancer Staging Manual: continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging[J]. CA Cancer J Clin, 2017, 67(2): 93-99. DOI:10.3322/caac.21388 |
| [16] |
秦雯, 陈泰文, 郑海平, 等. 胰腺癌组织中SOX4和E-cadherin的表达及临床意义[J]. 临床与实验病理学杂志, 2021, 37(10): 1160-1165. DOI:10.13315/j.cnki.cjcep.2021.10.003 |
| [17] |
崔瀚之, 樊梦娇, 吴超, 等. 晚期胰腺癌治疗现状与进展[J]. 解放军医学院学报, 2020, 41(9): 926-929. DOI:10.3969/j.issn.2095-5227.2020.09.018 |
| [18] |
PANG XC, ZHANG JL, HE X, et al. SPP1 promotes enzalutamide resistance and epithelial-mesenchymal-transition activation in castration-resistant prostate cancer via PI3K/AKT and ERK1/2 pathways[J]. Oxid Med Cell Longev, 2021, 2021: 5806602. DOI:10.1155/2021/5806602 |
| [19] |
XU CJ, SUN LC, JIANG CH, et al. SPP1, analyzed by bioinformatics methods, promotes the metastasis in colorectal cancer by activating EMT pathway[J]. Biomed Pharmacother, 2017, 91: 1167-1177. DOI:10.1016/j.biopha.2017.05.056 |
| [20] |
WEI JF, CHEN ZX, HU ML, et al. Characterizing intercellular communication of pan-cancer reveals SPP1+ tumor-associated macrophage expanded in hypoxia and promoting cancer malignancy through single-cell RNA-seq data[J]. Front Cell Dev Biol, 2021, 9: 749210. DOI:10.3389/fcell.2021.749210 |
| [21] |
ZENG B, ZHOU M, WU H, et al. SPP1 promotes ovarian cancer progression via Integrin β1/FAK/AKT signaling pathway[J]. Onco Targets Ther, 2018, 11: 1333-1343. DOI:10.2147/OTT.S154215 |
| [22] |
WANG Y, SU J, WANG YT, et al. The interaction of YBX1 with G3BP1 promotes renal cell carcinoma cell metastasis via YBX1/G3BP1-SPP1- NF-κB signaling axis[J]. J Exp Clin Cancer Res, 2019, 38(1): 386. DOI:10.1186/s13046-019-1347-0 |
| [23] |
LIU LL, ZHANG RY, DENG JW, et al. Construction of TME and Identification of crosstalk between malignant cells and macrophages by SPP1 in hepatocellular carcinoma[J]. Cancer Immunol Immunother, 2022, 71(1): 121-136. DOI:10.1007/s00262-021-02967-8 |
 2023, Vol. 52
2023, Vol. 52