文章信息
- 关琳, 王传合, 孙志军
- GUAN Lin, WANG Chuanhe, SUN Zhijun
- 低T3综合征对心力衰竭患者预后的影响
- Influence of low T3 syndrome on prognosis of patients with heart failure
- 中国医科大学学报, 2022, 51(9): 794-799
- Journal of China Medical University, 2022, 51(9): 794-799
-
文章历史
- 收稿日期:2021-10-19
- 网络出版时间:2022-08-15 9:09
心血管疾病是全世界人口死亡的主要原因。心力衰竭(简称心衰) 是各种心血管疾病的终末表现,尽管预防、早期发现和更好的治疗措施可以改善心衰患者的预后,但心衰患者的发病率和死亡率仍然居高不下[1]。很大一部分心衰患者存在某种形式的甲状腺功能障碍,包括甲状腺功能减退症、甲状腺功能亢进症和低T3综合征[2]。有研究[3]发现心衰患者血清T3水平降低。同时低T3水平与心衰患者的死亡率升高有密切的关系。最新研究[4]表明,与安慰剂相比,轻度甲状腺功能减退的老年人在使用左旋三碘甲状腺原氨酸(L-triiodothyronine,LT3)治疗后,心脏收缩和舒张功能均无统计学差异。目前,关于低T3综合征对心衰患者临床预后影响的研究较少,本研究旨在通过对心衰患者相关临床资料进行大样本回顾性分析,探讨低T3综合征对心衰患者预后的意义,以提高对慢性心衰患者伴有低T3综合征的认识。
1 材料与方法 1.1 研究对象连续收集中国医科大学附属盛京医院心内科2013年1月至2018年12月因心衰住院10 607例患者的临床资料,并建立回顾性队列数据库。纳入标准:(1) 年龄≥18岁;(2) 入院时已依据纽约心脏病协会(New York Heart Association,NYHA) 心功能分级标准评价其心功能水平,心功能Ⅱ~Ⅳ级;(3) 入院时已完善甲状腺功能指标检测。排除标准:(1) 现患有或既往有器质性甲状腺疾病;(2) 近期服用影响甲状腺激素水平的药物;(3) 患有严重疾病,如恶性肿瘤等。
1.2 方法本研究为回顾性研究,以查阅病历的方式进行回顾性调查,收集研究对象的临床资料包括一般情况、既往疾病史、体格检查、实验室指标及相关物理检查等。其中,实验室指标均为入院后24 h内抽取外周静脉血检测的结果;心脏彩超检查结果为入院3 d内测定的超声心动图结果。以Simpson法测量左心室射血分数(left ventricular ejection fraction,LVEF)。肝功能、肾功能、尿酸、血清离子等大生化检查通过贝克曼AU5400或AU5800生化检测仪检测。根据患者入院后检测的甲状腺功能,将其分为低T3综合征组[游离三碘甲状腺原氨酸(free triiodothyronine,FT3) < 2.43 pmol/L,促甲状腺激素(thyroid stimulating hormone,TSH) 正常] 以及甲状腺功能正常组[FT3、游离甲状腺素(free thyroxine,FT4)、TSH均正常]。各项参考值为FT3 2.43~6.01 pmol/L,FT4 9.01~19.05 pmol/L,TSH 0.3~4.8 μIU/mL。分别于患者出院后3个月、6个月、1年对患者进行电话随访,主要记录患者的死亡及再住院情况,以1年内的全因死亡作为主要终点事件,终点事件发生或随访截止时间为研究数据分析截止时间。
1.3 统计学分析采用SPSS 26.0软件建立数据库并进行统计分析,符合正态分布的计量资料行t检验,以x±s表示;不符合正态分布的计量资料行Mann-Whitney U秩和检验,采用M(P25~P75) 表示;计数资料行χ2检验,采用率(%) 表示。采用多因素Cox回归分析评价低T3综合征对心衰患者预后的预测价值。受试者操作特征(receiver operating characteristic,ROC) 曲线比较各独立危险对1年内死亡发生的预测价值。P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线情况共纳入7 780例心衰患者资料,其中低T3综合征组687例,甲状腺功能正常组7 093例。全部研究对象的平均年龄为70岁,男性占55.2%,平均LVEF为50%,入院时NYHAⅡ级、Ⅲ级和Ⅳ级患者分别占22.8%、42.8%和34.4%。合并冠状动脉粥样硬化性心脏病(简称冠心病)、高血压,2型糖尿病,心房颤动的比例分别为66.7%、62.2%、33.2%、33.1%。低T3综合征组与甲状腺功能正常组相比,平均年龄、N末端前体脑利钠肽(N-terminal pro-B type natriuretic peptide,NT-proBNP)、尿素氮、肌酐、尿酸、血钾和cTNⅠ水平较高;白蛋白、甘油三酯、血钠、血氯、低密度脂蛋白、血红蛋白、血小板、LVEF和收缩压水平较低,低T3综合征与冠心病无关,见表 1。
| Item | Total(n= 7 780) | Low T3 syndrome(n= 687) | Normal thyroid function(n= 7 093) | P |
| Age [M(P25-P75),year] | 70(61-79) | 74(64-81) | 70(60-79) | < 0.001 |
| Male [n(%)] | 4 292 | 325(47.3) | 3 967(55.9) | < 0.001 |
| TSH [M(P25-P75),μIU/mL] | 1.51(0.94-2.31) | 1.32(0.79-2.16) | 1.52(0.95-2.32) | < 0.001 |
| NYHA functional classification [n(%)] | < 0.001 | |||
| Ⅱ | 1 770 | 41(6.0) | 1 729(24.4) | |
| Ⅲ | 3 330 | 268(39.0) | 3 062(43.2) | |
| Ⅳ | 2 680 | 378(55.0) | 2 302(32.5) | |
| CHD [n(%)] | 5 192 | 450(65.5) | 4 742(66.9) | 0.473 |
| Hypertension [n(%)] | 4 842 | 384(55.9) | 4 458(62.9) | < 0.001 |
| Diabetes mellitus [n(%)] | 2 583 | 267(38.9) | 2 316(32.7) | 0.001 |
| Atrial fibrillation [n(%)] | 2 579 | 187(27.2) | 2 392(33.7) | < 0.001 |
| smoking history [n(%)] | 2 201 | 161(23.4) | 2 040(28.8) | 0.003 |
| BUN [M(P25-P75),mmol/L] | 7.29(5.59-9.57) | 11.31(8.01-17.17) | 7.09(5.51-9.02) | < 0.001 |
| Creatinine [M(P25-P75),μmol/L] | 82.45(67.30-103.00) | 108.10(80.80-167.40) | 81.00(66.70-102.15) | < 0.001 |
| Uric acid [M(P25-P75),μmol/L] | 439.69(343.00-498.00) | 459.10(381.10-625.80) | 439.69(341.40-487.40) | < 0.001 |
| Albumin [M(P25-P75),g/L] | 37.3(34.8-40.1) | 33.6(30.3-36.9) | 37.6(35.3-40.3) | < 0.001 |
| TG [M(P25-P75),mmol/L] | 1.10(0.78-1.55) | 0.95(0.68-1.33) | 1.12(0.80-1.58) | < 0.001 |
| LDL [M(P25-P75),mmol/L] | 2.50(1.92-3.10) | 2.24(1.75-2.74) | 2.52(1.94-3.12) | < 0.001 |
| Hemoglobin [M(P25-P75),g/L] | 129.00(117.00-143.00) | 117.00(96.00-134.00) | 130.00(119.00-143.00) | < 0.001 |
| Platelet [M(P25-P75),g/L] | 188.00(152.00-223.00) | 181.00(140.00-231.00) | 188.00(153.00-223.00) | 0.022 |
| HbA1C [M(P25-P75),%] | 6.2(5.7,6.8) | 6.4(5.7,6.9) | 6.2(5.7,6.8) | 0.052 |
| Potassium [M(P25-P75),mmol/L] | 4.04(3.75-4.33) | 4.14(3.77-4.58) | 4.03(3.75-4.31) | < 0.001 |
| Sodium [M(P25-P75),mmol/L] | 139.1(137.0-141.1) | 137.0(133.4-140.0) | 139.5(137.4-141.3) | < 0.001 |
| Chlorinum [M(P25-P75),mmol/L] | 105.4(102.6-107.9) | 102.4(98.2-106.4) | 105.5(102.9-108.0) | < 0.001 |
| cTNⅠ [M(P25-P75)] | 0.03(0.01-0.10) | 0.07(0.03-0.58) | 0.03(0.01-0.09) | < 0.001 |
| NT-proBNP [M(P25-P75),pg/mL] | 2 996.50(1 135.50-6 568.38) | 7 924.50(4 060.00-15 057.00) | 2 731.00(1 034.50-5 859.50) | < 0.001 |
| LVEF [M(P25-P75),%] | 50(40-59) | 45(36-56) | 50(40-59) | < 0.001 |
| Systolic pressure [M(P25-P75),mmHg] | 136(120-148) | 133(113-141) | 136(121-149) | < 0.001 |
| Heart rate [M(P25-P75),beat/min] | 87(73-96) | 87(77-100) | 87(72-96) | < 0.001 |
| CHD,coronary heart disease;BUN,blood urea nitrogen;TG,triglyceride;LDL,low density lipoprotein;HbA1C,glycosylated hemoglobin;cTNⅠ,cardiac troponinⅠ. | ||||
2.2 不同NYHA分级中NT-proBNP和FT3水平的变化
7 780例患者中,不同NYHA分级中NT-proBNP和FT3水平以中位数(95%CI) 表示。NYHAⅡ级(1 770例),NT-proBNP 938.8(399.1~2 252.875) pg/mL,FT3 3.83(3.40~4.27) pmol/L;NYHA Ⅲ级(3 330例),NT-proBNP 2 961.0(1 307.5~6 025.0) pg/mL,FT3 3.56(3.04~4.06) pmol/L;NYHA Ⅳ级(2 680例),NT-proBNP 5316.0(2 591.4~10 625.3) pg/mL,FT3 3.29(2.75~3.81) pmol/L。不同NYHA分级间NT-proBNP和FT3水平的比较采用Mann-Whitney U检验,结果显示,随着NYHA分级的增加,NT-proBNP水平逐级升高,FT3水平逐级下降,各分级间的差异有统计学意义(P < 0.01)。见表 2。
| NYHA | n | NT-proBNP(pg/mL) | FT3(pmol/L) |
| Ⅱ | 1 770 | 938.8(399.1-2 252.875) | 3.83(3.40-4.27) |
| Ⅲ | 3 330 | 2 961.0(1 307.5-6 025.0) | 3.56(3.04-4.06) |
| Ⅳ | 2 680 | 5 316.0(2 591.4-10 625.3) | 3.29(2.75-3.81) |
2.3 心衰患者预后的独立危险因素
将变量纳入多因素Cox分析模型,在校正患者性别、高血压、吸烟史、血小板、糖化血红蛋白、心率等混杂因素后,发现低T3综合征为心衰患者死亡的独立危险因素(HR=1.381,95%CI:1.185~1.608)。低T3组1年内死亡风险是甲状腺功能正常组1.381倍,见表 3、4。
| Variable | HR | 95%CI | P |
| Low T3 syndrome | 3.816 | 3.335-4.365 | < 0.001 |
| Age | 1.031 | 1.026-1.036 | < 0.001 |
| Female | 0.967 | 0.863-1.084 | 0.570 |
| NYHA functional class | 2.148 | 1.970-2.342 | < 0.001 |
| CHD | 1.249 | 1.102-1.415 | 0.001 |
| Hypertension | 0.894 | 0.796-1.004 | 0.058 |
| Diabetes mellitus | 1.316 | 1.172-1.478 | < 0.001 |
| Proxysmal atrial fibrillation | 0.511 | 0.401-0.652 | < 0.001 |
| Persistent atrial fibrillation | 0.715 | 0.618-0.827 | < 0.001 |
| Smoking history | 0.990 | 0.873-1.123 | 0.878 |
| BUN | 1.079 | 1.073-1.086 | < 0.001 |
| Creatinine | 1.003 | 1.002-1.003 | < 0.001 |
| Uric acid | 1.003 | 1.002-1.003 | < 0.001 |
| Albumin | 0.891 | 0.880-0.901 | < 0.001 |
| TG | 0.793 | 0.731-0.861 | < 0.001 |
| LDL | 0.888 | 0.833-0.947 | < 0.001 |
| Hemoglobin | 0.979 | 0.977-0.981 | < 0.001 |
| Platelet | 0.999 | 0.999-1.000 | 0.201 |
| HbA1C | 1.027 | 0.984-1.071 | 0.221 |
| Potassium | 1.435 | 1.305-1.579 | < 0.001 |
| Sodium | 0.929 | 0.917-0.941 | < 0.001 |
| Chlorinum | 0.940 | 0.930-0.951 | < 0.001 |
| cTNⅠ | 1.012 | 1.007-1.018 | < 0.001 |
| NT-proBNP | 1.000 | 1.000-1.000 | < 0.001 |
| LVEF | 0.975 | 0.970-0.979 | < 0.001 |
| Systolic pressure | 0.993 | 0.991-0.996 | < 0.001 |
| Heart rate | 1.002 | 0.999-1.005 | 0.131 |
| Variable | HR | 95%CI | P |
| Low T3 syndrome | 1.381 | 1.185-1.608 | < 0.001 |
| Age | 1.029 | 1.023-1.034 | < 0.001 |
| NYHA functional class | 1.399 | 1.269-1.542 | < 0.001 |
| CHD | 0.990 | 0.863-1.134 | 0.881 |
| Diabetes mellitus | 1.135 | 1.000-1.288 | 0.050 |
| Paroxysmal atrial fibrillation | 1.015 | 0.790-1.304 | 0.905 |
| Persistent atrial fibrillation | 0.931 | 0.799-1.084 | 0.355 |
| BUN | 1.026 | 1.012-1.039 | < 0.001 |
| Creatinine | 1.000 | 0.999-1.001 | 0.640 |
| Uric acid | 1.001 | 1.001-1.002 | < 0.001 |
| Albumin | 0.949 | 0.935-0.963 | < 0.001 |
| TG | 0.922 | 0.851-0.998 | 0.046 |
| LDL | 1.029 | 0.964-1.098 | 0.391 |
| Hemoglobin | 0.990 | 0.988-0.993 | < 0.001 |
| Potassium | 0.997 | 0.900-1.105 | 0.955 |
| Sodium | 0.997 | 0.979-1.015 | 0.755 |
| Chlorinum | 0.976 | 0.961-0.991 | 0.002 |
| cTNⅠ | 1.010 | 1.004-1.015 | 0.001 |
| NT-proBNP | 1.000 | 1.000-1.000 | < 0.001 |
| LVEF | 0.986 | 0.980-0.991 | < 0.001 |
| Systolic pressure | 0.995 | 0.993-0.998 | 0.001 |
2.4 患者出院后的生存情况
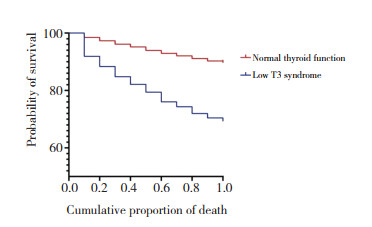
Kaplan-Meier分析结果显示,低T3综合征组与甲状腺功能正常组1年内死亡终点事件有统计学差异(χ2=244.7,P < 0.000 1),见图 1。
|
| 图 1 低T3综合征组与甲状腺功能正常组心衰1年内死亡累积比例 Fig.1 Cumulative proportion of deaths due to heart failure in the low T3 syndrome and normal thyroid function groups within one year |
2.5 ROC曲线比较T3和NT-proBNP对心衰患者预后的预测价值
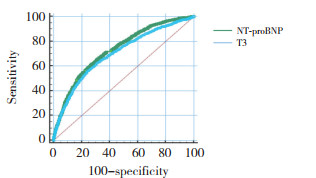
采用ROC曲线的约登指数确定T3预测心衰1年内死亡发生的最佳界值,T3的最佳界值为3.12 pmol/L,曲线下面积为0.702,灵敏度为56%,特异度为76%。NT-ProBNP最佳界值为5 106 pg/mL,曲线下面积为0.730,灵敏度为61%,特异度为73%。T3与NT-proBNP曲线下面积差异有统计学意义(z = 2.998,P = 0.002 7),见图 2。
|
| 图 2 T3和NT-proBNP对心衰患者预后的预测价的ROC曲线比较 Fig.2 Receiver operating characteristic curve comparison of T3 and NT-proBNP for predicting the prognosis of patients with heart failure |
3 讨论
甲状腺激素对心脏具有正性肌力作用,并与肾上腺素能系统相互联系[5]。甲状腺激素通过调节周围血管张力使血流动力学发生改变,进而影响心室的收缩功能。同时,T3通过对肌球蛋白亚型和调控蛋白的作用来增加收缩力和舒张速度;此外,T3可以降低包括冠状动脉在内的血管阻力,并促进冠状动脉的血管生成[6]。
既往研究[7-8]表明,心衰患者的FT3水平可能较低,但TSH和FT4水平在正常范围内。与此同时FT3水平的降低可能与心衰的严重程度成正比,较高的TSH、FT4水平和较低的FT3水平均可能导致更严重的心衰症状出现,并且还增加了心脏移植或全因死亡率的风险。IERVASI等[9]的前瞻性研究发现,FT3是预测心脏病患者累积死亡最有价值的指标。提示低T3综合征是预测心脏病患者死亡风险的有效指标,可能直接与心脏病患者的预后不良有关。同时与NYHAI-Ⅱ类患者相比,NYHA Ⅲ~Ⅳ类疾病患者的FT3水平较低。本研究也证实了随着NYHA分级的增加,T3水平逐级递减,各分级间的差异有统计学意义。
PINGITORE等[10]通过多变量模型预测全因和心源性死亡,发现低T3水平是心衰患者死亡的独立预测指标。PFISTER等[11]对615例心血管疾病患者的研究发现FT3和低T3综合征是死亡的预测指标,与NT-proBNP和其他已知的心血管风险指标无关。CHUANG等[12]通过纳入106例急性失代偿性心衰患者,最终发现T3水平似乎是心衰重症患者全因死亡和心脏死亡的独立预测因子,高NT-proBNP和低T3水平预示长期预后较差。本研究通过多因素Cox分析同样证实低T3综合征是心衰患者死亡的独立危险因素。低T3组1年内死亡风险是甲状腺功能正常组的1.381倍。
本研究结果显示,在慢性心衰患者1年内死亡的独立危险因素中,利用ROC曲线的约登指数确定T3预测心衰1年内死亡发生的最佳界值,T3的最佳界值为3.12 pmol/L,比诊断低T3综合征的界值(2.43 pmol/L)高,便于临床医生早期识别伴有甲状腺功能水平异常的心衰患者,给予及时有效的治疗。
综上所述,低T3综合征可以独立预测心衰患者死亡等结局事件,但本研究存在局限性,属于单中心回顾性研究,死亡样本量有限,与此同时本研究所用的数据库缺乏患者入院后的用药记录,因此,不能反映慢性心衰整体人群的情况,服用甲状腺素制剂、糖皮质激素、胺碘酮、肝素、普萘洛尔等药物患者的甲状腺功能指标可能会对结果造成影响。迄今为止,对于心衰患者补充左甲状腺素等药物进行替代治疗结果尚不统一,仍需要进行更大规模的研究以确定其临床应用价值。
| [1] |
SHAH KS, XU HL, MATSOUAKA RA, et al. Heart failure with preserved, borderline, and reduced ejection fraction: 5-year outcomes[J]. J Am Coll Cardiol, 2017, 70(20): 2476-2486. DOI:10.1016/j.jacc.2017.08.074 |
| [2] |
VALE C, NEVES JS, VON HAFE M, et al. The role of thyroid hormones in heart failure[J]. Cardiovasc Drugs Ther, 2019, 33(2): 179-188. DOI:10.1007/s10557-019-06870-4 |
| [3] |
SATO Y, YOSHIHISA A, KIMISHIMA Y, et al. Low T3 syndrome is associated with high mortality in hospitalized patients with heart failure[J]. J Card Fail, 2019, 25(3): 195-203. DOI:10.1016/j.cardfail.2019.01.007 |
| [4] |
GENCER B, MOUTZOURI E, BLUM MR, et al. The impact of levo- thyroxine on cardiac function in older adults with mild subclinical hypothyroidism: a randomized clinical trial[J]. Am J Med, 2020, 133(7): 848-856. DOI:10.1016/j.amjmed.2020.01.018 |
| [5] |
TEIXEIRA P, DOS SANTOS PB, PAZOS-MOURA CC. The role of thyroid hormone in metabolism and metabolic syndrome[J]. Ther Adv Endocrinol Metab, 2020, 11: 2042018820917869. DOI:10.1177/2042018820917869 |
| [6] |
LOURBOPOULOS AI, MOUROUZIS IS, TRIKAS AG, et al. Effects of thyroid hormone on tissue hypoxia: relevance to sepsis therapy[J]. J Clin Med, 2021, 10(24): 5855. DOI:10.3390/jcm10245855 |
| [7] |
RAZVI S, JABBAR A, PINGITORE A, et al. Thyroid hormones and cardiovascular function and diseases[J]. J Am Coll Cardiol, 2018, 71(16): 1781-1796. DOI:10.1016/j.jacc.2018.02.045 |
| [8] |
KANNAN L, SHAW PA, MORLEY MP, et al. Thyroid dysfunction in heart failure and cardiovascular outcomes[J]. Circ Heart Fail, 2018, 11(12): e005266. DOI:10.1161/CIRCHEARTFAILURE.118.005266 |
| [9] |
IERVASI G, PINGITORE A, LANDI P, et al. Low-T3 syndrome: a strong prognostic predictor of death in patients with heart di-sease[J]. Circulation, 2003, 107(5): 708-713. DOI:10.1161/01.cir.0000048124.64204.3f |
| [10] |
PINGITORE A, LANDI P, TADDEI MC, et al. Triiodothyronine levels for risk stratification of patients with chronic heart failure[J]. Am J Med, 2005, 118(2): 132-136. DOI:10.1016/j.amjmed.2004.07.052 |
| [11] |
PFISTER R, STRACK N, WIELCKENS K, et al. The relationship and prognostic impact of low-T3 syndrome and NT-pro-BNP in cardiovascular patients[J]. Int J Cardiol, 2010, 144(2): 187-190. DOI:10.1016/j.ijcard.2009.03.137 |
| [12] |
CHUANG CP, JONG YS, WU CY, et al. Impact of triiodothyronine and N-terminal pro-B-type natriuretic peptide on the long-term survival of critically ill patients with acute heart failure[J]. Am J Cardiol, 2014, 113(5): 845-850. DOI:10.1016/j.amjcard.2013.11.039 |
 2022, Vol. 51
2022, Vol. 51