文章信息
- 赖树盛, 王晗, 褚建祎, 张帆, 郑石磊
- LAI Shusheng, WANG Han, CHU Jiany, ZHANG Fan, ZHENG hilei
- 磁共振影像组学诊断脑卒中后创伤后应激障碍
- Application of magnetic resonance imaging radiomics in the diagnosis of post-stroke post-traumatic stress disorder
- 中国医科大学学报, 2022, 51(7): 604-610
- Journal of China Medical University, 2022, 51(7): 604-610
-
文章历史
- 收稿日期:2022-03-07
- 网络出版时间:2022-06-21 13:42
2. 泰安市中心医院医学影像中心,山东 泰安 271000;
3. 锦州医科大学附属第一医院放射科,辽宁 锦州 121001;
4. 锦州医科大学附属第一医院神经内科,辽宁 锦州 121001
2. Medical Imaging Center, Taian Central Hospital, Taian 271000, China;
3. Department of Radiology, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China;
4. Department of Neurology, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China
2019全球疾病伤害和危险因素负担研究显示,脑卒中是世界范围内第二致死原因、第三致残原因。近30年来,全球脑卒中事件绝对数量增加70%,相关死亡率增加43%[1]。脑卒中近似于严重的脑创伤事件,不仅造成患者诸多功能障碍,对患者心理、精神和情感等亦产生极大消极影响。创伤后应激障碍(post-traumatic stress disorder,PTSD) 是暴露于威胁生命的创伤性事件所引发的严重应激性精神障碍,美国精神病学会于1994年《诊断与统计手册:精神障碍》第4版首次提出心肌梗死、脑卒中等威胁生命的疾病能够引发PTSD[2]。研究[3]表明,脑卒中后PTSD的患病率为3%~37%,脑卒中后PTSD不仅降低患者药物依从性和相关生活质量等,更增加了患者的再梗死风险、死亡率。目前,脑卒中后PTSD的诊断主要依赖于患者临床表现、相关量表评分或精神访谈等,尚缺乏客观、便捷及有效的影像学评估方法[4]。本研究基于磁共振成像(magnetic resonance imaging,MRI) 影像组学方法分析并建立脑卒中后PTSD患者海马和杏仁核T2加权像(T2 weighted image,T2WI) 影像组学模型,探讨其诊断效能,为临床早期准确诊断和评估脑卒中后PTSD提供新的思路和影像学依据。
1 材料与方法 1.1 临床资料收集2019年10月至2021年10月锦州医科大学附属第一医院诊治的缺血性脑卒中患者146例,年龄36~59 (50.81±5.04) 岁。纳入标准:年龄 < 60岁;脑卒中为首次就诊;影像学检查符合缺血性脑卒中诊断标准;患者意识清楚并具有相应表达和认知水平;其他慢性疾病处于稳定状态;MRI影像资料完整且图像符合纹理分析要求;右利手。排除标准:年龄≥60岁;脑卒中复发;伴脑肿瘤等其他疾病;认知或表达严重障碍;既往精神类疾病史或经历严重创伤事件;MRI影像资料不完整或图像无法进行纹理分析。将患者随机分为训练组(脑卒中后PTSD和非PTSD患者各51例) 和测试组(脑卒中后PTSD和非PTSD患者各22例)。
1.2 MRI检查方法采用西门子Verio 3T超导MR扫描仪(德国西门子公司),8通道头颅线圈。研究对象于初诊和复诊时接受MRI检查,扫描序列包括T1加权像(T1 weighted image,T1WI)、T2WI、T2液体衰减反转恢复序列(T2-fluid attenuated inversion recovery,T2-FLAIR) 和扩散加权成像(diffusion-weighted imaging,DWI)。
矢状位TSE T1WI扫描参数:TR=2000ms,TE=9.9ms,TI=860ms,视野=240mm×216 mm,矩阵=320× 240,层厚=5.5mm,层间距=0.55mm。轴位TSE T1WI扫描参数:TR=1530 ms,TE=9ms,TI=681ms,视野=240 mm×204 mm,矩阵=320×240,层厚=5.5mm,层间距=0.55mm。轴位TSE T2WI扫描参数:TR=6000ms,TE=96ms,视野=240mm×204mm,矩阵=320×320,层厚=5.5mm,层间距=0.55mm。轴位T2-FLAIR扫描参数:TR=8500ms,TE=94ms,TI=2440ms,视野=240mm×204mm,矩阵=256×179,层厚=5.5mm,层间距=0.55mm。轴位EPI DWI扫描参数:TR=6700ms,TE=88 ms,视野=240mm×231mm,矩阵=162×162,层厚=5.5 ms,层间距=0.55ms,b值分别为0和1000。
1.3 临床特征和相关量表评分 1.3.1 临床特征收集患者的临床资料,包括年龄、性别、受教育程度、家庭月人均收入、职业、体质量指数、有无医疗保险以及既往高血压、糖尿病和高血脂情况等。
1.3.2 相关量表[5-7]评分(1) 家庭功能满意度,采用家庭关怀度指数问卷(family adaptation,partnership,growth,affection,and resolve index,APGAR),由家庭健康度、合作度、成长度、亲情度和亲密度组成,总分7~10代表家庭功能良好,4~6分代表中度功能障碍,0~3分代表严重功能障碍;(2) 神经损伤程度,在发病初期和发病后第14天,采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS) 进行评估,每个维度得分为3~5个级别,得分越高表示神经损伤越严重;(3) PTSD诊断,采用创伤后应激障碍症状清单平民版(PTSD checklist-civilian version,PCL-C) 进行评估,包括再体验、回避、警觉性增高3个症状群的17个条目,≥50分者结合精神访谈诊断为PTSD阳性;(4) 脑白质营养不良,在发病后第14天采用改良年龄相关白质改变(age-related white matter changes,ARWMC)量表评估白质营养不良的位置和严重程度,分为额叶、顶枕叶、颞叶、幕下区和基底节区共5个区域,每个区域分别计分(0~3分),最终得分为双侧大脑半球各区域得分总和。
以上各项相关量表评分由1名研究员在患者发病后60d内进行,复诊时向患者发放问卷,并对不清晰条目予以解释。
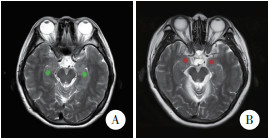
1.4 MRI图像和感兴趣区(region of interest,ROI)选取T2WI图像用于纹理特征提取,T1WI、T2-FLAIR和DWI图像用于ROI描绘、设置的解剖学参考。为减少层厚产生的部分容积效应,选择每例患者T2WI图像中显示海马和杏仁核的最大层面进行纹理特征提取。ROI勾画由2名高年资神经放射科医生手动放置在双侧海马、杏仁核区域,层面选取不一致时二人协商达成一致。采用MaZda软件(波兰罗兹工业大学) 进行ROI选取和纹理特征提取,对图像的灰度、强度归一(范围为灰度值平均值±3×灰度值标准差),以最小化各图像可能存在的混杂效应。每例患者中,ROI均为相同大小的椭圆形(19×22)、圆形(20×20),并确保其位于双侧海马、杏仁核区域内,以保证纹理特征提取的稳定性。见图 1。
|
| A, hippocampus; B, amygdala. 图 1 海马和杏仁核ROI选取示意图 Fig.1 ROI delineation in the hippocampus and amygdala |
1.5 二级影像组学特征的提取和模型的建立标题
使用MaZda软件Analysis模块提取纹理特征参数并保存、导出,采用LASSO回归选取优化纹理特征参数和构建影像组学特征模型。LASSO回归减少了惩罚项λ,将与诊断无关的纹理特征的系数设置为0,并保留具有非0系数的最佳纹理特征。采用10倍交叉验证在LASSO回归中选择最佳特征,二项偏差遵循最小化标准,以确定最佳惩罚项λ。确定λ后,通过多变量LASSO logistic回归分析生成影像组学特征模型(即由截距和最佳特征乘以各自的系数组成的线性方程)。将训练组中每例患者的最佳纹理特征值代入方程中,以获得相应分数进行分类。
1.6 影像组学模型验证通过受试者操作特征(receiver operating characteristic,ROC) 曲线评估影像组学模型的诊断效能,绘制影像组学评分ROC曲线并计算训练组的曲线下面积(area under curve,AUC)、灵敏度和特异度。为了评估影像组学模型的泛化性能,使用相同的图像选择和ROI描绘方法提取测试组患者海马和杏仁核T2WI图像的纹理特征参数。通过将最佳纹理特征值代入方程,使用影像组学特征计算测试组中每例患者的影像组学得分,绘制测试组影像组学评分ROC曲线,以显示模型的泛化性能,并计算相应的AUC、灵敏度和特异度。
1.7 统计学分析采用SPSS 21.0软件进行统计学分析。计量资料用x±s表示,采用成组t检验进行比较。计数资料用率表示,采用χ2检验进行比较。采用ROC曲线评估影像组学特征的诊断分类性能。采用Hosmer-Lemeshow检验评估影像组学模型的拟合优度。通过组间相关系数(intraclass correlation coefficient,ICC) 评估2名观察者纹理特征提取的一致性。P < 0.05为差异有统计学意义。
2 结果 2.1 患者的一般临床特征和量表评分训练组和测试组中,脑卒中后PTSD与非PTSD患者比较,年龄、性别、体质量指数、受教育程度、从事体力劳动、家庭月人均收入、医疗保险、家庭APGAR评分以及高血压、糖尿病、高血脂病史的差异均无统计学意义(均P > 0.05);脑卒中后PTSD与非PTSD患者比较,发病初期和发病后14d的NIHSS评分的差异均无统计学意义(均P > 0.05);脑卒中后PTSD患者再体验、回避、警觉性增高单项症状评分以及PCL-C总分均高于非PTSD患者,差异均有统计学意义(均P < 0.05)。见表 1。
| Item | Training group | Test group | |||||
| PTSD (n = 51) | Non-PTSD (n=51) | P | PTSD (n= 22) | Non-PTSD (n=22) | P | ||
| Age (year) | 51.18±4.65 | 50.21±5.70 | 0.353 | 49.77±5.05 | 52.36±4.03 | 0.067 | |
| Sex (male/female) | 30/21 | 33/18 | 0.541 | 12/10 | 11/11 | 0.763 | |
| BMI (kg/m2) | 25.91±3.62 | 25.67±4.05 | 0.750 | 26.68±3.95 | 25.82±3.53 | 0.451 | |
| Education length(year) | 7.75±2.43 | 8.04±2.31 | 0.532 | 7.23±2.67 | 7.73±1.93 | 0.435 | |
| Physical work [n(%)] | 41(80.39) | 43(84.31) | 0.603 | 18(81.82) | 16(72.73) | 0.472 | |
| Monthly per capita income (CNY) | 2 930.75±956.52 | 2 960.46±1 122.13 | 0.886 | 2 693.62±763.34 | 2 871.41±811.87 | 0.458 | |
| Health insurance [n (%)] | 30(58.82) | 32(62.75) | 0.554 | 12(54.55) | 14(63.64) | 0.419 | |
| Hypertension history [n (%)] | 36(70.59) | 32(62.75) | 0.401 | 14(63.64) | 12(54.55) | 0.540 | |
| Diabetes history [n (%)] | 25(49.02) | 27(52.94) | 0.692 | 13(59.09) | 11(50.00) | 0.545 | |
| Hyperlipidemia history [n (%)] | 29(56.86) | 31(60.78) | 0.687 | 13(59.09) | 8(36.36) | 0.131 | |
| Family APGAR score | 7.29±1.30 | 7.51±1.32 | 0.407 | 6.64±1.43 | 7.09±1.97 | 0.387 | |
| NIHSS score | |||||||
| At early onset | 4.43±1.01 | 4.20±0.98 | 0.234 | 4.23±0.87 | 4.36±0.90 | 0.612 | |
| At day 14 | 2.67±0.77 | 2.63±0.63 | 0.778 | 2.59±0.67 | 2.64±0.58 | 0.811 | |
| PCL-C score | |||||||
| Avoidance | 27.45±3.15 | 12.41±3.15 | < 0.001 | 25.27±3.88 | 11.77±3.66 | < 0.001 | |
| Intrusion | 18.02±3.38 | 10.12±2.68 | < 0.001 | 17.05±3.03 | 8.86±1.73 | < 0.001 | |
| Hyperarousal | 12.51±2.99 | 10.69±2.04 | 0.001 | 11.64±3.02 | 9.82±1.40 | 0.014 | |
| Total score | 57.98±5.98 | 33.21±4.79 | < 0.001 | 53.95±5.20 | 30.45±5.02 | < 0.001 | |
2.2 脑白质和梗死病变情况
训练组和测试组中,脑卒中后PTSD与非PTSD患者比较,额叶、顶枕叶、颞叶、幕下区和基底节区ARWMC量表各项评分的差异无统计学意义(P > 0.05),ARWMC量表总分的差异有统计学意义(P < 0.05),病变部位、标准梗死体积的差异无统计学意义(P > 0.05)。见表 2。
| Item | Training group | Test group | |||||
| PTSD (n= 51) | Non-PTSD (n= 51) | P | PTSD (n= 22) | Non-PTSD (n= 22) | P | ||
| ARWMC score | |||||||
| Frontal lobe | 1.47±0.90 | 1.29±0.83 | 0.504 | 1.55±0.80 | 1.36±0.85 | 0.469 | |
| Parietal occipital lobe | 1.53±0.92 | 1.35±0.87 | 0.323 | 1.41±0.91 | 1.32±0.78 | 0.724 | |
| Temporal lobe | 0.92±0.72 | 0.76±0.71 | 0.269 | 1.14±0.64 | 0.86±0.64 | 0.165 | |
| Infratentorial region | 0.90±0.76 | 0.81±0.69 | 0.496 | 1.18±0.73 | 0.82±0.73 | 0.107 | |
| Basal ganglion region | 1.31±0.65 | 1.20±0.76 | 0.408 | 1.41±0.50 | 1.09±0.75 | 0.106 | |
| Total score | 6.14±1.73 | 5.41±1.80 | 0.041 | 6.68±1.49 | 5.45±1.71 | 0.015 | |
| Lesion at left/right side | 28/23 | 25/26 | 0.552 | 12/10 | 8/14 | 0.226 | |
| Standardized infarct volume (mL) | 4.63±0.96 | 4.80±0.97 | 0.365 | 4.71±0.73 | 4.43±0.95 | 0.276 | |
2.3 基于T2WI序列降维后获得海马和杏仁核最佳纹理特征参数
观察者间提取纹理特征ICC范围为0.768~0.907,表明纹理特征提取具有良好的一致性。LASSO回归基于10倍交叉验证惩罚项λ的确定,随着惩罚项λ值增加,与诊断无关的特征系数被设置为0,使方程中非0系数的最优特征减少。确定二项式最小化标准偏差,在左侧垂直虚线处分别选取优化的λ为海马和杏仁核纹理特征筛选,海马λ值为0.053,ln (λ) = -2.947,杏仁核λ值为0.058,ln (λ) = -2.847。LASSO回归降维后,海马、杏仁核分别保留了9个、14个非0系数的最佳纹理特征(表 3),基于LASSO logistic回归分析建立鉴别脑卒中后PTSD和非PTSD的海马、杏仁核影像组学模型。
| Radiomics signature | Intercept | Optimal feature | Coefficient |
| Hippocampus | -1.291 1e+01 | Kurtosis | 6.323 5e-02 |
| S (2,0) SumOfSqs | 2.309 2e-02 | ||
| S (2,2) SumOfSqs | 3.322 7e-03 | ||
| S (3,-3) SumVarnc | 1.697 8e-03 | ||
| S (4,-4) Contrast | -2.938 6e-04 | ||
| S (5,0) SumOfSqs | -4.600 2e-04 | ||
| S (5,0) InvDfMom | -3.504 6e+00 | ||
| GrSkewness | 1.449 7e-01 | ||
| Teta3 | -1.024 0e-01 | ||
| Amygdala | -9.979 6e+00 | Variance | 1.947 1e-02 |
| Skewness | 3.907 1e-03 | ||
| S (1,-1) InvDfMom | 4.978 8e-01 | ||
| S (2,2) SumAverg | -4.883 6e-02 | ||
| S (3,0) SumOfSqs | -1.822 6e-02 | ||
| S (4,0) DifVarnc | -8.875 9e-03 | ||
| S (0,4) InvDfMom | 7.881 6e+00 | ||
| S (4,-4) InvDfMom | 6.671 9e-01 | ||
| S (0,5) InvDfMom | 6.653 0e+00 | ||
| S (5,5) Correlat | 8.317 2e-02 | ||
| S (5,5) SumEntrp | 1.997 7e+00 | ||
| S (5,-5) SumAverg | 1.700 8e-02 | ||
| GrNonZeros | 8.864 9e+00 | ||
| Teta3 | 1.520 1e+00 | ||
| SumOfSqs,sum of squares;SumVarnc,sum variance;InvDfMom,inverse difference moment;GrSkewness,gradient skewness;SumAverg,sum average;DifVarnc,difference variance;Correlat,correlation;SumEntrp,sum entropy;GrNonZeros,percentage of pixels with nonzero gradient. | |||
2.4 海马和杏仁核影像组学模型的诊断效能
采用ROC曲线评估基于T2WI图像海马、杏仁核影像组学模型诊断脑卒中后PTSD和非PTSD的效能(图 2)。海马影像组学模型在训练组中,AUC为0.892 0 (95%CI:0.833 2~0.950 7),灵敏度和特异度分别为82.35%和80.39%;在测试组中,AUC为0.702 5 (95%CI:0.536 6~0.868 3),灵敏度和特异度分别为68.18%和77.27%。杏仁核影像组学模型在训练组中,AUC为0.921 4 (95%CI:0.873 6~0.969 1),灵敏度和特异度分别为90.20%和72.55%;在测试组中,AUC为0.797 5 (95%CI:0.667 6~0.927 5),灵敏度和特异度分别为63.64%和86.37%。Hosmer-Lemeshow检验结果显示,海马和杏仁核影像组学模型在训练组和测试组中均具有较好的拟合优度(均P > 0.05)。

|
| A, hippocampus; B, amygdala. 图 2 海马和杏仁核T2WI影像组学模型对脑卒中后PTSD诊断的ROC曲线 Fig.2 ROC curve of the hippocampus and amygdala radiomics model based on T2WI for diagnosing post-stroke PTSD |
3 讨论
脑卒中是导致患者诸多功能障碍甚至危及生命的严重意外事件,脑卒中后PTSD对患者心理健康和生活质量产生严重负面影响,并与药物依从性、复发甚至死亡等风险密切相关[8]。因此,精准诊断和评估脑卒中后是否伴发PTSD对脑卒中患者获得良好预后至关重要。
既往通过相关问卷、量表或精神病学访谈诊断和评估PTSD。研究[9]报道,脑卒中后PTSD的估计患病率存在一定差异,可能由所用问卷、量表不同或临床经验不同的精神科医师进行精神病学访谈等所致。在神经影像学方面,磁共振波谱成像、弥散张量成像、静息态功能MRI及基于体素形态学测量等技术已用于PTSD的临床研究[10]中,但由于软件或硬件要求较高、序列复杂、准确性和可重复性等诸多局限性并未广泛用于临床诊断中。
常规MRI在一些神经退行性或精神类疾病中应用价值有限,如无法观察到阿尔茨海默病早期的主要病理特征,但神经纤维缠结、淀粉样肽累积等可导致图像像素分布或强度变化,进而在常规MRI图像上形成特定的纹理模式,可通过纹理分析进行捕捉并识别[11]。POLOPALLI等[12]建立双侧颈总动脉闭塞(bilateral common carotid artery occlusion,BCCAo) 联合单一连续刺激(single prolonged stress,SPS) 大鼠模型,结果显示SPS+BCCAo大鼠认知障碍和焦虑样行为加重,海马神经元数量明显减少。MRI纹理分析可以揭示和量化细胞水平出现的细微形态和结构变化,提供相关ROI组织的高通量潜在信息[11],这也是本研究采用影像组学方法对脑卒中后PTSD进行鉴别和分类的理论基础。目前,关于脑卒中后PTSD影像组学的相关研究尚未见报道,本研究率先尝试采用海马和杏仁核T2WI影像组学方法对脑卒中后PTSD进行预测。
海马、杏仁核是大脑边缘系统的重要组成,参与调节学习、认知、记忆(尤其是焦虑和恐惧记忆) 等,保存与情绪相关的信息,甚至形成长期记忆,海马和杏仁核的形态、结构及功能变化与PTSD的病理生理学密切相关[13]。本研究分别提取脑卒中患者海马、杏仁核T2WI图像纹理特征参数,采用LASSO回归降维筛选最佳纹理参数并建立影像组学模型。LASSO回归被广泛用作影像组学研究中的高维数据分析工具,其设计目的是避免过度拟合,可用相对较小的样本量分析大量纹理特征[14]。LASSO回归筛选出最具鉴别意义的纹理特征参数构建的海马T2WI图像影像组学模型,在训练组和验证组中AUC分别为0.892 0和0.702 5,灵敏度和特异度分别为82.35%和80.39%、68.18%和77.27%;杏仁核影像组学模型在训练组和验证组中AUC分别为0.921 4和0.797 5,灵敏度和特异度分别为90.20%和72.55%、63.64%和86.37%。上述结果表明,海马和杏仁核T2WI影像组学模型在脑卒中后PTSD与非PTSD中均具有较高的诊断效能,对二者预测和分类是可行的。
本研究的不足之处主要体现在以下几方面:一是脑卒中后PTSD的发生与多种因素相关[15],由于本研究样本含量有限且为单中心研究,部分临床特征在各组间未发现统计学差异,未来应进行大样本、多中心研究;二是本研究应用海马和杏仁核T2WI影像组学模型对脑卒中后PTSD与非PTSD进行了鉴别,采用多序列MRI联合多脑区、各临床因素及相关量表评分的列线图法可能进一步提高其预测效能。
综上所述,本研究结果初步显示基于T2WI图像的海马和杏仁核影像组学模型对脑卒中后PTSD具有较好的诊断性能,海马和杏仁核影像组学模型可作为临床诊断和评估脑卒中后PTSD的一种新的潜在影像学标志物。
| [1] |
GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820. DOI:10.1016/S1474-4422(21)00252-0 |
| [2] |
DOLLENBERG A, MOELLER S, LÜCKE C, et al. Prevalence and influencing factors of chronic post-traumatic stress disorder in patients with myocardial infarction, transient ischemic attack(TIA) and stroke-an exploratory, descriptive study[J]. BMC Psychiatry, 2021, 21(1): 295. DOI:10.1186/s12888-021-03303-1 |
| [3] |
乔雪. 脑卒中后运动功能障碍患者创伤后应激障碍水平及其影响因素的调查研究[J]. 解放军预防医学杂志, 2020, 38(1): 36-38. DOI:10.13704/j.cnki.jyyx.2020.01.013 |
| [4] |
GARTON AL, SISTI JA, GUPTA VP, et al. Poststroke post-traumatic stress disorder: a review[J]. Stroke, 2017, 48(2): 507-512. DOI:10.1161/STROKEAHA.116.015234 |
| [5] |
李学军, 章微微, 付金英, 等. 社会关系质量对中青年首发脑卒中患者早期创伤后应激障碍的影响[J]. 中华全科医学, 2017, 15(3): 483-486. DOI:10.16766/j.cnki.issn.1674-4152.2017.03.037 |
| [6] |
QIAO J, SUI R, ZHANG L, et al. Construction of a risk model associated with prognosis of post-stroke depression based on magnetic resonance spectroscopy[J]. Neuropsychiatr Dis Treat, 2020, 16: 1171-1180. DOI:10.2147/NDT.S245129 |
| [7] |
XIONG Y, YANG J, WONG A, et al. Operational definitions improve reliability of the age-related white matter changes scale[J]. Eur J Neurol, 2011, 18(5): 744-749. DOI:10.1111/j.1468-1331.2010.03272.x |
| [8] |
LIYANAGE-DON N, BIRK J, CORNELIUS T, et al. Medications as traumatic reminders in patients with stroke/transient ischemicattack-induced posttraumatic stress disorder[J]. Stroke, 2021, 52(1): 321-324. DOI:10.1161/STROKEAHA.120.031109 |
| [9] |
JORGE RE. Posttraumatic stress disorder[J]. Continuum(Minneap Minn), 2015, 21(3): 789-805. DOI:10.1212/01.con.0000466667.20403.b1 |
| [10] |
KUNIMATSU A, YASAKA K, AKAI H, et al. MRI findings in posttraumatic stress disorder[J]. J Magn Reson Imaging, 2020, 52(2): 380-396. DOI:10.1002/jmri.26929 |
| [11] |
ROHINI P, SUNDAR S, RAMAKRISHNAN S. Characterization of Alzheimer conditions in MR images using volumetric and sagittal brainstem texture features[J]. Comput Methods Programs Biomed, 2019, 173: 147-155. DOI:10.1016/j.cmpb.2019.03.003 |
| [12] |
POLOPALLI S, YETUKURI AR, DANDUGA RCSR, et al. A prognostic study on the effect of post-traumatic stress disorder on cerebral ischaemia reperfusion-induced stroke[J]. World J Biol Psychiatry, 2022, 23(2): 136-150. DOI:10.1080/15622975.2021.1935318 |
| [13] |
WEIS CN, WEBB EK, HUGGINS AA, et al. Stability of hippocampal subfield volumes after trauma and relationship to development of PTSD symptoms[J]. Neuroimage, 2021, 236: 118076. DOI:10.1016/j.neuroimage.2021.118076 |
| [14] |
HEPP T, SCHMID M, GEFELLER O, et al. Approaches to regularized regression-a comparison between gradient boosting and the lasso[J]. Methods Inf Med, 2016, 55(5): 422-430. DOI:10.3414/ME16-01-0033 |
| [15] |
PERKINS JD, WILKINS SS, KAMRAN S, et al. Post-traumatic stress disorder and its association with stroke and stroke risk factors: a literature review[J]. Neurobiol Stress, 2021, 14: 100332. DOI:10.1016/j.ynstr.2021.100332 |
 2022, Vol. 51
2022, Vol. 51