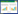文章信息
- 温晶, 常晓岑, 郭丹, 都健
- WEN Jing, CHANG Xiaocen, GUO Dan, DU Jian
- 增食欲素A诱导的自噬在人结肠癌细胞HT-29凋亡中的保护作用
- Protection of HT-29 human colon cancer cells from apoptosis by orexin A-induced autophagy
- 中国医科大学学报, 2022, 51(2): 140-144
- Journal of China Medical University, 2022, 51(2): 140-144
-
文章历史
- 收稿日期:2021-04-14
- 网络出版时间:2021-12-30 12:02
结肠癌是消化系统最常见的恶性肿瘤之一,其发病率及死亡率呈逐年上升且年轻化的趋势[1-2]。研究表明,增食欲素(Orexins) 在结肠癌等多种肿瘤的发生和发展过程中发挥着非常关键的作用。Orexins包括Orexin A和Orexin B,分别通过激活受体OX1R和OX2R发挥作用[3]。原发性结直肠癌、肝转移瘤及多种人结肠癌细胞系中均存在OX1R mRNA的表达。研究表明,Orexin A可影响肝癌[4]、前列腺癌[5]、胰腺癌[6]和结肠癌[7]等多种肿瘤细胞的代谢与活性,能诱导结肠癌细胞凋亡,还可与5-氟尿嘧啶协同促进结直肠癌细胞凋亡[7]。本研究组前期研究[8]发现,Orexin A能通过ERK信号通路诱导HCT-116结肠癌细胞的凋亡和自噬。
自噬,又称Ⅱ型程序性细胞死亡,参与调节多种细胞的内环境稳定[9]。自噬活性的变化与肿瘤的发生和发展相关[10],但其在抗肿瘤治疗中的作用及机制目前仍存在争议。研究[11-13]表明,某些已知能够激活细胞凋亡的抗肿瘤药物也可引起细胞自噬,自噬抑制剂可增强这些药物的抗肿瘤活性。此时,自噬作为保护剂,可防止细胞发生细胞凋亡。相反,自噬也可通过诱导自噬性细胞死亡杀死细胞[14]。本研究组已对Orexin A诱导肿瘤细胞的增殖和凋亡进行了相关报道[6, 15],但目前Orexin A诱导人结肠癌HT-29细胞自噬及其与凋亡的关系未见报道。本研究拟探讨Orexin A同时对HT-29人结肠癌细胞凋亡和自噬的诱导作用,并进一步探讨其相互关系和作用机制。
1 材料与方法 1.1 材料Orexin A、二甲基亚枫、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT) 试剂盒(美国Sigma公司);氯喹(chloroquine,CQ)、anti-Beclin-1 (美国Sigma-Aldrich公司);RPMI1640培养基(美国Gibco公司);胎牛血清(杭州四季青公司);AnnexinV-FITC/PI细胞凋亡双染试剂盒(上海翊圣生物科技有限公司);β-actin多克隆抗体、辣根酶标记山羊抗兔IgG (美国Santa Cruz公司);anti-LC3、anti-caspase 3 (美国Cell Signaling Technology公司);SB334867 (美国Tocris公司)。
1.2 方法 1.2.1 细胞培养HT-29人结肠癌细胞获自中国科学院细胞库(中国上海),用含10%胎牛血清、L-谷氨酰胺(2 mmol/L) 及青霉素(50 μg/mL) 和链霉素(100 μg/mL) 的RPMI1640培养基,在37 ℃、5%CO2的潮湿环境中培养。每2~3 d对细胞进行传代培养,以维持其处于对数生长期。
1.2.2 细胞活力测定将HT-29细胞(2×103/孔) 接种于96孔板,培养24 h。为了使细胞周期同步,将细胞血清剥夺24 h,并用不同浓度Orexin A (0,1×10-9,1×10-8,1×10-7 mol/L) 处理细胞24 h。加入MTT溶液(0.5 mg /mL),继续培养4 h。除去培养基,加入二甲基亚砜(100 μL/孔),置于摇床上低速震荡10 min,使结晶物充分溶解。在酶联免疫检测仪570 nm和650 nm处测量各孔的吸光度值。
1.2.3 细胞凋亡检测用AnnexinV/PI凋亡检测试剂盒定量凋亡细胞,通过BD Accuri TM C6流式细胞仪(美国BD Pharmingen公司) 评估细胞凋亡情况。在不含血清的培养基中用不同浓度的Orexin A (0,1×10-9,1×10-8,1×10-7 mol/L) 处理细胞24 h。或将细胞分组给药处理24 h,即对照组,Orexin A (1×10-7 mol/L) 组,CQ (20 μmol/L) 组,Orexin A (1×10-7 mol/L) +CQ (20 μmol/L) 组。将细胞(1×105) 用PBS洗涤2次,用AnnexinV-FITC (5 μL) 和PI (10 μL) 在室温下避光染色15 min。通过荧光激活细胞分析计数通过FITC标记的AnnexinV染色的细胞数,以确定凋亡率。
1.2.4 透射电子显微镜观察细胞内自噬体细胞分为对照组和Orexin A (1×10-7 mol/L) 组。分别处理24 h后,胰蛋白酶消化和收集细胞,2.5%磷酸盐缓冲的戊二醛固定,1%磷酸盐缓冲的四氧化锇后固定,包埋,切片,乙酸双氧铀和柠檬酸铅双染。用JEM-1200EX透射电子显微镜观察并拍照。
1.2.5 Western blotting检测蛋白表达药物处理后收集HT-29细胞,1 000 g离心10 min,PBS冲洗2次,加入细胞裂解液(10 mmol/L TrisHCl pH7.4,10 mmol/L edeticacid pH8.0,0.5% TritonX-100),冰浴中裂解30 min。4 ℃、12 000 g离心10 min,收集上清液,Bradford法测每组蛋白浓度,制备蛋白样品。上样行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭,一抗封闭过夜,再以辣根过氧化物酶标记的二抗封闭液封闭1.5 h,DAB显色,扫描记录。
1.3 统计学分析采用SPSS 16.0软件进行统计处理。计量资料用x±s表示,组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 Orexin A抑制HT-29细胞活力并诱导细胞凋亡应用不同浓度Orexin A (0,1×10-9,1×10-8,1×10-7 mol/L) 处理HT-29细胞,MTT检测结果显示,Orexin A以剂量依赖的方式抑制HT-29细胞生长。与对照组比较,1×10-8和1×10-7 mol/L浓度的Orexin A能够诱导HT-29细胞活力显著降低(P < 0.05)。流式细胞仪测定结果显示,Orexin A处理细胞24 h后,细胞凋亡显著增加。与对照组比较,Orexin A (1×10-7 mol/L) 能够诱导细胞凋亡率增加1.5倍(P < 0.05),见表 1。
| Item | Orexin A concentration (mol·L-1) | |||
| 0 | 1×10-9 | 1×10-8 | 1×10-7 | |
| Proliferation | 99.67±0.195 | 86.43±9.615 | 77.79±9.170 | 65.13±11.500 |
| P | – | 0.076 | 0.055 | 0.017 |
| Viability | 99.30±0.218 | 83.37±9.170 | 69.44±5.395 | 53.17±9.238 |
| P | – | 0.060 | 0.017 | 0.021 |
| Apotosis | 4.03±0.143 | 4.36±0.210 | 5.19±0.890 | 7.52±1.380 |
| P | – | 0.088 | 0.089 | 0.012 |
2.2 HT-29细胞中自噬泡形成
应用透射电子显微镜观察细胞的超微结构,与对照组比较,Orexin A (1×10-7 mol/L) 处理后的HT-29细胞中可见许多微小液泡,即自噬泡。见图 1。
|
| A, control group; B, Orexin A (1×10-7 mol/L) group. Arrows, autophagic vacuoles; Nu, nucleus. 图 1 Orexin A诱导HT-29细胞中自噬泡形成 Fig.1 Orexin A induced formation of autophagic vacuoles in HT-29 cells |
2.3 Orexin A诱导LC3-Ⅱ积累并上调Beclin-1的表达
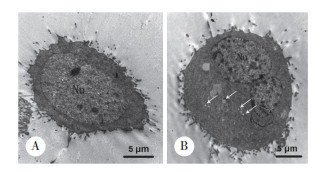
LC3-Ⅱ与自噬体膜密切相关,被用作监测自噬的可靠标志物。Western blotting结果显示,Orexin A以时间和剂量依赖的方式上调了LC3-Ⅱ和自噬关键蛋白Beclin-1的表达,见图 2。
|
| A, the expression of LC3;B, the expression of Beclin-1. 图 2 Orexin A对HT-29细胞中LC3和Beclin-1蛋白表达的影响 Fig.2 Effects of Orexin A on LC3 and Beclin-1 levels in HT-29 cells |
2.4 抑制自噬可促进Orexin A诱导的HT-29细胞凋亡
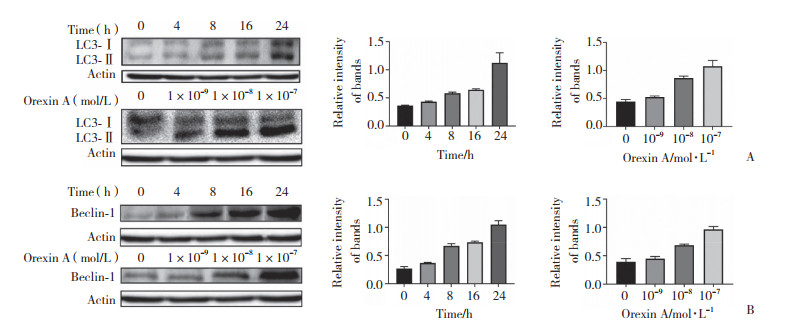
应用CQ和Orexin A单独或联合处理细胞,结果表明,CQ增强了Orexin A诱导的HT-29细胞生长抑制和细胞凋亡,见图 3A、3B。为了进一步证实结果,用Western blotting检测了caspase-3的裂解情况,结果显示,Orexin A裂解前caspase-3至其活性形式,见图 3C。
|
| A, the cell viability was measured by MTT assay; B, the cell apoptotic ratios were assessed by flow cytometry; C, the cleavage of caspase-3 was detected by western blotting. *P < 0.05. CQ, chloroquine. 图 3 氯喹诱导的自噬抑制对Orexin A诱导的HT-29细胞凋亡的影响 Fig.3 Chloroquine-induced inhibition of autophagy enhanced orexin A-induced apoptosis in HT-29 cells |
3 讨论
随着新辅助化疗的开展,结肠癌的5年生存率得到了一定程度的提高[16]。研发低毒性抗肿瘤药物已成为肿瘤研究领域的热点。研究[17-18]表明,Orexin A参与调节多种肿瘤细胞的病理过程,但其对人结肠癌细胞凋亡和自噬的作用及二者之间的关系尚不明确。
自噬最主要的细胞学特征是细胞内出现具有双层膜结构的细胞质囊泡[19]。本研究发现,Orexin A处理HT-29细胞24 h后,细胞质内出现封闭的双层膜囊泡,即自噬体。Western blotting结果也显示,Orexin A处理后,LC3-Ⅰ向LC3-Ⅱ转化,且LC3表达水平以剂量和时间依赖的方式增加。LC3的这些特异性变化已被公认为哺乳动物发生自噬的标志[20]。表明Orexin A诱导的HT-29细胞死亡中,有细胞发生了自噬性活化。Beclin-1是酵母自噬基因Atg6/Vps30的同源基因,也是介导哺乳动物自噬发生的特异性基因[21]。在本研究中,Orexin A以剂量依赖的方式增加了HT-29细胞中Beclin-1的表达,表明Beclin-1参与了Orexin A诱导的自噬。
自噬在哺乳动物的感染、肿瘤及神经退行性疾病等多种病理过程中发挥重要作用[22]。研究[11]表明,自噬参与了抗肿瘤药物对肿瘤细胞的杀伤机制。自噬能够通过抑制抗肿瘤药物诱导的细胞凋亡来保护部分肿瘤细胞;同时,部分肿瘤细胞也可因发生自噬性活化而死亡[23]。抗肿瘤治疗中自噬与凋亡的关系及其具体机制尚不明确。本研究发现,Orexin A处理HT-29结肠癌细胞后,能诱导其发生自噬性活化和凋亡。自噬抑制剂CQ诱导细胞凋亡率增加,细胞活力减低。推测Orexin A作用于HT-29结肠癌细胞后,自噬作为一种防御机制被诱导发生,用于清除Orexin A杀伤的细胞器及产生的有害物质,延缓凋亡的发生,从而发挥保护作用。因此,精细调控自噬将在结肠癌治疗方面具有广阔的前景。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
王宁, 刘硕, 杨雷, 等. 2018全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2019(1): 87-97. DOI:10.12151/JMCM.2019.01-10 |
| [3] |
SAKURAI T, AMEMIYA A, ISHII M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4): 573-585. DOI:10.1016/s0092-8674(00)80949-6 |
| [4] |
WAN X, LIU Y, ZHAO Y, et al. Orexin A affects HepG2 human hepatocellular carcinoma cells glucose metabolism via HIF-1α-dependent and -independent mechanism[J]. PLoS One, 2017, 12(9): e0184213. DOI:10.1371/journal.pone.0184213 |
| [5] |
VALIANTE S, LIGUORI G, TAFURI S, et al. Expression and potential role of the peptide orexin-A in prostate cancer[J]. Biochem Biophys Res Commun, 2015, 464(4): 1290-1296. DOI:10.1016/j.bbrc.2015.07.124 |
| [6] |
SUO L, CHANG X, ZHAO Y. The orexin-A-regulated Akt/mTOR pathway promotes cell proliferation through inhibiting apoptosis in pancreatic cancer cells[J]. Front Endocrinol (Lausanne), 2018, 9: 647. DOI:10.3389/fendo.2018.00647 |
| [7] |
VOISIN T, EL FIRAR A, FASSEU M, et al. Aberrant expression of OX1 receptors for orexins in colon cancers and liver metastases: an openable gate to apoptosis[J]. Cancer Res, 2011, 71(9): 3341-3351. DOI:10.1158/0008-5472.can-10-3473 |
| [8] |
WEN J, ZHAO Y, GUO L. Orexin A induces autophagy in HCT-116 human colon cancer cells through the ERK signaling pathway[J]. Int J Mol Med, 2016, 37(1): 126-132. DOI:10.3892/ijmm.2015.2409 |
| [9] |
DENNY P, FEUERMANN M, HILL DP, et al. Exploring autophagy with gene ontology[J]. Autophagy, 2018, 14(3): 419-436. DOI:10.1080/15548627.2017.1415189 |
| [10] |
SUARES A, MEDINA MV, COSO O. Autophagy in viral development and progression of cancer[J]. Front Oncol, 2021, 11: 603224. DOI:10.3389/fonc.2021.603224 |
| [11] |
ZHONG YY, LE FY, CHENG J, et al. Triptolide inhibits JAK2/STAT3 signaling and induces lethal autophagy through ROS generation in cisplatin-resistant SKOV3/DDP ovarian cancer cells[J]. Oncol Rep, 2021, 45(5): 69. DOI:10.3892/or.2021.8020 |
| [12] |
LIU Y, GONG W, YANG ZY, et al. Quercetin induces protective autophagy and apoptosis through ER stress via the p-STAT3/Bcl-2 axis in ovarian cancer[J]. Apoptosis, 2017, 22(4): 544-557. DOI:10.1007/s10495-016-1334-2 |
| [13] |
DATTA S, CHOUDHURY D, DAS A, et al. Autophagy inhibition with chloroquine reverts paclitaxel resistance and attenuates metastatic potential in human nonsmall lung adenocarcinoma A549 cells via ROS mediated modulation of β-catenin pathway[J]. Apoptosis, 2019, 24(5/6): 414-433. DOI:10.1007/s10495-019-01526-y |
| [14] |
LE XF, MAO W, LU Z, et al. Dasatinib induces autophagic cell death in human ovarian cancer[J]. Cancer, 2010, 116(21): 4980-4990. DOI:10.1002/cncr.25426 |
| [15] |
CHANG XC, ZHAO YY, JU SJ, et al. Orexin-A regulates cell apoptosis in human H295R adrenocortical cells via orexin receptor type 1 through the AKT signaling pathway[J]. Mol Med Rep, 2015, 12(5): 7582-7588. DOI:10.3892/mmr.2015.4381 |
| [16] |
吕国利, 白松, 李杨. 新辅助化疗对大肠癌患者临床特征的影响[J]. 中国老年保健医学, 2017, 15(6): 45-50. DOI:10.3969/j.issn.1672-4860.2017.06.018 |
| [17] |
DAYOT S, SPEISKY D, COUVELARD A, et al. In vitro, in vivo and ex vivo demonstration of the antitumoral role of hypocretin-1/orexin-A and almorexant in pancreatic ductal adenocarcinoma[J]. Oncotarget, 2018, 9(6): 6952-6967. DOI:10.18632/oncotarget.24084 |
| [18] |
GRAYBILL NL, WEISSIG V. A review of orexin's unprecedented potential as a novel, highly-specific treatment for various localized and metastatic cancers[J]. SAGE Open Med, 2017, 5: 2050312117735774. DOI:10.1177/2050312117735774 |
| [19] |
ICHIMIYA T, YAMAKAWA T, HIRANO T, et al. Autophagy and autophagy-related diseases: a review[J]. Int J Mol Sci, 2020, 21(23): 8974. DOI:10.3390/ijms21238974 |
| [20] |
BANSAL M, MOHARIR SC, SWARUP G. Autophagy receptor optineurin promotes autophagosome formation by potentiating LC3-Ⅱproduction and phagophore maturation[J]. Commun Integr Biol, 2018, 11(2): 1-4. DOI:10.1080/19420889.2018.1467189 |
| [21] |
KAUR S, CHANGOTRA H. The beclin 1 interactome: modification and roles in the pathology of autophagy-related disorders[J]. Biochimie, 2020, 175: 34-49. DOI:10.1016/j.biochi.2020.04.025 |
| [22] |
THORBURN A. Autophagy and disease[J]. J Biol Chem, 2018, 293(15): 5425-5430. DOI:10.1074/jbc.R117.810739 |
| [23] |
ZHANG B, LIU LT. Autophagy is a double-edged sword in the therapy of colorectal cancer[J]. Oncol Lett, 2021, 21(5): 378. DOI:10.3892/ol.2021.12639 |
 2022, Vol. 51
2022, Vol. 51