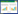文章信息
- 吴思, 路一平, 王馨艺, 孙峥嵘
- WU Si, LU Yiping, WANG Xinyi, SUN Zhengrong
- 原代正常宫颈及宫颈癌细胞的培养方法
- Culturing method of primary cells from normal cervical tissue and cervical cancer tissue
- 中国医科大学学报, 2022, 51(11): 965-969
- Journal of China Medical University, 2022, 51(11): 965-969
-
文章历史
- 收稿日期:2022-05-01
- 网络出版时间:2022-11-04 13:58
宫颈癌在全球所有癌症中发病率排名第14位,在女性癌症中排名第4位[1-2]。已知宫颈癌发病机制主要是以破坏正常细胞为前提,而原代培养细胞由于离体时间短,遗传性状更接近体内细胞的原始状态,适合用于观察细胞形态、分化及功能学等研究[3],建立正常宫颈上皮原代细胞有利于更好地了解人乳头瘤病毒(human papillomavirus,HPV)感染宫颈上皮细胞所导致的病理学改变。而宫颈癌细胞的原代培养则可以更加真实地反映人体细胞在癌症发生后的功能学改变,因此宫颈上皮原代细胞的培养至关重要。
上皮细胞培养的难点在于细胞分离后具有增殖能力的底层细胞数量较少,在后期的培养过程中很容易被成纤维细胞污染[4]。此前已经有许多关于宫颈上皮细胞分离方法的尝试,包括中性蛋白酶联合法、Ⅰ型胶原酶法等进行组织消化分离[5]。也有研究[6]表明,采用无血清培养基K-SFM进行原代培养,不但可以有效防止成纤维细胞的过快生长,还能够促进上皮细胞的生长。尽管宫颈上皮细胞的原代培养方法有很多,但国内外尚无统一的宫颈原代培养方案,严重阻碍了以原代宫颈细胞为模型的相关宫颈疾病的研究。本文就正常宫颈和宫颈癌如何简便准确地分离原代细胞进行了探讨,并成功建立了新的分离方法。
1 材料与方法 1.1 组织来源选取2019年5月至2019年12月于中国医科大学附属盛京医院因子宫肌瘤行全子宫切除术的4例患者的正常宫颈组织进行原代正常宫颈细胞培养,年龄40~50岁;另选取因宫颈活检提示为宫颈鳞状细胞癌行全子宫切除术的4例患者的宫颈癌组织进行原代宫颈癌细胞培养,年龄35~55岁。本研究获得中国医科大学附属盛京医院伦理委员会批准。
1.2 主要试剂与仪器K-SFM培养基(美国Gibco公司),Dispase Ⅱ型(美国Sigma公司),胶原酶Ⅰ型(美国Sigma公司),0.25%胰酶-EDTA(中国solarbio公司),D-PBS(中国solarbio公司),DMEM/F12培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),鼠尾胶原Ⅰ型(中国Solarbio公司),P40(1∶100,英国Abcam公司),Ki-67(1∶100,英国Abcam公司),P16(1∶100,英国Abcam公司),CD326(1∶200,美国CST公司),Dylight488(1∶200,中国Abbinke公司),Dylight594(1∶200,中国Abbinke公司)二抗(1∶200),CO2培养箱(美国Thermo Scientific公司),荧光显微镜(日本Nikon公司)。
1.3 细胞培养 1.3.1 正常宫颈上皮原代细胞的分离及培养取正常宫颈组织标本,置于无菌离心管中,加入DMEM培养液,30 min内转运至实验室;D-PBS清洗5遍,用预冷后的3 mL DispaseⅡ+7 mL DMEM的消化液,消化20 h;取出消化好的组织,室温放置1 h,放入新的培养皿中,用眼科镊将鳞状上皮与下面的组织分离开,D-PBS清洗;将分离出来的鳞状上皮组织剪碎,胰酶消化10 min;立即用等量的含有血清的培养基终止消化,反复吹打混匀成单细胞悬液;用200目的细胞筛过滤细胞悬液,1 500 r/min离心5 min,弃去上清,加入5%FBS的KFSM培养基重悬;将单细胞悬液加入用鼠尾胶原包被好的培养皿中,培养48 h后首次换液,继续培养至细胞汇合70%~80%;14 d后进行首次传代。
1.3.2 宫颈鳞状细胞癌原代细胞的分离及培养取宫颈鳞状细胞癌组织标本,置于无菌离心管中,加入DMEM培养液,30 min内转运至实验室;眼科剪剔除坏死组织及血渍,D-PBS清洗5遍;眼科剪将组织剪碎,加入3 mL的胰酶37 ℃、5%二氧化碳孵箱静置消化30 min,组织消化为黏糊状;将消化好的组织移至15 mL离心管中,1 500 r/min离心3 min,弃上清,加入胶原酶Ⅰ型5 mL,放置37 ℃、5%CO2培养箱中振荡消化30~60 min,至组织完全溶解;用含10%FBS血清的DMEM/F12等体积中和,200目滤网过滤,过滤后的细胞悬液1 000 r/min离心5 min,弃去上清,加入5%FBS的KFSM培养基重悬;将单细胞悬液加入用鼠尾胶原包被好的培养皿中,培养48 h后首次换液,继续培养至细胞汇合70%~80%;14 d后进行首次传代。
1.4 细胞鉴定采用免疫细胞荧光染色法进行细胞鉴定。将密度为4×105/mL的细胞接种到包被含爬片的12孔板中,每个板接种8个孔,每个孔加入1 mL的细胞悬液。2孔行Ki-67+P16双染,2孔行P40,2孔行CD326,1孔作为阴性对照(PBS代替一抗),1孔备用,放入培养箱中进行培养。当细胞达到70%~80%汇合,PBS洗涤2次后将细胞用4%多聚甲醛固定30 min,吸去固定液,PBS洗涤3次,每次5 min;加入0.3%Triton-100穿孔15 min,吸去Triton-100,PBS洗涤3次,每次5 min;加入封闭液,封闭1 h,吸去封闭液,每孔加入150 μL一抗,4 ℃过夜;吸去一抗,PBS洗涤3次,每次5 min;每孔加入150 μL的相应抗鼠或抗兔二抗,避光孵育1 h;吸去多余的二抗,PBS洗涤3次,每次5 min;取出爬片,用含DAPI的封片剂将爬片封闭到玻片上,镜下观察细胞染色情况。
2 结果 2.1 宫颈正常上皮细胞原代、传代培养形态学观察正常宫颈原代培养2 d后首次贴壁,细胞贴壁伸展,呈多角形,成团聚集生长,胞核明显,周围有少量成纤维细胞围绕上皮细胞,呈纺锤形或梭形(图 1A),细胞从培养的第7天开始生长速度明显增快(图 1B),培养至第14天时细胞融合可达70%~80%,细胞之间排列紧密,胞核明显,呈典型的宫颈上皮细胞,胞质大胞核小(图 1C),传代细胞接种24 h即可贴壁,可传4~5代,细胞形态呈多角或圆形,胞质丰富,胞核清晰,可见明显核仁,增殖速度较快(图 1D)。
|
| A, cellular morphology after the first replacement of the cell culture medium of primary normal cervical squamous cells; B, cellular morphology at the seventh day; C, cellular morphology at the fourteenth day; D, cellular morphology after the first passage culture. 图 1 正常宫颈上皮细胞形态×200 Fig.1 Cellular morphology of primary cells from normal cervical squamous cells ×200 |
2.2 宫颈正常上皮细胞鉴定
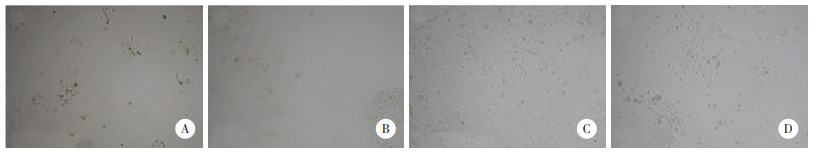
对传代的宫颈上皮细胞进行免疫荧光染色(图 2),CD326、P40、P16胞质呈红色荧光,Ki-67胞核呈绿色荧光:CD326,P40表达强阳性,代表此细胞为鳞状上皮细胞;P16表达弱阳性,Ki-67仅几个细胞表达,证明此细胞增殖活性差,为正常鳞状上皮细胞。
|
| A, CD326, P40, and Ki-67+P16 immunofluorescence staining for primary normal cervical squamous cells ×100;B, CD326, P40, and Ki-67+P16 immunofluorescence staining for primary normal cervical squamous cells ×400. 图 2 正常宫颈上皮细胞荧光鉴定 Fig.2 Identification of primary normal cervical squamous cells by immunofluorescence |
2.3 宫颈鳞状细胞癌细胞原代、传代培养形态学观察
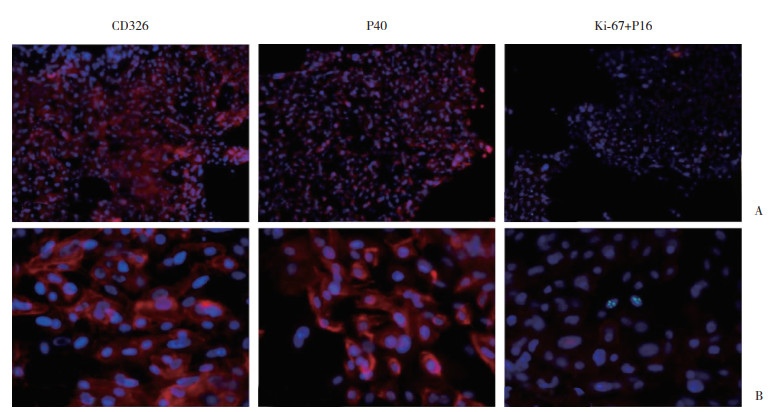
原代宫颈鳞状细胞癌细胞培养2 d后首次贴壁,细胞贴壁伸展,呈多角形或圆形,成团聚集生长,周围有大量成纤维细胞围绕上皮细胞呈旋涡状或放射状排列,呈纺锤形或梭形(图 3A),由于成纤维在胰酶消化时可较快脱壁,所以在培养第5天时,采用胰酶消化1 min后进行吹打,发现成纤维细胞明显减少,且上皮细胞只有少量损失,消化后上皮细胞生长速度明显加快。细胞从培养的第7天开始生长速度明显增快(图 3B),培养至第14天细胞融合可达70%~80%,细胞之间排列紧密,胞核明显,呈典型的铺路石样形态(图 3C),传代细胞接种24 h贴壁,可传5~6代,细胞形态呈多角或圆形,胞质丰富,胞核清晰,可见明显核仁,增殖速度较快(图 3D)。
|
| A,cellular morphology after the first replacement of the cell culture medium for primary cells from the cervical squamous cell carcinoma tissues;B,cellular morphology at the seventh day;C,cellular morphology at the fourteenth day;D,c ellular morphology after the first passage culture. 图 3 宫颈癌细胞形态×200 Fig.3 Cellular morphology of primary cells from cervical squamous cell carcinoma tissues × 200 |
2.4 宫颈鳞状细胞癌细胞鉴定
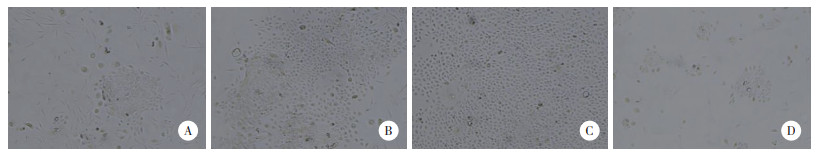
传代的宫颈鳞状细胞癌细胞的免疫荧光染色(图 4),CD326、P40、P16胞质呈红色荧光,Ki-67胞核呈绿色荧光:CD326,P40表达强阳性,代表此细胞为鳞状上皮细胞;P16表达阳性,Ki-67广泛表达于细胞核中,证明此细胞增殖活性强,为宫颈鳞状细胞癌细胞。
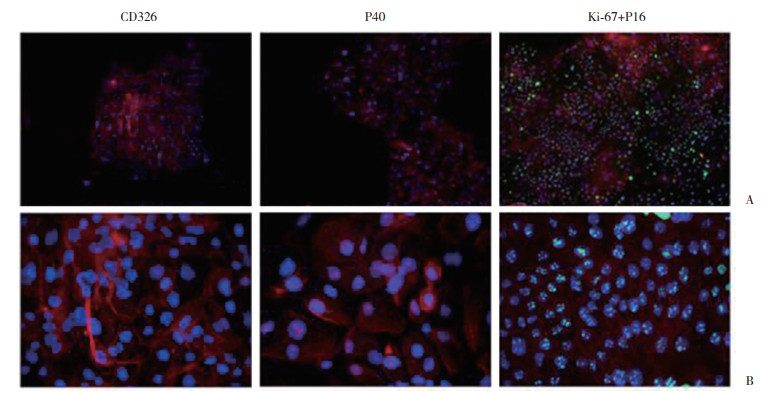
|
| A, CD326, P40, and Ki-67+P16 immunofluorescence staining of primary cells from cervical squamous cell carcinoma tissues×100;B, CD326, P40, and Ki-67+P16 immunofluorescence staining for primary cells from cervical squamous cell carcinoma tissues ×400. 图 4 宫颈癌细胞荧光鉴定 Fig.4 Identification of primary cells from the cervical squamous cell carcinoma tissues by immunofluorescence |
3 讨论
本研究结果显示,原代上皮细胞可以在含有低浓度FBS的K-SFM中培养,而无需成纤维细胞饲养层。既往研究[3]证实,成纤维细胞在正常浓度的FBS培养中迅速生长,上皮细胞在后续的培养中极易被成纤维细胞污染。因此,在细胞培养中选择了低浓度FBS的K-SFM培养基进行宫颈上皮细胞的纯化,得到了高度纯化的宫颈上皮细胞培养物。
有研究[4]运用Ⅰ型胶原酶成功分离出正常宫颈上皮细胞。但在本研究中发现Ⅰ型胶原酶对宫颈鳞状细胞癌细胞的分离效果较好,细胞获得量尚可,但对正常宫颈上皮细胞分离效果较差,因此本研究按照文献[4]中的方法将剪碎的正常组织置于Ⅰ型胶原酶溶液中,37 ℃恒温振荡器中以200 r/min消化40 min,组织消化明显不够充分,细胞筛过滤细胞溶液,并将单细胞悬液置于事先包被Ⅰ型鼠尾胶原蛋白的培养瓶中进行培养,发现获得的细胞以成纤维细胞为主,这一结果在李雅等[5]的研究中也得到验证。研究[7-8]发现中性蛋白酶作用于细胞间桥,可将上皮组织与结缔组织完全分开,而不破坏基底层细胞,故针对正常宫颈上皮细胞本研究采用中性蛋白酶联合胰酶-EDTA法进行细胞分离,结果显示联合法分离的正常宫颈细胞成功率高、细胞纯度高、细胞贴壁好。对分离培养细胞进行1∶2传代,正常宫颈上皮细胞可传代4~5次,而宫颈癌细胞则可传代5~6次。在细胞生长过程中,可利用形态最好、增殖速度最快的三、四代细胞进行细胞形态学及功能学研究。
通过CD326和P40进行细胞免疫荧光鉴定,证明了原代培养细胞首次传代后的细胞均为上皮细胞。已知P16是一种细胞周期依赖激酶抑制因子,Ki-67是一种核增殖基因。在正常条件下,2种分子不会共表达,当P16和Ki-67出现共表达时提示细胞周期失调,可以预测宫颈病变的存在[9]。本研究选取P16和Ki-67进行荧光双染细胞鉴定,结果表明正常宫颈上皮细胞P16表达很弱,Ki-67只有少数细胞表达,而宫颈鳞状细胞癌细胞P16和Ki-67均表达强阳性,进而证明了细胞分离的可靠性与真实性。
综上所述,本研究展示了一种改良的上皮细胞培养方法,可以通过不同的消化方法增强不同级别宫颈上皮细胞的获得率,改变培养基血清含量进而净化原代培养中的上皮细胞。这种培养技术简单、实用、可靠;并且可以产生高度纯化的宫颈上皮细胞,此方法的建立也为宫颈病变的研究提供了理论及实验基础。
| [1] |
BRISSON M, DROLET M. Global elimination of cervical cancer as a public health problem[J]. Lancet Oncol, 2019, 20(3): 319-321. DOI:10.1016/S1470-2045(19)30072-5 |
| [2] |
GONTHIER C, DESPORTES C, PRETET J L, et al. HPV testing in the screening and follow-up of patients with cervical high-grade squamous intraepithelial lesions[J]. Gynecol Obstet Fertil Senol, 2019, 47(10): 747-752. DOI:10.1016/j.gofs.2019.09.004 |
| [3] |
ASSELINEAU D, PRUNIERAS M. Reconstruction of 'simplified' skin: control of fabrication[J]. Br J Dermatol, 1984, 111(Suppl 27): 219-222. DOI:10.1111/j.1365-2133.1984.tb15608.x |
| [4] |
LIU YZ, LÜ XP, PAN ZX, et al. Establishment of a novel method for primary culture of normal human cervical keratinocytes[J]. Chin Med J (Engl), 2013, 126(17): 3344-3347. |
| [5] |
李雅, 荣守华, 智艳芳, 等. 正常宫颈上皮细胞原代培养体系的改良[J]. 郑州大学学报(医学版), 2017, 52(3): 370-375. DOI:10.13705/j.issn.1671-6825.2017.03.032 |
| [6] |
WANG HK, BROKER TR, CHOW LT. Robust HPV-18 production in organotypic cultures of primary human keratinocytes[J]. Methods Mol Biol, 2015, 1249: 93-109. DOI:10.1007/978-1-4939-2013-6_7 |
| [7] |
FAN TT, LI XF, LI Y, et al. An improved method for primary culture of normal cervical epithelial cells and establishment of cell model in vitro with HPV-16 E6 gene by lentivirus[J]. J Cell Physiol, 2018, 233(4): 2773-2780. DOI:10.1002/jcp.25978 |
| [8] |
马丽萍, 刘小林. CDC50A在宫颈癌原代细胞中的表达及对干细胞特性的影响[J]. 吉林医学, 2021, 42(6): 1289-1293. DOI:10.3969/j.issn.1004-0412.2021.06.002 |
| [9] |
YU L, FEI LY, LIU XB, et al. Application of p16/Ki-67 dual-staining cytology in cervical cancers[J]. J Cancer, 2019, 10(12): 2654-2660. DOI:10.7150/jca.32743 |
 2022, Vol. 51
2022, Vol. 51