文章信息
- 丛明, 单伟, 石玉秀
- CONG Ming, SHAN Wei, SHI Yuxiu
- CDK4-pRB-E2F1通路在创伤后应激障碍大鼠杏仁核神经细胞凋亡中的作用
- Role of the CDK4-pRB-E2F1 pathway in apoptosis of amygdala neurons in rats with post-traumatic stress disorder
- 中国医科大学学报, 2021, 50(7): 608-611
- Journal of China Medical University, 2021, 50(7): 608-611
-
文章历史
- 收稿日期:2020-11-21
- 网络出版时间:2021-06-22 16:31
2. 锦州医科大学基础医学院人体解剖学教研室, 辽宁 锦州 121001;
3. 中国医科大学基础医学院组织胚胎学教研室, 沈阳 110122
2. Department of Anatomy, College of Basic Medical Sciences, Jinzhou Medical University, Jinzhou 121000, China;
3. Department of Histology and Embryology, College of Basic Medical Sciences, China Medical University, Shenyang 110122, China
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指人遭受突发的巨大灾难或严重威胁而出现并长期存在的精神障碍[1]。研究[2]显示,PTSD患者大脑杏仁核组织出现体积缩小、细胞死亡等病理改变。本课题组前期研究[3-4]证实了PTSD造模大鼠杏仁核及海马组织中神经细胞均发生了凋亡;结果显示,PTSD大鼠杏仁核神经细胞中细胞周期因子CDK4和CyclinD1表达增高,而且这种表达增高时间与细胞凋亡时间接近,说明PTSD可能引起细胞周期的异常重启,从而造成了神经细胞的凋亡。WANG等[5]在中枢神经系统损伤引起细胞凋亡的研究中发现细胞周期因子pRB和E2F1存在异常高表达,这种高表达是损伤刺激激活了CDK4/Cyclin D1-pRB-E2F信号通路引起的;而pRB[6-7]和E2F1[8-9]高表达诱导受损的成熟神经细胞最终走向凋亡。
本研究采用Wistar大鼠建立了单一连续应激(single-prolonged stress,SPS)经典PTSD动物模型,探讨了CDK4-pRB-E2F1通路在PTSD引起神经细胞凋亡中的可能作用。
1 材料与方法 1.1 实验动物与分组选取健康雄性8~10周龄Wistar大鼠50只(中国医科大学实验动物中心提供),体质量(150±20) g。大鼠分隔饲养,每12 h光照与黑暗交替,温度22~25 ℃,大鼠可自由摄取食物和水。SPS处理后1 d、4 d、7 d、14 d将大鼠随机分为4组,将未做任何处理大鼠作为对照组,每组10只。
1.2 PTSD大鼠模型建立采用SPS刺激方法建立PTSD大鼠模型,具体步骤:(1)用剪开的塑料矿泉水瓶(500 mL)将大鼠固定、禁锢2 h;(2)将大鼠放入水深40 cm、水温25 ℃左右的水池中游泳20 min;(3)将大鼠从水池中夹出,放置恢复15 min,然后乙醚麻醉大鼠;(4)大鼠放回笼子中继续饲养。
1.3 方法 1.3.1 旷场实验将对照组和SPS 7 d组大鼠分别放入同样条件下的四方形旷场箱中,安静观察并记录大鼠在5 min内进入旷场箱中央位置区域范围的次数,穿越中心区域次数越少代表焦虑状态越严重。
1.3.2 僵立行为测定僵立行为是啮齿类动物在受到惊吓后,保持一种僵硬蹲伏状态的行为,提示动物存在恐惧记忆。将对照组和SPS 7 d组大鼠先后放入前期大鼠游泳使用的水池内,安静观察大鼠5 min,每隔10 s检测1次,记录大鼠表现出僵立行为的次数。僵立行为=僵立行为次数/观察总次数×100%。
1.3.3 Western blotting检测pRB、E2F1表达各组大鼠腹腔注射2%戊巴比妥钠注射液麻醉,麻醉成功后将大鼠放于冰面上,迅速取出杏仁核脑组织。将取出脑组织匀浆和超声粉碎处理后,4 ℃,12 000 r/min离心20~30 min,离心后提取上清液;采取考马斯亮蓝方法测定标本蛋白浓度,按照每份标本蛋白含量50 μg标准提取样本;采用10%SDS-PAGE凝胶电泳后,采用恒压下转PVDF膜处理,将PVDF膜裁剪、封闭和漂洗后,分别滴加兔来源pRB抗体(1: 600)和兔来源E2F1抗体(1: 500),4 ℃封闭条件下过夜;应用TBST液清洗膜3次,每次15 min;分别加入羊抗兔辣根过氧化物酶IgG抗体(1:1 000),室温条件下孵育2 h,经TBST液清洗膜3次后ECL发光液显色。使用Fluorchem V2.0系统测定目标条带吸光度,然后分别计算目标条带的平均吸光度值和作为参照的GAPDH条带的平均吸光度值,两者比值代表蛋白的相对表达量。
1.3.4 实时PCR检测RB mRNA、E2F1 mRNA表达按照1.3.3方法麻醉大鼠后获取杏仁核脑组织,Trizol法提取各组细胞总RNA,严格按照试剂盒说明书将RNA逆转录为cDNA。扩增反应体系,SYBR 10 µL,PCR上段引物0.4 µL,PCR下段引物0.4 µL,模板cDNA 2 µL,DEPC水7.2 µL;PCR引物序列见表 1。采用LightCycler 480型PCR仪进行反应和结果测试。
| Gene | PCR primer sequence | Product length (bp) |
| RB | Sense 5’-GATGCGCCAGTTTCTAAGCG-3’ | 179 |
| Antisense 5’- ACCAGAGCGTAACAACCACA-3’ | ||
| E2F1 | Sense 5’-TGAAACGGAGGCTGGATCTG-3’ | 97 |
| Antisense 5’-TTCACACCTTTCCCTGGGTG-3’ | ||
| GAPDH | Sense 5’-ACTTTGGCATCGTGGAAGGG-3’ | 264 |
| Antisense 5’-ACTTGGCAGGTTTCTCCAGG-3’ |
1.4 统计学分析
采用SPSS 18.0软件进行统计分析,计量资料采用x±s表示。组间比较采用t检验或单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 2组行为学检测结果旷场实验结果显示,对照组和SPS 7d组多数时间在箱壁周围范围内活动,其活动轨迹呈现沿壁活动的特性。对照组和SPS 7 d组大鼠进入旷场箱中央位置区域次数分别为8.20±1.87、1.50±0.85,2组比较差异有统计学意义(P < 0.05)。僵立行为测试结果显示,对照组和SPS 7 d组表现截然不同。SPS 7 d组大鼠典型僵立蹲伏动作增多,其他活动行为频率降低,时常出现头、背毛发竖起等警觉动作;而对照组大鼠活动自如,僵立蹲伏动作较少。对照组和SPS 7d组大鼠僵立行为分别为(11.00±5.24) %、(56.67±8.61) %,2组比较差异有统计学意义(P < 0.05)。
2.2 各组pRB和E2F1蛋白表达结果结果显示,SPS各组大鼠pRB和E2F1蛋白表达均较对照组增高。与对照组比较,SPS 7 d组和SPS 14 d组pRB和E2F1蛋白表达显著增高(P < 0.05),见图 1。
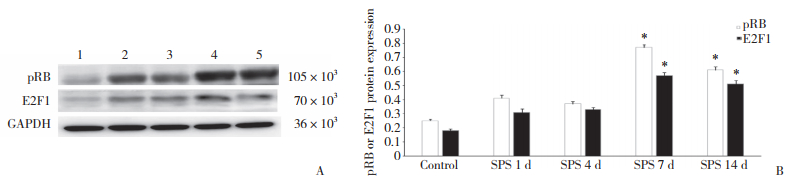
|
| A, protein expression of pRB and E2F1;B, statistical results of protein expression.1, control group; 2, SPS 1 d group; 3, SPS 4 d group; 4, SPS 7 d group; 5, SPS 14 d group. *P < 0.05 vs control group. 图 1 各组pRB、E2F1蛋白表达 Fig.1 Protein Expression of pRB and E2F1 in each group |
2.3 各组RB mRNA、E2F1 mRNA表达结果
结果显示,SPS各组大鼠RB、E2F1 mRNA表达均较对照组增高。与对照组比较,SPS 4 d组、SPS 7 d组、SPS 14 d组RB mRNA表达显著增高(P < 0.05);SPS 7 d组、SPS 14 d组E2F1 mRNA表达显著增高(P < 0.05)。见表 2。
| Group | RB mRNA | E2F1 mRNA |
| Control | 0.500±0 | 0.500±0 |
| SPS 1 d | 0.547±0.055 | 0.625±0.057 |
| SPS 4 d | 1.073±0.0661) | 0.756±0.060 |
| SPS 7 d | 1.512±0.0631) | 1.299±0.0611) |
| SPS 14 d | 1.530±0.0871) | 1.065±0.0821) |
| 1)P<0.05 vs control group. | ||
3 讨论
已有研究[10]表明PTSD杏仁核组织发生病理变化,从而证实了PTSD产生的异常增强的恐惧记忆、焦虑等症状的根源很可能在杏仁核等边缘系统。本研究中旷场实验和僵立行为测试显示,SPS刺激后大鼠进入旷场箱中央位置区域范围的次数显著减少,典型僵立蹲伏动作增多,时常出现头、背毛发竖起等警觉动作,说明SPS刺激引起大鼠产生恐惧、焦虑的症状,证实PTSD模型建模成功。
在RB蛋白与E2F1转录因子在细胞周期调控中的关系研究中发现,RB蛋白被CDK4/CDK6-CyclinD复合物磷酸化,进而将E2F1从RB-E2F1复合物中游离出来发挥转录活性,推进细胞周期进入S期[11]。因此,CDK4、CDK6、Cyclin D蛋白、RB蛋白和E2F1转录因子构成了一条完整的调控细胞周期进程的链条,形成了CDK/Cyclin D-pRB-E2F信号传导通路。已有研究[5, 12-13]证实中枢神经损伤时神经细胞内CDK4、Cyclin D1、pRB和E2F1等细胞周期相关因子异常高表达,说明可能激活了CDK4/Cyclin D1-pRB-E2F信号通路,重启细胞周期,进而导致细胞凋亡。本研究结果显示SPS刺激后pRB和E2F1表达增加,其表达升高趋势与前期研究[4]CyclinD1、CDK4表达升高趋势基本相同。因此推测PTSD中CDK4-pRB-E2F1信号转导通路激活,细胞周期重启,进而诱导了神经细胞凋亡。目前,关于CDK4-pRB-E2F1通路引起细胞凋亡机制的研究[14-15]发现,游离的E2F1可能通过阻断抗凋亡信号、依赖p53凋亡基因和非依赖p53凋亡基因等途径诱导细胞凋亡。
综上所述,PTSD大鼠杏仁核神经细胞中pRB及E2F1高表达,CDK4-pRB-E2F1通路可能参与了PTSD杏仁核神经细胞的调亡。但PTSD中E2F1转录因子通过何种具体途径诱发细胞凋亡,以及如何对细胞周期相关因子进行干预的尚不清楚,今后将进一步研究、论证。
| [1] |
丁金兰, 韩芳, 石玉秀. 创伤后应激障碍大鼠杏仁核PDE-4和CREB的表达[J]. 中国组织化学与细胞化学杂志, 2015, 24(5): 435-438. DOI:10.16705/j.cnki.1004-1850.2015.05.012 |
| [2] |
WIMALAWANSA SJ. Mechanisms of developing post-traumatic stress disorder:new targets for drug development and other potential interventions[J]. CNS Neurol Disord Drug Targets, 2014, 13(5): 807-816. DOI:10.2174/1871527313666140711091026 |
| [3] |
JIA YB, HAN YH, WANG XY, et al. Role of apoptosis in the post-traumatic stress disorder model-single prolonged stressed rats[J]. Psychoneuroendocrinology, 2018, 95: 97-105. DOI:10.1016/j.psyneuen.2018.05.015 |
| [4] |
CONG M, WEN LL, HAN F, et al. Alterations in cyclin D1 and cyclin-dependent kinase 4 expression in the amygdalae of post-traumatic stress disorder rats[J]. Mol Med Rep, 2017, 16(6): 8351-8358. DOI:10.3892/mmr.2017.7613 |
| [5] |
WANG HQ, LIAO ZB, SUN XC, et al. Intravenous administration of honokiol provides neuroprotection and improves functional recovery after traumatic brain injury through cell cycle inhibition[J]. Neuropharmacology, 2014, 86: 9-21. DOI:10.1016/j.neuropharm.2014.06.018 |
| [6] |
LIU W, LIU XJ, YANG HL, et al. Phosphorylated retinoblastoma protein (p-Rb) is involved in neuronal apoptosis after traumatic brain injury in adult rats[J]. J Mol Histol, 2013, 44(2): 147-158. DOI:10.1007/s10735-013-9481-z |
| [7] |
YU Y, REN QG, ZHANG ZH, et al. Phospho-Rb mediating cell cycle reentry induces early apoptosis following oxygen-glucose deprivation in rat cortical neurons[J]. Neurochem Res, 2012, 37(3): 503-511. DOI:10.1007/s11064-011-0636-6 |
| [8] |
SHATS I, DENG M, DAVIDOVICH A, et al. Expression level is a key determinant of E2F1-mediated cell fate[J]. Cell Death Differ, 2017, 24(4): 626-637. DOI:10.1038/cdd.2017.12 |
| [9] |
TING JH, MARKS DR, SCHLEIDT SS, et al. Targeted gene mutation of E2F1 evokes age-dependent synaptic disruption and behavioral deficits[J]. J Neurochem, 2014, 129(5): 850-863. DOI:10.1111/jnc.12655 |
| [10] |
ASUKAI N. Treatment of posttraumatic stress disorder and extinction learning of traumatic memory[J]. Nihon Shinkei Seishin Yakurigaku Zasshi, 2013, 33(3): 111-115. |
| [11] |
AL-KHALAF HH, COLAK D, AL-SAIF M, et al. p16INK4A positively regulates cyclin D1 and E2F1 through negative control of AUF1[J]. PLoS One, 2011, 6(7): e21111. DOI:10.1371/journal.pone.0021111 |
| [12] |
KUMARI A, IWASAKI T, PYNDIAH S, et al. Regulation of E2F1-induced apoptosis by poly (ADP-ribosyl) ation[J]. Cell Death Differ, 2015, 22(2): 311-322. DOI:10.1038/cdd.2014.146 |
| [13] |
侯一玮, 王洪财, 葛汝丽. 细胞周期G2/M期调控与神经变性疾病[J]. 国际神经病学神经外科学杂志, 2018, 45(3): 320-323. DOI:10.16636/j.cnki.jinn.2018.03.024 |
| [14] |
QI JJ, LIU L, CAO JX, et al. E2F1 regulates p53R2 gene expression in p53-deficient cells[J]. Mol Cell Biochem, 2015, 399(1/2): 179-188. DOI:10.1007/s11010-014-2244-7 |
| [15] |
王瑞, 达林泰, 乌兰其其格. CDK6及E2F-1参与细胞周期调控pRb通路的研究进展[J]. 现代肿瘤医学, 2015, 23(3): 423-426. DOI:10.3969/j.issn.1672-4992.2015.03.40 |
 2021, Vol. 50
2021, Vol. 50