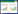文章信息
- 朱英会, 仲伟俍, 王志坚, 仲涛, 田康
- ZHU Yinghui, ZHONG Weiliang, WANG Zhijian, ZHONG Tao, TIAN Kang
- miR-149-5p通过HMGA2调控骨肉瘤细胞迁移
- miR-149-5p regulates the migration of osteosarcoma cells through HMGA2
- 中国医科大学学报, 2021, 50(6): 521-525
- Journal of China Medical University, 2021, 50(6): 521-525
-
文章历史
- 收稿日期:2020-12-07
- 网络出版时间:2021-05-26 16:28
2. 大连医科大学附属第一医院骨科, 辽宁 大连 116011
2. Department of Orthopedics, The First Affiliated Hospital of Dalian Medical University, Dalian 116011, China
骨肉瘤(osteosarcoma,OS)是最常见的原发性恶性骨肿瘤之一,主要发生在儿童和青少年,具有高度异质性,可产生不成熟的骨和类骨结构[1]。20世纪70年代,截肢是OS唯一的干预手段,患者5年生存率低于20%。化疗显著提高了患者的预期寿命,目前患者的5年生存率为65%~70%[2-3]。自20世纪90年代以来,患者生存率并未明显提高[2-3]。因此,更好地了解促进OS发生、发展的生物学过程和关键机制,对于提高OS患者的治疗效果和预后至关重要。
微RNA(microRNA,miRNA)是一类非编码RNA,其最常见的功能是通过结合mRNA从而负调控靶基因的表达,在细胞增殖和侵袭等生物学过程中发挥关键作用[4-5]。miR-149-5p是miRNA的一种,已经发现其在乳腺癌和胶质瘤中表达下调,并与肿瘤转移、复发相关[4]。在神经母细胞瘤中,miR-149-5p通过抑制Akt1和E2F1的表达,诱导细胞凋亡[6]。研究[7]发现,miR-149-5p在OS中表达下调,且与肿瘤大小和预后不良相关。但其在OS中的具体调控机制尚不明确,相关研究较少。
高迁移率族蛋白A2(high mobility group protein A2,HMGA2)是HMGA蛋白家族的成员,通过直接结合基因启动子和增强子区域的A/T富集的DNA序列,参与染色质结构的调控[8]。它在多种肿瘤中高表达,并调控多种肿瘤的生物学过程。研究[9]发现,其受lncVPS9D1-AS1的调控,促进结肠癌生长。此外,其还受miR-142-3p的调节,参与OS的生长、转移过程[10]。但其调控机制和过程仍存在许多未知,其可能与miR-142-3p具有相似的机制,参与OS的进展。本研究探讨了miR-149-5p与HMGA2之间的调控关系及其对OS细胞迁移能力的影响。
1 材料与方法 1.1 主要试剂和仪器OS细胞(Saos2、MG63、U2OS和HOS)和hFOB1.19细胞购自中国科学院细胞库。胎牛血清购自美国Gibco公司,基础培养基购自中国HyClone公司。miR-149-5p过表达序列及阴性对照(negative control,NC)、HMGA2过表达质粒由上海吉玛公司合成和提供。转染试剂购自中国Invitrogen公司,1%结晶紫染色液购自中国Solarbio公司,SDS-PAGE凝胶配制试剂盒、BCA蛋白检测试剂盒购自中国碧云天公司。HMGA2、β-actin抗体购自中国CST生物公司。
1.2 方法 1.2.1 细胞培养MG63、HOS和U2OS细胞培养于α-MEM培养基(美国HyClone公司),添加10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素(中国赛默飞公司)。Saos2细胞培养于RPMI 1640培养基(美国HyClone公司),添加15%的胎牛血清(中国赛默飞公司)、100 U/mL青霉素和100 μg/mL链霉素(中国赛默飞公司)。hFOB1.19细胞培养于改良的Eagle培养基(DMEM,中国赛默飞公司),添加10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素。细胞置于37 ℃、5% CO2的培养箱中培养。细胞生长融合度达到80%~90%左右进行1:2传代,传代后在相同条件下进行常规培养。
1.2.2 细胞转染实验使用Saos2细胞系,待细胞融合度达到50%~60%,使用转染试剂进行转染。转染过程使用转染试剂Lipofectamine 3000和P3000进行流程操作。
1.2.3 实时荧光定量PCR采用实时荧光定量PCR检测miR-149-5p的表达水平。使用TRIzol(中国碧云天公司),按照制造商的说明流程从每个细胞样品中提取总RNA。使用TaqMan MicroRNA(美国Applied Biosystems公司)逆转录试剂盒进行逆转录,按照试剂盒流程进行操作(日本TaKaRa公司),使用SYBR Green Master Mix试剂盒(日本TaKaRa公司),按照说明书进行目的RNA检测。miR-149-5p:正义链5’-GGCTCTGGCTCCGTGTCTT-3’,反义链5’-CAGTGCAGGGTCCGAGGTATT-3’。HMGA2:正义链5’-AGTCCCTCTAAAGCAGCTCA-3’,反义链5’-GTCCTCTTCGGCAGACTCTT-3’。U6:正义链5’-CAAATTCGTGAAGCGTTCCATA-3’,反义链5’-AGTGCAGGGTCCGAGGTA TTC-3’。
1.2.4 Western blotting使用RIPA试剂(中国碧云天公司)提取细胞总蛋白并添加蛋白酶抑制剂。蛋白质经SDS-PAGE后转移到PVDF膜上(美国Bio-Rad公司)。PVDF膜进行5%牛血清白蛋白封闭,随后使用HMGA2、β-actin抗体(中国CST公司)4 ℃孵育(1: 1 000)过夜。第2天使用TBST清洗3次,每次5 min,然后进行二抗孵育(中国碧云天公司),孵育后TBST清洗3次,每次5 min。最后进行显色成像(Tanon-5200,日本佳能公司)。
1.2.5 Transwell实验细胞接种于Transwell小室上层,细胞密度为5×103/小室,并添加10%胎牛血清培养基进行培养,下室放同样浓度DMEM+胎牛血清培养基。细胞培养48 h后,使用多聚甲醛固定15 min,0.05%结晶紫染色20 min。随后拍照,进行细胞计数及细胞数量的统计学分析。其中PBS为空白对照组;mimic-miR-149-5p+vector组为miR-149-5p过表达模拟物加HMGA2过表达质粒空载体;HMGA2+mimic-NC组为HMGA2过表达质粒加miRNA过表达模拟物阴性对照序列;mimic-miR-149-5p+HMGA2组为miR-149-5p过表达模拟物加HMGA2过表达质粒。
1.2.6 生物信息学分析通过starbase(http://starbase.sysu.edu.cn)进行结合预测,该网站中包含有PITA和miRmap网站的结合信息。
1.3 统计学分析采用SPSS 20.0软件进行统计分析。所有实验至少进行3次,数据以x±s表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
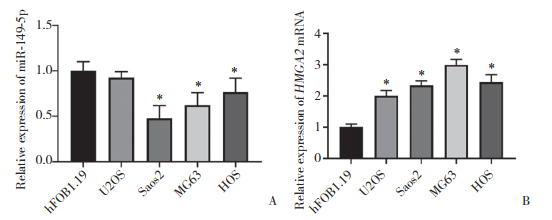
2 结果 2.1 miR-149-5p和HMGA2在OS细胞中的表达情况为了探索miR-149-5p在OS中的作用,通过PCR检测和比较OS细胞(Saos2、MG63、U2OS和HOS)和hFOB1.19细胞中miR-149-5p和HMGA2的表达(图 1)。结果显示,与hFOB1.19细胞相比,miR-149-5p在Saos2、MG63和HOS细胞中低表达,HMGA2 mRNA在U2OS、Saos2、MG63和HOS细胞中高表达(P < 0.05)。Western blotting结果提示,HMGA2在OS细胞U2OS、Saos2、MG63和HOS中表达增加(图 2)。提示miR-149-5p可能参与OS的发生和进展,HMGA2是一个促癌基因。
|
| A, miR-149-5p; B, HMGA2 mRNA. The hFOB1.19 cells were used as the control. * P < 0.05 vs hFOB1.19 cells. 图 1 PCR检测OS细胞中miR-149-5p和HMGA2 mRNA的表达情况 Fig.1 Expression of miR-149-5p and HMGA2 mRNA in different osteosarcoma cell lines detected using PCR |
|
| 图 2 Western blotting检测OS细胞中HMGA2蛋白的表达 Fig.2 Expression of HMGA2 protein in different osteosarcoma cell lines detected using Western blotting |
2.2 miR-149-5p抑制OS细胞迁移
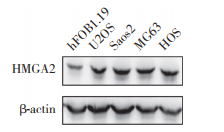
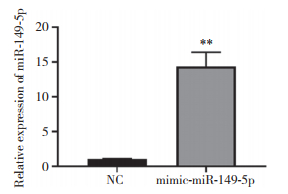
为进一步确认miR-149-5p在OS细胞恶性过程中的作用,通过转染构建过表达细胞系(Saos2),采用PCR检测细胞中miR-149-5p表达水平(图 3),证明过表达细胞系构建成功(P < 0.01)。采用CCK-8实验检测过表达miR-149-5p的Saos2细胞的迁移能力(图 4),结果显示,miR-149-5p过表达明显抑制了Saos2细胞的迁移能力,说明miR-149-5p参与OS细胞迁移能力的调节过程。
|
| **P < 0.01 vs NC group. 图 3 PCR检测Saos2细胞中miR-149-5p过表达 Fig.3 miR-149-5p overexpression in Saos2 cells detected using PCR |

|
| 图 4 Transwell实验检测过表达miR-149-5p的Saos2细胞的迁移能力×200 Fig.4 Migration of Saos2 cells after miR-149-5p overexpression detected using the Transwell assay ×200 |
2.3 miR-149-5p可调控HMGA2的表达
通过生物信息学网站starbase分析和预测miR-149-5p和HMGA2 mRNA的结合位点,结果发现,两者存在结合位点(图 5)。采用PCR检测miR-149-5p过表达细胞系Saos2中HMGA2 mRNA的表达,结果发现,过表达细胞系中HMGA2 mRNA表达明显下降(图 6A)(P < 0.05)。Western blotting结果显示,HMGA2蛋白表达水平也下降(图 6B)。这些结果说明miR-149-5p可调控细胞内HMGA2的表达水平。
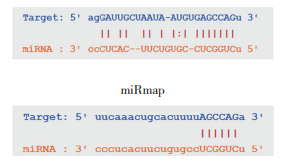
|
| 图 5 starBase网站预测miR-149-5p和HMGA2mRNA的结合位点 Fig.5 Binding sites of miR-149-5p and HMGA2 mRNA predicted using starBase |

|
| A, expression of HMGA2 mRNA; B, expression of HMGA2 protein. NC, negative control. * P < 0.05 vs NC group. 图 6 过表达miR-149-5p后HMGA2mRNA和蛋白的表达情况 Fig.6 Expression of HMGA2 mRNA and protein after miR-149-5p overexpression |
2.4 miR-149-5p通过HMGA2调控OS细胞迁移
HMGA2受到miR-149-5p的调控,但miR-149-5p是否可通过HMGA2调控Saos2细胞的迁移能力,还需要进一步证明。因此,采用Transwell实验评估二者的关系及对细胞迁移能力的调节作用(图 7)。结果发现,过表达miR-149-5p可抑制HMGA2过表达引起的细胞迁移。
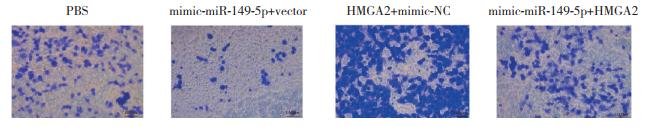
|
| 图 7 miR-149-5p通过HMGA2调控OS细胞迁移×200 Fig.7 miR-149-5p regulates the migration of osteosarcoma cells through HMGA2 ×200 |
3 讨论
OS是最常见的恶性骨肿瘤,是一种侵袭性肿瘤,尽管原发性肿瘤的多药化疗和手术切除有了进展,但OS患者的5年总体生存率和复发率并未得到明显改善[11]。多种与关键信号转导通路相关的分子改变与OS病理生物学的多个过程有关,如增殖、侵袭、存活和转移[12]。因此,识别这些重要的分子靶点可能为OS的诊断和治疗提供新的方法。
最近的研究证实了miR-149-5p在包括癌症在内的多种疾病中具有不可或缺的作用。miR-149-5p在多种肿瘤中发挥重要作用,如在结直肠癌中其过表达抑制细胞迁移和侵袭[13],在非小细胞肺癌中其抑制肿瘤细胞上皮间质转化过程,从而调节其转移能力[14]。胃癌中,miR-149-5p还可以抑制肿瘤干细胞群体的比例[15]。最近的研究[7]发现,miR-149-5p在OS肿瘤组织中低表达,并参与细胞生长能力调控过程,提示其可能是一个抑癌基因,但其具体调控机制尤其是对细胞迁移能力的调节机制尚不清楚。因此,本研究探讨了miR-149-5p在OS细胞迁移能力调控过程中的关键作用,通过PCR检测miR-149-5p在OS细胞中的表达,并通过PCR和Western blotting检测HMGA2在OS细胞中的表达。结果发现,miR-149-5p在OS细胞中表达下降,HMGA2 mRNA和蛋白表达增加。本研究发现,过表达miR-149-5p后Saos-2细胞迁移能力下降,通过生物信息学网站预测了miR-149-5p与HMGA2 mRNA的可能结合位点,最后通过Transwell实验证实了miR-149-5p通过HMGA2调控OS细胞的迁移。
综上所述,本研究通过PCR、Western blotting和Transwell实验检测OS细胞在不同条件下的迁移能力,发现了一个迁移调控关键基因miR-149-5p,其可能成为一个有效的肿瘤治疗靶点。
| [1] |
TIRTEI E, CAMPELLO A, ASAFTEI SD, et al. Precision medicine in osteosarcoma:match trial and beyond[J]. Cells, 2021, 10(2): 281. DOI:10.3390/cells10020281 |
| [2] |
ISAKOFF MS, BIELACK SS, MELTZER P, et al. Osteosarcoma:current treatment and a collaborative pathway to success[J]. J Clin Oncol, 2015, 33(27): 3029-3035. DOI:10.1200/JCO.2014.59.4895 |
| [3] |
HE C, SUN J, LIU C, et al. Elevated H3K27me3 levels sensitize osteosarcoma to cisplatin[J]. Clin Epigenetics, 2019, 11(1): 8. DOI:10.1186/s13148-018-0605-x |
| [4] |
CHAN SH, HUANG WC, CHANG JW, et al. MicroRNA-149 targets GIT1 to suppress integrin signaling and breast cancer metastasis[J]. Oncogene, 2014, 33(36): 4496-4507. DOI:10.1038/onc.2014.10 |
| [5] |
NAVARRO-VILLARÁ N E, DE LA CRUZ-OJEDA P, CONTRERAS L, et al. Molecular pathways leading to induction of cell death and anti-proliferative properties by tacrolimus and mTOR inhibitors in liver cancer cells[J]. Cell Physiol Biochem, 2020, 54(3): 457-473. DOI:10.33594/000000230 |
| [6] |
PAN SJ, ZHAN SK, PEI BG, et al. MicroRNA-149 inhibits proliferation and invasion of glioma cells via blockade of AKT1 signaling[J]. Int J Immunopathol Pharmacol, 2012, 25(4): 871-881. DOI:10.1177/039463201202500405 |
| [7] |
XU RD, FENG F, YU XS, et al. miR-149-5p inhibits cell growth by regulating TWEAK/Fn14/PI3K/AKT pathway and predicts favorable survival in human osteosarcoma[J]. Int J Immunopathol Pharmacol, 2018, 32: 2058738418786656. DOI:10.1177/2058738418786656 |
| [8] |
WANG S, WANG Z, LI J, et al. Splicing factor USP39 promotes ovarian cancer malignancy through maintaining efficient splicing of oncogenic HMGA2[J]. Cell Death Dis, 2021, 12(4): 294. DOI:10.1038/s41419-021-03581-3 |
| [9] |
LIU H, ZHANG X, JIN X, et al. Long noncoding RNA VPS9D1-AS1 sequesters microRNA-525-5p to promote the oncogenicity of colorectal cancer cells by upregulating HMGA1[J]. Cancer Manag Res, 2020, 12: 9915-9928. DOI:10.2147/CMAR.S273687 |
| [10] |
PAN W, PANG J, JI B, et al. RNA binding protein HuR promotes osteosarcoma cell progression via suppressing the miR-142-3p/HMGA1 axis[J]. Oncol Lett, 2018, 16(2): 1475-1482. DOI:10.3892/ol.2018.8855 |
| [11] |
LILIENTHAL I, HEROLD N. Targeting molecular mechanisms underlying treatment efficacy and resistance in osteosarcoma:a review of current and future strategies[J]. Int J Mol Sci, 2020, 21(18): 6885. DOI:10.3390/ijms21186885 |
| [12] |
李颖, 贾迪, 杨丹. 信号通路相关的lncRNA与骨肉瘤关系的研究进展[J]. 生命的化学, 2020, 40(3): 418-423. DOI:10.13488/j.smhx.20190377 |
| [13] |
刘晓柱, 李银凤. miR-149抑制结直肠癌细胞迁移的分子机制研究[J]. 天津医药, 2020, 48(1): 19-24. DOI:10.11958/20192289 |
| [14] |
KE Y, ZHAO W, XIONG J, et al. miR-149 inhibits non-small-cell lung cancer cells EMT by targeting FOXM1[J]. Biochem Res Int, 2013, 2013: 506731. DOI:10.1155/2013/506731 |
| [15] |
LI P, SHAN JX, CHEN XH, et al. Epigenetic silencing of microRNA-149 in cancer-associated fibroblasts mediates prostaglandin E2/interleukin-6 signaling in the tumor microenvironment[J]. Cell Res, 2015, 25(5): 588-603. DOI:10.1038/cr.2015.51 |
 2021, Vol. 50
2021, Vol. 50