文章信息
- 吴明, 赵玉洁, 彭楠茜, 陈波
- WU Ming, ZHAO Yujie, PENG Nanxi, CHEN Bo
- 沉默UBA2对三阴性乳腺癌细胞系MDA-MB-231增殖和迁移的影响
- Effects of silencing UBA2 on the proliferation and migration of the triple-negative breast cancer cell line MDA-MB-231
- 中国医科大学学报, 2021, 50(3): 241-244
- Journal of China Medical University, 2021, 50(3): 241-244
-
文章历史
- 收稿日期:2020-09-07
- 网络出版时间:2021-03-18 14:34
乳腺癌是女性最常见的恶性肿瘤,仅次于肺癌,严重威胁女性的生命健康[1]。乳腺癌是一种高度异质性恶性肿瘤,根据激素受体和HER-2的表达情况,可以分为4种亚型,即Luminal A型、Luminal B型、HER-2过表达型和三阴性乳腺癌[2]。相较于其他亚型,三阴性乳腺癌由于缺乏有效的治疗靶点,目前除化疗和手术以外,暂无可靠的治疗方法,患者的生存和预后很差,是制约乳腺癌患者预后的因素之一[3]。因此,研究三阴性乳腺癌潜在的增殖机制有助于开发三阴性乳腺癌的治疗靶点,有利于改善患者的预后。
UBA2蛋白是参与小泛素样修饰物(small ubiquitin-like modifier,SUMO)修饰的重要分子,蛋白的SUMO化修饰是重要的翻译后修饰形式,参与许多细胞生物过程,如细胞增殖、转移、侵袭等[4-5]。UBA2在多种肿瘤中表达异常。胃癌中UBA2表达量高于正常组织,且高分期患者UBA2的表达明显高于低分期患者[6]。直肠癌中敲低UBA2后,肿瘤细胞的增殖和侵袭能力均受到抑制[7]。目前,UBA2对三阴性乳腺癌中肿瘤细胞增殖和迁移的影响仍知之甚少。因此,本研究通过敲低UBA2基因,探讨其对三阴性乳腺癌细胞增殖、迁移和凋亡的影响,以期为三阴性乳腺癌提供新的治疗靶点。
1 材料与方法 1.1 材料人三阴性乳腺癌细胞系MDA-MB-231购自北京协和细胞库;胎牛血清、DMEM培养基购自美国Corning公司;0.25% EDTA-胰酶购自美国Gibco公司;UBA2 siRNA购自上海吉玛基因技术公司;CCK-8试剂盒购自上海碧云天生物技术公司;兔抗人UBA2抗体购自美国CST公司;鼠抗人GAPDH抗体、辣根过氧化物酶标记的山羊抗鼠、兔二抗购自北京中杉金桥生物技术公司;Annexin V/碘化丙啶试剂盒购自美国Biolegend公司。
1.2 方法 1.2.1 生物信息学分析采用Kaplan-Meier plotter数据库中的乳腺癌数据集分析UBA2表达情况及其与乳腺癌患者预后的关系。利用人类蛋白质图谱(The Human Protein Atlas,HLA)数据库分析UBA2在正常乳腺组织和乳腺癌组织中的表达差异。
1.2.2 细胞培养三阴性乳腺癌细胞系MDA-MB-231培养于含10%胎牛血清的DMEM培养基中,放于37 ℃、5%CO2的培养箱中培养,当细胞汇合度在80%左右时,进行传代培养或保种。取处于对数期、生长状态良好的细胞用于实验。
1.2.3 细胞转染按照操作手册将UBA2 siRNA-287、UBA2 siRNA-354和阴性对照(negative control,NC)siRNA转染至MDA-MB-231细胞中。将转染UBA2 siRNA-287和UBA2 siRNA-354的细胞设为沉默组,转染NC siRNA的细胞设为阴性对照组,未转染任何siRNA的野生型细胞设为空白对照组。转染后,采用Western blotting检测各组转染效果,收集细胞用于后续实验。
1.2.4 CCK-8法检测沉默UBA2对MDA-MB-231细胞增殖的影响将转染后的各组MDA-MB-231细胞以5×103/孔接种于96孔板中,放回培养箱中培养24 h。每孔加入CCK-8溶液10 μL,继续培养2 h后,应用酶标仪检测各孔在450 nm处的吸光度,每组设3个复孔,重复3次。
1.2.5 划痕实验检测沉默UBA2对MDA-MB-231细胞迁移的影响收集转染后的各组MDA-MB-231细胞,以8×105/孔铺于6孔板中。次日,用200 μL枪头进行划痕,PBS洗涤2遍,加入无血清培养基,记录划痕面积后,放回培养箱中继续培养。24 h后取出6孔板,记录划痕面积。
1.2.6 流式细胞术检测沉默UBA2后MDA-MB-231细胞的凋亡情况收集转染后的各组MDA-MB-231细胞,按照试剂说明,依次加入5 μL Annexin V-FITC和10 μL碘化丙啶,混匀后,室温暗处孵育15 min,加入200 μL binding buffer上机检测。
1.3 统计学分析采用GraphPad Prism 8软件进行统计学分析并作图。计量资料以x±s表示,组间比较采用成组t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 乳腺癌中UBA2高表达与预后不良有关HLA数据库分析结果显示,与正常乳腺组织相比,乳腺癌组织中UBA2表达量异常增高。Kaplan-Meier plotter数据库预后分析结果显示,UBA2高表达的患者其总生存(overall survival,OS)、无复发生存(relapse free survival,RFS)、无远处转移生存(distant metastasis free survival,DMFS)和后进展生存(post progression survival,PPS)均比UBA2低表达的患者差,提示UBA2高表达与预后不良有关。见图 1。
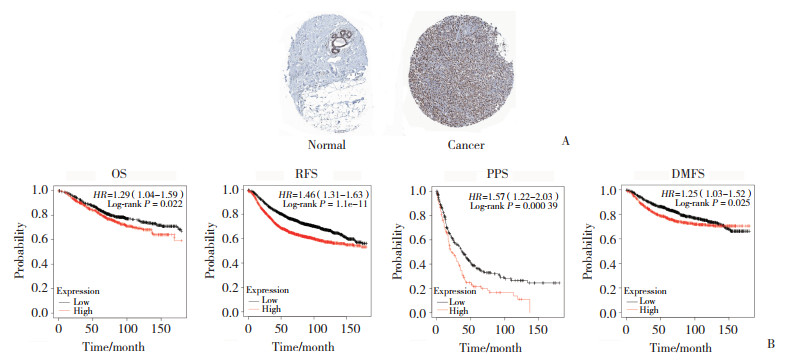
|
| A, expression of UBA2 in the normal breast and breast cancer tissues; B, survival curves constructed using the Kaplan-Meier Plotter database. 图 1 UBA2在乳腺癌中的表达以及不同UBA2表达水平的乳腺癌患者的生存曲线 Fig.1 Expression of UBA2 in the breast cancer tissues and survival curves of the patients with low- and high-expression of UBA2 |
2.2 UBA2沉默
Western blotting结果显示,转染UBA2 siRNA后,三阴性乳腺癌细胞系MDA-MB-231中UBA2蛋白的表达明显降低,表明UBA2在MDA-MB-231细胞中被成功沉默。见图 2。

|
| *P < 0.001. 图 2 UBA2沉默后蛋白的表达情况 Fig.2 Expression of the UBA2 protein upon silencing UBA2 |
2.3 沉默UBA2对MDA-MB-231细胞增殖的影响
CCK-8结果显示,在MDA-MB-231细胞中沉默UBA2后,细胞的增殖能力受到明显抑制,差异有统计学意义(P < 0.001)。见图 3。

|
| 图 3 沉默UBA2对细胞增殖的抑制情况 Fig.3 Inhibition of the proliferation of the breast cancer cells upon silencing UBA2 |
2.4 沉默UBA2对MDA-MB-231细胞迁移的影响
划痕实验结果显示,沉默UBA2后,沉默组MDA-MB-231细胞的迁移能力比空白对照组弱,差异有统计学意义(P < 0.001)。见图 4。

|
| A, representative image from the wound-healing assay; B, quantification of the results from the wound-healing assay. *P < 0.001. 图 4 沉默UBA2对细胞迁移的抑制情况 Fig.4 Inhibition of the migration of the breast cancer cells upon silencing UBA2 |
2.5 沉默UBA2对MDA-MB-231细胞凋亡的影响
流式细胞术结果显示,沉默UBA2后,沉默组与空白对照组细胞凋亡情况几乎一致,表明沉默UBA2并未影响MDA-MB-231的凋亡。见图 5。

|
| 图 5 沉默UBA2后对细胞凋亡的抑制情况 Fig.5 Inhibition of the apoptosis of the breast cancer cells upon silencing UBA2 |
3 讨论
三阴性乳腺癌因为其恶性程度高、缺乏有效的治疗靶点,制约着患者的生存率[8]。近年来免疫治疗和靶向治疗蓬勃发展,PDL1单抗、CTLA单抗和赛妥珠单抗-格卫替康等多种抗体药和抗体偶联药物被证明可以用于三阴性乳腺癌的治疗,改善患者的预后[9-10]。虽然这些新药极大丰富了三阴性乳腺癌的治疗手段,但是由于每种药物适应人群的局限性,因此仍需要继续探索有效的三阴性乳腺癌治疗新靶点。
UBA2是SUMO化修饰过程中的关键激活酶,主要负责激活SUMO分子,从而促使SUMO分子与靶蛋白连接,实现靶蛋白的SUMO化修饰[11]。SUMO化修饰不仅可以提高靶蛋白的稳定性,也可以改变靶蛋白的细胞内分布[12-13]。以往研究显示,UBA2的异常表达不仅会引起多种肿瘤的恶性表型,在非肿瘤疾病中,UBA2的异常表达还与疾病的恶性进展有关。UBA2的表达增高会加重类风湿性关节炎的损伤[14]。此外,抑制UBA2的表达可以减轻肝脏的缺血再灌注损伤,降低肝脏手术后患者发生并发症的风险[15]。本研究首先利用公共数据库分析了UBA2在乳腺癌中的表达情况及其与预后的关系,结果显示,UBA2在乳腺癌中表达量高于正常乳腺组织,UBA2高表达的患者预后不良。然后利用RNA干扰技术,在三阴性乳腺癌细胞系MDA-MB-231中沉默了UBA2,探究其在乳腺癌细胞增殖和迁移中的作用。结果显示,沉默UBA2抑制了MDA-MB-231细胞的增殖和迁移能力。这与UBA2在其他癌症中的作用十分相似。
综上所述,本研究发现UBA2高表达与患者预后不良有关,并且该基因在乳腺癌细胞的增殖和转移中发挥一定作用。由于UBA2是SUMO化的关键分子,本研究结果提示SUMO化在乳腺癌增殖和转移中发挥一定作用。但是,UBA2过表达引起乳腺癌细胞中哪些下游分子发生变化值得进一步研究,这也为探索三阴性乳腺癌新的治疗靶点提供了新的思路。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
DESANTIS CE, MA J, GAUDET MM, et al. Breast cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(6): 438-451. DOI:10.3322/caac.21583 |
| [3] |
HARBECK N, PENAULT-LLORCA F, CORTES J, et al. Breast cancer[J]. Nat Rev Dis Primers, 2019, 5(1): 66. DOI:10.1038/s41572-019-0111-2 |
| [4] |
CHANG HM, YEH ETH. SUMO: from bench to bedside[J]. Physiol Rev, 2020, 100(4): 1599-1619. DOI:10.1152/physrev.00025.2019 |
| [5] |
JIA Y, GUO Y, JIN Q, et al. A SUMOylation-dependent HIF-1α/CLDN6 negative feedback mitigates hypoxia-induced breast cancer metastasis[J]. J Exp Clin Cancer Res, 2020, 39(1): 42. DOI:10.1186/s13046-020-01547-5 |
| [6] |
李晓锋, 毛爱枝, 李国喜. 胃癌组织中UBA2表达的临床意义及其对细胞增殖和凋亡的影响[J]. 现代消化及介入诊疗, 2019, 24(9): 972-976. DOI:10.3969/j.issn.1672-2159.2019.09.007 |
| [7] |
CHENG H, SUN X, LI J, et al. Knockdown of Uba2 inhibits colorectal cancer cell invasion and migration through downregulation of the Wnt/β-catenin signaling pathway[J]. J Cell Biochem, 2018, 119(8): 6914-6925. DOI:10.1002/jcb.26890 |
| [8] |
ZHU W, PEREZ EA, HONG R, et al. Age-related disparity in immediate prognosis of patients with triple-negative breast cancer: a population-based study from SEER cancer registries[J]. PLoS One, 2015, 10(5): e0128345. DOI:10.1371/journal.pone.0128345 |
| [9] |
ZHU H, DU C, YUAN M, et al. PD-1/PD-L1 counterattack alliance: multiple strategies for treating triple-negative breast cancer[J]. Drug Discov Today, 2020, 25(9): 1762-1771. DOI:10.1016/j.drudis.2020.07.006 |
| [10] |
SYED YY. Sacituzumab govitecan: first approval[J]. Drugs, 2020, 80(10): 1019-1025. DOI:10.1007/s40265-020-01337-5 |
| [11] |
ZHAO Q, MA Y, LI Z, et al. The function of SUMOylation and its role in the development of cancer cells under stress conditions: a systematic review[J]. Stem Cells Int, 2020, 2020: 1-16. DOI:10.1155/2020/8835714 |
| [12] |
WANG S, ZHANG X, WANG H, et al. Heat shock protein 27 enhances SUMOylation of heat shock protein B8 to accelerate the progression of breast cancer[J]. Am J Pathol, 2020, 190(12): 2464-2477. DOI:10.1016/j.ajpath.2020.04.012 |
| [13] |
KNITTLE AM, HELKKULA M, JOHNSON MS, et al. SUMOylation regulates nuclear accumulation and signaling activity of the soluble intracellular domain of the ErbB4 receptor tyrosine kinase[J]. J Biol Chem, 2017, 292(48): 19890-19904. DOI:10.1074/jbc.m117.794271 |
| [14] |
WANG C, XIAO Y, LAO M, et al. Increased SUMO-activating enzyme SAE1/UBA2 promotes glycolysis and pathogenic behavior of rheumatoid fibroblast-like synoviocytes[J]. JCI Insight, 2020, 5(18): e135935. DOI:10.1172/jci.insight.135935 |
| [15] |
HUANG J, XIE P, DONG Y, et al. Inhibition of Drp1 SUMOylation by ALR protects the liver from ischemia-reperfusion injury[J]. Cell Death Differ, 2020. DOI:10.1038/s41418-020-00641-7 |
 2021, Vol. 50
2021, Vol. 50