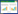文章信息
- 张晨, 李燕, 郭凤英, 刘子歌, 宋国瑞, 陈德胜
- ZHANG Chen, LI Yan, GUO Fengying, LIU Zige, SONG Guorui, CHEN Desheng
- RANKL/RANK/OPG信号通路调控磨损颗粒诱导的小鼠炎性骨溶解
- The RANKL/RANK/OPG signal pathway regulates the wear particle-induced inflammatory osteolysis in mice
- 中国医科大学学报, 2021, 50(2): 130-134, 140
- Journal of China Medical University, 2021, 50(2): 130-134, 140
-
文章历史
- 收稿日期:2020-05-07
- 网络出版时间:2021-01-13 16:38
2. 宁夏医科大学基础医学院生物化学教研室, 银川 750004
2. Department of Biochemistry, Basic Medical College, Ningxia Medical University, Yinchuan 750004, China
人工关节置换术是现阶段治疗终末期骨性关节炎的重要方法,它不仅能有效缓解关节疼痛,还能重建关节功能。由于我国老龄化人口正以比总人口增长更快的速度增加,人工关节置换术也呈递增趋势[1]。无菌性松动导致的假体下沉、松动和失效是人工关节置换术后的主要并发症,也是人工关节翻修的最主要原因[2]。如何预防和治疗假体周围骨溶解导致假体无菌性松动,是目前骨科关注的热点和难点。人工关节各部件相互摩擦产生的磨损颗粒进入机体内,通过刺激假体周围界膜组织的巨噬细胞释放多种炎性细胞因子和细胞,引起假体周围无菌性炎症反应,刺激破骨细胞增殖活化,导致假体周围的骨溶解[3]。骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)构成RANKL/RANK/OPG信号通路,对调控破骨细胞的骨溶解起重要作用[4]。RANKL/RANK/OPG信号通路的调控,可能对预防和延缓人工关节置换术后无菌性松动有非常重要的意义。目前研究[5]发现,采用外源性OPG作用于骨质疏松动物模型,能减少骨质流失,表明OPG具有调控实验性骨质疏松骨质流失的作用。本研究采用外源性OPG作用于磨损颗粒诱导小鼠气囊植骨模型,探讨RANKL/RANK/OPG信号通路对人工假体周围无菌性骨溶解的影响。
1 材料与方法 1.1 主要试剂与仪器BALB/c小鼠由宁夏医科大学实验动物中心提供,动物实验许可证号:SCXK(京)2016-0008;磨损颗粒(美国Alfa Aesar公司);OPG、RANKL、RANK(美国Sigma公司);白细胞介素-6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(杭州联科生物技术有限公司);抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)试剂盒(美国Sigma公司)。
1.2 实验分组及造模8~10周龄雌性BALB/c小鼠45只,体质量25~30 g,在SPF级环境中饲养,动物相关处置均符合《中华人民共和国实验动物管理条例》要求,适应性喂养1周后进行实验。对小鼠进行编号,采用随机数字表法将小鼠随机分为对照组、模型组和OPG组,每组15只。另选45只SPF级BALB/c同属同龄雌性小鼠,做为磨损颗粒诱导骨溶解动物模型植骨的供体,每只小鼠可提供2片用于植骨的颅骨骨片,大小约0.5 cm×0.25 cm×0.1 cm。小鼠腹腔注射3%戊巴比妥钠(35 mg/kg)进行麻醉,腹腔麻醉成功后背部消毒备皮,注射2 mL无菌空气形成气囊;之后连续每天向小鼠背部气囊中注射0.5 mL无菌空气,至第7天气囊形成;另外随机选同属同龄小鼠处死,取颅骨骨片;切开气囊,植入颅骨骨片,缝合切口。
对照组:植骨后向小鼠气囊内注射0.1 mL PBS,此后腹腔注射0.1 mL生理盐水,1次/d,持续14 d。模型组:植骨后向小鼠气囊内注射0.1 mL处理好的钛颗粒悬液,此后腹腔注射0.1 mL生理盐水,1次/d,持续14 d。OPG组:植骨后向小鼠气囊内注射0.1 mL处理好的钛颗粒悬液,之后腹腔注射OPG(3 mg/kg),1次/d,持续14 d。将3组小鼠同时间处死,取出小鼠颅骨及其囊壁组织进行相关检测。
1.3 HE染色观察炎性改变切片先后置入不同浓度二甲苯、无水乙醇以及75%乙醇浸泡,之后蒸馏水洗涤;加苏木素染色,自来水冲洗,盐酸乙醇分化,自来水冲洗,用0.6%氨水返蓝,流水冲洗;置入伊红染液染色;置入不同浓度乙醇以及二甲苯脱水透明;中性树胶封片。
1.4 TRAP染色观察骨溶解TRAP对观察、确定破骨细胞具有特异性。将小鼠颅骨及其囊壁组织经脱钙、切片、脱蜡后,经过不同浓度乙醇阶梯脱水,冲洗后放入丙酮溶液中固定,之后将玻片放入暗盒内,滴加新鲜配制的TRAP染液,染液须完全覆盖切片,37 ℃水浴锅避光孵育1 h后冲洗、苏木素复染,再次冲洗后晾干、封片。
1.5 ELISA法检测气囊植骨组织中IL-6和TNF-α的水平每组随机取3只小鼠处死后,取气囊植骨组织先剪碎,再通过RIPA裂解液裂解,12 000 r/min离心15 min后收集上清液,按照ELISA试剂盒说明书检测IL-6和TNF-α。
1.6 免疫组织化学染色检测气囊植骨组织中RANKL、RANK、OPG的表达切片在68 ℃中烤片2 h后,置入不同浓度二甲苯、无水乙醇浸泡,经自来水、蒸馏水冲洗、3% H2O2孵育后,用0.01 mol/L柠檬酸缓冲液煮沸予抗原修复,滴加羊血清于玻片封闭。分别滴加一抗(RANKL、RANK、OPG)孵育、二抗,37 ℃孵育、冲洗后,滴加辣根过氧化物酶标记链霉抗生物素蛋白稀释液,37 ℃孵育,滴加DAB静置数分钟,置于显微镜下观察显色,适时终止。后经苏木素液复染,1%盐酸乙醇分化,碳酸锂返蓝,不同浓度的乙醇、二甲苯浸泡,中性树脂封片。
显微镜下观察免疫组化染色结果并进行图像采集,每张免疫组化切片随机选取5个表达的高倍镜(×400)视野,确保每张图像的位置以及背景亮度一致。将采集的图像用Image-Pro软件进行分析,确定统一的测定标准,计算分析后得到平均光密度值。
1.7 统计学分析采用SPSS 22.0软件对数据进行统计分析,计量资料用x±s表示,多组间样本均数的比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 HE染色HE染色结果显示,对照组中未见钛颗粒浸润,气囊植骨复合体周围组织见少量的中性粒细胞、巨噬细胞和淋巴细胞等,炎症反应不明显,植骨块骨面平滑并光整;模型组气囊植骨复合体的囊壁增厚,周围钛颗粒浸润,可有中性粒细胞、巨噬细胞和嗜酸性粒细胞等浸润,炎症反应明显,植骨块表面存在侵蚀,骨面不光整,部分有缺损表现;OPG组亦有钛颗粒浸润,气囊植骨复合体周围气囊组织厚度与模型组相比较薄,周围有少量炎症细胞,植骨骨块表面侵蚀反应减轻,比较平整。见图 1。
|
| A, control group; B, model group; C, OPG group. Blue arrows indicate the tissue air pouches, green arrows indicate the titanium particles, and red arrows indicate the implanted skull. 图 1 HE染色结果×20 Fig.1 HE staining ×20 |
2.2 TRAP染色
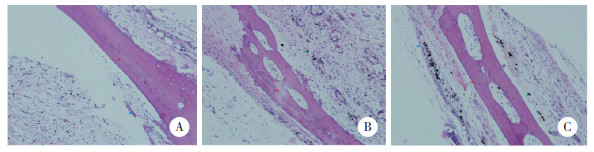
对照组见少量的TRAP染色阳性细胞,染色较浅,阳性染色面积小;模型组TRAP染色阳性细胞数较多,阳性染色面较大,而且染色深;OPG组TRAP染色阳性细胞数与模型组相比较少。见图 2、表 1。
|
| A, control group; B, model group, C, OPG group. Red arrows indicate the osteoclast area. 图 2 TRAP染色结果×20 Fig.2 TRAP staining ×20 |
| Item | Control group(n = 15) | Model group(n = 15) | OPG group(n = 15) | F | P |
| Number of TRAP staining positive cells | 6.16±1.92 | 35.00±3.61 | 14.37±3.64 | 48.830 | < 0.001 |
| IL-6(mg/g of tissue) | 137.58±18.20 | 330.00±20.82 | 217.74±14.73 | 62.683 | < 0.001 |
| TNF-α(mg/g of tissue) | 137.58±18.20 | 330.00±20.82 | 75.21±12.91 | 39.673 | < 0.001 |
| RANKL | 1.00±0.05 | 2.22±0.14 | 1.35±0.12 | 30.720 | < 0.001 |
| RANK | 1.00±0.56 | 3.72±0.28 | 1.38±0.12 | 49.722 | < 0.001 |
| OPG | 1.05±0.94 | 0.93±0.12 | 1.13±0.10 | 18.632 | < 0.001 |
2.3 ELISA检测小鼠气囊组织中IL-6、TNF-α水平
与对照组比较,模型组和OPG组小鼠气囊植骨中IL-6、TNF-α水平均升高,差异有统计学意义(P < 0.05);与模型组比较,OPG组小鼠颅骨骨膜中IL-6、TNF-α水平降低,差异有统计学意义(P < 0.05)。见表 1。
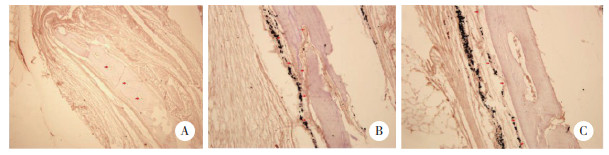
2.4 免疫组织化学染色检测小鼠气囊组织中RANKL、RANK、OPG表达与对照组比较,模型组和OPG组小鼠气囊植骨组织中RANKL、RANK表达增加,而OPG表达减少,差异有统计学意义(P < 0.05)。与模型组比较,OPG组小鼠气囊植骨组织RANKL、RANK表达减少,而OPG表达增加,差异有统计学意义(P < 0.05)。见表 1、图 3。
|
| Blue arrows indicate the positive expression area. 图 3 3组RANKL、RANK、OPG免疫组化结果×20 Fig.3 Immunohistochemistry results for RANKL, RANK, and OPG in the three groups ×20 |
3 讨论
骨性关节炎是一种包含关节软骨损害、软骨愈合不充分、关节结构进行性恶化等特点的退行性疾病,关节超负荷和生物力学改变等多种因素引起的关节软骨溃疡、皲裂、纤维化,常会导致关节出现肿胀、疼痛、活动受限等表现,发展至终末期还会造成患者关节畸形、功能受限,给患者带来极大的痛苦[6]。由于目前缺乏早期诊断方法,临床诊治时多处于疾病的中晚期,治疗方法多以手术为主,而在多种手术方法中,人工关节置换术是发展时间最长、技术最为成熟的治疗方法[7]。但是人工关节假体植入体内后,假体表面与关节磨损会产生磨损颗粒,刺激骨-假体的界膜组织中的巨噬细胞释放大量溶骨性炎性细胞因子,激活破骨细胞活化,诱导骨溶解而导致无菌性松动,这是制约人工关节置换术发展的重要并发症[8]。随着分子生物学的发展,以信号通路为靶点的研究逐渐成为解决假体无菌性松动的突破口,在以骨代谢失衡为主的溶骨性改变过程中,RANKL/RANK/OPG信号通路被证实起重要的调控作用。
RANK是从小鼠类巨噬细胞的破骨细胞前体细胞中复制出的破骨细胞分化因子受体,属于Ⅰ型三聚化的跨膜蛋白,在破骨细胞的前体细胞、成熟破骨细胞、软骨细胞等中起重要作用[9]。RANKL属于TNF-α超家族成员Ⅱ型跨膜蛋白,其mRNA在骨骼和淋巴组织中均可以检测到,在骨小梁、骨髓、骨髓基质细胞和成骨细胞中高表达[10]。RANK的胞内区域包含多个受体相关因子结合区域,可与肿瘤坏死相关因子(TNF receptor-associated factor,TRAF)家族中的TRAF-1、TRAF-3、TRAF-6及白细胞介素(interleukin,IL)家族中的IL-1、IL-6、IL-15等结合,这是激活JNK、Wnt等骨性关节炎相关信号通路活性的关键步骤[11]。OPG同属于TNF-α超家族成员,是一种分泌型糖蛋白,主要以单体形式由成骨细胞和骨髓基质细胞分泌产生[12]。OPG是RANKL竞争性抑制因子,可与破骨细胞前体细胞和成熟破骨细胞表面的RANK竞争性结合,以阻断RANKL与RANK结合,从而拮抗RANKL的促破骨细胞分化功能,诱导破骨细胞凋亡,抑制骨吸收[13]。
本研究选用钛颗粒刺激小鼠气囊植骨构建磨损颗粒诱导骨溶解动物模型,病理形态学和TRAP染色结果显示,模型组破骨细胞生成增加,骨吸收反应增强,与对照组相比差异显著。OGP组在将外源性OPG作用于磨损颗粒诱导小鼠气囊植骨模型后,磨损颗粒诱导的骨溶解明显减轻,说明OPG可能有效抑制颗粒诱导的破骨细胞生成作用。免疫组化结果显示,OPG在对照组有一定的表达,钛颗粒刺激诱导骨溶解的模型组OPG表达量明显减少,说明OPG和RANKL竞争性与RANK结合的作用减弱,使得RANKL与更多的RANK结合,增加磨损颗粒周围组织中破骨细胞前体活化和分化,向破骨细胞转化,出现骨溶解。加入外源性OPG的OPG组中OPG表达显著增加,而RANKL表达减少,说明在OPG与RANK结合作用增强的同时,RANKL与RANK结合作用减弱,也促使破骨细胞的转化生成减少,相应的骨溶解作用减弱,对预防无菌性骨溶解有重要的促进作用。
磨损颗粒刺激巨噬细胞释放大量的炎症介质和细胞因子(如TNF-α、IL-6等),这些炎症介质与细胞因子在信号通路的调控下被激活,作用于破骨细胞前体,使其分化和增殖,转化为成熟的破骨细胞,诱导骨溶解[14]。本研究中,模型组中IL-6、TNF-α表达水平升高,说明炎症反应增强,而加入外源性OPG的OPG组中IL-6、TNF-α表达水平降低,说明OPG和RANKL竞争性与RANK结合作用增强后,RANKL与RANK结合作用减弱。RANKL是调节骨吸收、骨溶解的关键因子,与前体破骨细胞膜上的RANK受体结合减弱会降低破骨细胞活性,破骨细胞骨溶解作用减弱。加入外源性OPG除了抑制破骨细胞的溶骨作用,也相应降低了IL-6、TNF-α等炎症介质和细胞因子的活性,减轻了炎症反应。
骨代谢平衡是一个很复杂的过程,RANK/RANKL/OPG是体内维持骨代谢平衡的重要信号通路,王瑞灯等[15]通过研究OPG对肿瘤骨转移的作用机制,发现IL-11、TNF-α等会通过成骨细胞和基质细胞上调RANKL,抑制OPG参与溶骨性病变,同时骨微环境中释放大量趋化因子如胰岛素样生长因子、基质细胞衍生因子-1等,使骨细胞和软骨细胞分化异常,处于病理状态。PHILIPPOU等[16]的机械应力对骨骼生长影响的研究中,让研究对象进行适当离心运动,6 h后发现血液中OPG水平升高,而RANKL水平降低,得出中等强度的运动能够预防骨质疏松症,而这种生理变化主要是通过RANK/RANKL/OPG信号通路实现的。OPG/RANKL比值的升高有助于骨细胞的成骨化,可以有效预防骨质疏松症的发生。最新的研究[17]还表明,骨细胞自身分泌的β干扰素是破骨细胞生成的负调节因子,能够抑制破骨细胞的形成,侧面证实了OPG对预防骨溶解的发生起至关重要的作用。
综上所述,加入外源性OPG作用于磨损颗粒诱导的骨溶解后,可能使RANKL/RANK/OPG信号通路对破骨细胞骨溶解作用下调,本研究结果为假体周围骨溶解的防治提供一种可能的理论依据,为延缓和阻止假体周围无菌性松动寻找可靠的靶点。
| [1] |
MATHARU GS, MOUCHTI S, TWIGG S, et al. The effect of smoking on outcomes following primary total hip and knee arthroplasty:a population-based cohort study of 117, 024 patients[J]. Acta Orthop, 2019, 90(6): 559-567. DOI:10.1080/17453674.2019.1649510 |
| [2] |
张晨, 李燕, 郭凤英, 等. 磨损颗粒刺激小鼠air pouch气囊建立骨溶解动物模型的实验研究[J]. 宁夏医学杂志, 2019, 41(7): 577-580. DOI:10.13621/j.1001-5949.2019.07.0577 |
| [3] |
NIARAKIS A, GIANNOPOULOU E, SYGGELOS SA, et al. Effects of proteasome inhibitors on cytokines, metalloproteinases and their inhibitors and collagen type-Ⅰ expression in periprosthetic tissues and fibroblasts from loose arthroplasty endoprostheses[J]. Connect Tissue Res, 2019, 60(6): 555-570. DOI:10.1080/03008207.2019.1601186 |
| [4] |
MOON YW, KIM JG, HAN JH, et al. Factors correlated with the reducibility of varus deformity in knee osteoarthritis:an analysis using navigation guided TKA[J]. Clin Orthop Surg, 2013, 5(1): 36. DOI:10.4055/cios.2013.5.1.36 |
| [5] |
贺志强, 杨亚帆, 陈先州, 等. RANKL/RANK/OPG信号通路参与调控磷酸三钙磨损颗粒诱导假体周围骨溶解的研究[J]. 实用骨科杂志, 2019, 25(11): 991-995. DOI:10.13795/j.cnki.sgkz.2019.11.008 |
| [6] |
QIN S, ZHANG Q, ZHANG L. Effect of OPG gene mutation on protein expression and biological activity in osteoporosis[J]. Exp Ther Med, 2017, 14(2): 1475-1480. DOI:10.3892/etm.2017.4712 |
| [7] |
KOH RH, JIN Y, KIM J, et al. Inflammation-modulating hydrogels for osteoarthritis cartilage tissue engineering[J]. Cells, 2020, 9(2): 419. DOI:10.3390/cells9020419 |
| [8] |
中华医学会骨科学分会关节外科学组. 骨关节炎诊疗指南(2018年版)[J]. 中华骨科杂志, 2018, 38(12): 705-715. DOI:10.3760/cma.j.issn.0253-2352.2018.12.00 |
| [9] |
ZHOU F, MEI J, HAN X, et al. Kinsenoside attenuates osteoarthritis by repolarizing macrophages through inactivating NF-κB/MAPK signaling and protecting chondrocytes[J]. Acta Pharm Sin B, 2019, 9(5): 973-985. DOI:10.1016/j.apsb.2019.01.015 |
| [10] |
陈德胜, 张先龙. RANK、RANKL与人工关节磨损颗粒诱导骨溶解[J]. 国际骨科学杂志, 2012, 33(6): 398-400. |
| [11] |
LIAO L, LIN Y, LIU Q, et al. Cepharanthine ameliorates titanium particle-induced osteolysis by inhibiting osteoclastogenesis and modulating OPG/RANKL ratio in a murine model[J]. Biochem Biophys Res Commun, 2019, 517(3): 407-412. DOI:10.1016/j.bbrc.2019.07.115 |
| [12] |
TRIPATHI A, PANDEY S, SINGH SV, et al. Bisphosphonate therapy for skeletal malignancies and metastases:impact on jaw bones and prosthodontic concerns[J]. J Prosthodont, 2011, 20(7): 601-603. DOI:10.1111/j.1532-849x.2011.00738.x |
| [13] |
LIU H, DONG Y, GAO Y, et al. Hesperetin suppresses RANKL-induced osteoclastogenesis and ameliorates lipopolysaccharide-induced bone loss[J]. J Cell Physiol, 2019, 234(7): 11009-11022. DOI:10.1002/jcp.27924 |
| [14] |
SAKURAI Y, FUJITA M, KAWASAKI S, et al. Contribution of synovial macrophages to rat advanced osteoarthritis pain resistant to cyclooxygenase inhibitors[J]. Pain, 2019, 160(4): 895-907. DOI:10.1097/j.pain.0000000000001466 |
| [15] |
王瑞灯, 贾璞, 唐海. 核因子κβ受体活化因子/核因子κβ受体活化因子配体/骨保护素信号通路在乳腺癌骨转移机制中的研究进展[J]. 中华实验外科杂志, 2019, 36(5): 982-986. DOI:10.3760/cma.j.issn.1001-9030.2019.05.068 |
| [16] |
PHILIPPOU A, BOGDANIS G, MARIDAKI M, et al. Systemic cytokine response following exercise-induced muscle damage in humans[J]. Clin Chem Lab Med, 2009, 47(6): 777-782. DOI:10.1515/CCLM.2009.163 |
| [17] |
HAYASHIDA C, ITO J, NAKAYACHI M, et al. Osteocytes produce interferon-β as a negative regulator of osteoclastogenesis[J]. J Biol Chem, 2014, 289(16): 11545-11555. DOI:10.1074/jbc.M113.523811 |
 2021, Vol. 50
2021, Vol. 50