文章信息
- 聂涵, 周晓煦, 赵越, 田文
- NIE Han, ZHOU Xiaoxu, ZHAO Yue, TIAN Wen
- 泛素特异性蛋白酶22通过调控雌激素受体α的转录活性抑制磷诱导的人动脉平滑肌细胞钙化
- Ubiquitin-specific peptidase 22 inhibits phosphorus-induced human aortic smooth muscle cells calcification via modulating transactivation of the estrogen receptor
- 中国医科大学学报, 2021, 50(10): 930-934, 939
- Journal of China Medical University, 2021, 50(10): 930-934, 939
-
文章历史
- 收稿日期:2020-04-27
- 网络出版时间:2021-09-29 19:32
2. 中国医科大学基础医学院细胞生物学教研室, 沈阳 110122
2. Department of Cell Biology, Basic Medicine College, China Medical University, Shenyang 110122, China
血管钙化指钙盐病理性地沉积在血管组织中,其普遍存在于衰老、糖尿病和慢性肾病的病理过程。血管钙化被认为是一个复杂并受高度调控的主动过程[1],血管平滑肌细胞的表型转化是关键环节,即从收缩表型转分化为类成骨细胞表型,收缩表型特异性基因下调(例如平滑肌α-肌动蛋白),同时骨形成标志物上调,包括Runt相关转录因子(runt-related transcription factor 2,Runx2)和碱性磷酸酶[2]。绝经前女性血管钙化发病率极低,绝经后雌激素替代治疗能显著减少血管钙化的发生[3]。雌激素通过雌激素受体(estrogen receptor,ER)依赖的方式抑制人血管平滑肌细胞中的骨形成信号传导通路,从而减轻血管钙化[4]。
泛素特异性蛋白酶22(ubiquitin specific peptidase 22,USP22)可使组蛋白去泛素化,从而增强其稳定性,进而导致相关基因的转录增加。前期研究[5]发现,USP22是核受体转录激活的重要辅调节因子。提示USP22可能作为ER的辅调节因子参与转录调控,并参与血管钙化的相关过程。本研究将人动脉平滑肌细胞(human aortic smooth muscle cells,HASMCs)钙化模型作为载体,证实USP22与ERα之间的相互作用,并探讨其对血管钙化进程的影响。
1 材料与方法 1.1 实验材料HASMCs购自湖南湘雅细胞库。高糖DMEM(Dulbecco’s modified eagle medium)培养基粉末(美国Gibco公司);胎牛血清(德国SeraPro公司);β-磷酸甘油粉末、茜素红染液;雌二醇(美国Sigma-Aldrich公司);LipofectamineTM 3000 Transfection reagent、jetPRIME transfection reagent(美国Polyplus公司);质粒提取及纯化试剂盒(美国OMEGA bio-tek公司);双荧光素酶基因检测试剂盒(美国Promega公司,Dual-Luciferase Reporter Assay System,E1960);蛋白酶抑制剂(瑞士Roche公司);BCA蛋白浓度检测试剂盒(中国凯基生物)。抗体:Runx2(美国Sigma-Aldrich公司),USP22(美国Proteintech公司),β-actin、抗鼠二抗、抗兔二抗(美国Santa Cruz公司),ERα(美国Abclone公司)。
1.2 方法 1.2.1 钙含量比色试验将HASMCs接种于培养皿内,24 h后更换诱导钙化DMEM培养基(含5 nmol磷酸甘油),分别培养0、3、5和7 d,每隔2 d更换1次培养基。加入0.6 mol/L盐酸2 mL,于37 ℃孵育24 h。吸取上清,并用钙含量比色检测试剂盒检测钙离子浓度。脱钙后的细胞用2 mL PBS冲洗3次,加入1 mL 0.1 mol/L NaOH,1 g/L SDS裂解细胞30 min,提取上清液,12 000 r/min离心30 min,再提取上清液,并用BCA蛋白浓度测定试剂盒检测蛋白含量。钙离子浓度/蛋白含量即标准化后的细胞钙含量,以此表示细胞钙化程度。
1.2.2 茜素红染色将HASMCs接种于培养皿内,24 h后更换诱导钙化DMEM培养基,分别培养0、3、5和7 d,每隔2 d更换1次培养基。4% 多聚甲醛固定15 min,PBS清洗细胞1~2次。2% 茜素红染料染色5 min,PBS洗掉多余的染料。
1.2.3 Western blotting样品蛋白浓度用BCA法测定,之后加入6×loading buffer混匀,100 ℃煮沸5 min。以20 μg样品蛋白/孔上样,进行电泳及转膜,之后用5%脱脂奶粉室温封闭1 h,参照抗体说明书要求配置一抗并孵育。TBST洗涤3次,10 min,二抗稀释比例为1∶5 000,室温孵育2 h,TBST洗涤3×10 min。滴加ECL工作液,曝光及扫描。以β-actin为内参,Image J软件进行图像分析。
1.2.4 免疫共沉淀(co-immunoprecipitation,co-IP)从蛋白上清液中取40 μL作为input组,余下蛋白上清进行co-IP(IP组)。将适量的protein A/G agarose beads(琼脂糖珠)加至上清液中,进行preclear,10 r/min,4 ℃,离心1.5 h,弃去beads,将上清转移至新EP管中。IP组:IgG组加入0.1 μL IgG,正常对照组和实验组加入适量的IP抗体(与IgG是相同种属),10 r/min,4 ℃,离心12~16 h。IP组加入适量新Protein A/G agarose beads,10 r/min,4 ℃,离心4 h,使beads与抗体、抗原形成复合物,弃去上清,每管加入1 mL TNE溶液,10 r/min,4 ℃,离心15 min,接着1 500 r/min,4 ℃,离心3 min,弃掉上清,重复上述步骤3次,最后一次离心完将上清弃净,留取沉淀,即beads-抗原-抗体复合物。将input组和IP组配成样品,并进行Western blotting。
1.2.5 双荧光素酶报告基因试验将HASMCs接种于24孔板,当细胞生长至密度80%时进行转染,使用jetPRIME transfection reagent(Polyplus),每孔加入质粒(ERα 0.05 μg,ERE-luci 0.25 μg,PRL 5 ng,PC/USP22 0.25 μg),4 h后更换为DMEM培养基,并加入雌激素,终浓度为10-7。24 h后再次加入雌激素,2 h后弃去培养基,并用PBS清洗2次,之后每孔加入80 μL lysis buffer(5× lysis buffer用PBS稀释为1×),水平摇床20 min。每孔吸取30 μL蛋白裂解液,先后加入15 μL luci buffer,15 μL stop buffer,并用双报告检测仪测量荧光度值,记录数据。每个分组均设置3个副孔。
1.3 统计学分析采用SPSS 17.0软件进行统计分析。计量资料以x±s表示。多组间比较采用方差分析,多组间两两比较采用q检验。所有的P值均为双侧,P < 0.05为差异有统计学意义。
2 结果 2.1 HASMCs钙化模型建立及检测将HASMCs接种24 h之后,更换诱导钙化的DMEM培养基分别培养0、3、5和7 d,每隔2 d换1次培养基。随着钙化培养基处理时间的延长,茜素红染色逐渐加深(图 1A),HASMCs钙化程度加重;钙含量比色试验结果显示钙离子含量也逐渐增多,培养0、3、5和7 d的HASMCs钙离子浓度/蛋白含量分别为0.01±0.001、0.03±0.003、0.06±0.001和0.13±0.020。(P < 0.05,图 1B),在Western blotting中,钙化的标志蛋白Runx2的表达量上升,同时USP22的蛋白表达量也逐渐增加(图 1C)。上述结果表明高磷条件成功诱导HASMCs钙化,并且在钙化过程中,USP22的表达量有所增加。
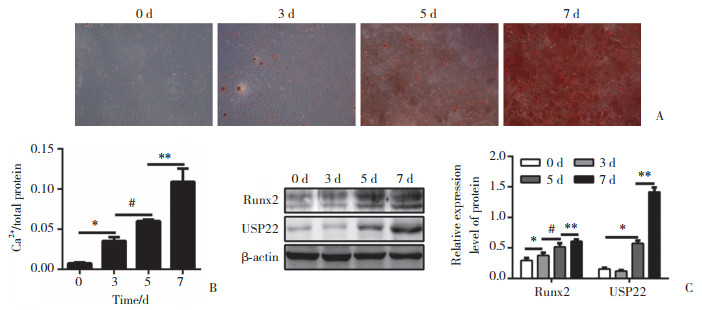
|
| A, alizarin red staining of HASMCs treated with high P for 0, 3, 5, and 7 days; B, quantification of calcification in HASMCs at sequential time points after high P treatment; C, Western blotting for identification of Runx2 and USP22 expression. *P < 0.05 compared with 0 d; # P < 0.05 compared with 3 d; ** P < 0.05 compared with 5 d. 图 1 高磷诱导HASMCs钙化的检测 Fig.1 Determination of calcification induced by high P in HASMCs |
2.2 USP22对ERα的转录调控及相互作用
co-IP试验证实USP22确实在蛋白水平与ERα之间存在相互作用(图 2)。由双荧光素酶报告试验结果可知,无论雌激素是否存在,USP22均可以抑制ERα的转录活性,对照组、雌激素处理组、USP22过表达组及USP22过表达+雌激素刺激组的HASMCs的荧光素酶相对活性分别为0.26±0.02、0.50±0.02、0.12±0.01和0.24±0.01(图 3)。结果显示,USP22可以通过与ERα结合的方式进而抑制其转录调控活性。
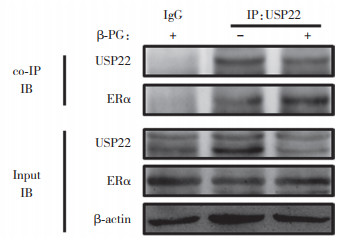
|
| 图 2 co-IP技术检测USP22与ERα之间的相互作用 Fig.2 co-immunoprecipitation was used to detect the interaction between USP22 and ERα |

|
| A, transcriptional activity of ERα is inhibited by USP22, regardless of treatment with estrogen; B, transfection efficiency of USP22 was determined by Western blotting. * P < 0.05 compared with the control group; # P < 0.05 compared with HASMCs treated with estrogen. 图 3 双荧光素酶报告试验检测USP22对于ERα转录活性的影响 Fig.3 Effect of USP22 on the transcriptional activity of ERα was determined by dual-luciferase assay |
2.3 USP22对人动脉平滑肌血管钙化的影响
应用flag标签质粒与siRNA分别过表达/沉默USP22,并用Western blotting检测转染效率和。当USP22过表达时,HASMCs钙离子含量增多,对照组、雌激素刺激组、USP22过表达组及USP22过表达+雌激素刺激组的HASMCs的钙相对量分别为0.05±0.010、0.03±0.005、0.08±0.006和0.06±0.002;并且Runx2的蛋白表达量有所增加,对照组、雌激素刺激组、USP22过表达组及USP22过表达+雌激素刺激组的HASMCs的Runx2蛋白表达的相对量分别为0.18±0.02、0.06±0.01、0.28±0.03和0.15±0.02;当USP22沉默时,钙离子含量减少,对照组、雌激素刺激组、USP22沉默组及USP22沉默+雌激素刺激组的HASMCs的钙相对量分别为0.08±0.002、0.04±0.001、0.06±0.003和0.02±0.002,并且Runx2的蛋白表达量也有所降低,对照组、雌激素刺激组、USP22沉默组及USP22沉默+雌激素刺激组的HASMCs的Runx2蛋白表达的相对量分别为0.71±0.02、0.73±0.02、0.51±0.02和0.26±0.03。上述结果表明,USP22可以促进钙化相关进程。见图 4、5。
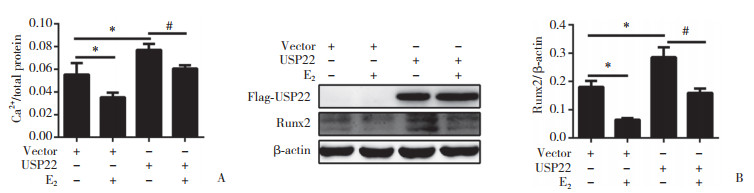
|
| A, quantification of calcification; B, Western blotting. * P < 0.05 compared with control group; # P < 0.05 compared with HASMCs treated with USP22 overexpression. 图 4 过表达USP22对HASMCs钙化的影响 Fig.4 Effect of USP22 overexpression on calcification of HASMCs |
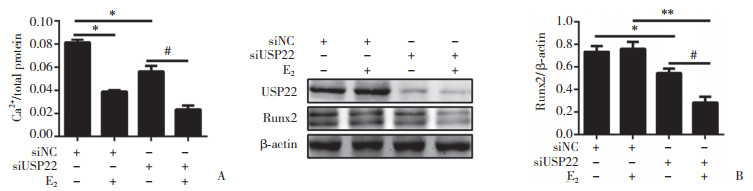
|
| A, quantification of calcification; B, Western blotting. * P < 0.05 compared with the control group; # P < 0.05 compared with HASMCs treated with USP22 knockdown; **P < 0.05 compared with HASMCs treated with estrogen. 图 5 沉默USP22对人动脉平滑肌细胞钙化的影响 Fig.5 Effect of knock down of USP22 and E2 treatment on calcification of HASMCs |
3 讨论
本研究发现USP22能通过结合ERα,抑制ERα的转录调控活性并促进人动脉平滑肌细胞的钙化,为阐明钙化机制提供了新的观点。
绝经后心血管疾病发病率的增加与雌激素水平降低有关,提示内源性雌激素对血管有益[6]。流行病学研究[7]发现绝经后妇女主动脉钙化与骨密度降低相关,提示雌激素和血管钙化相关。此外,雌激素能够抑制血管钙化,从正常育龄母猪分离出的主动脉平滑肌细胞与从切除卵巢的猪分离出的平滑肌细胞相比更能对抗钙化环境[8]。
研究证明,血清磷酸盐水平的升高与血管钙化相关[9],并且会增加心血管事件和死亡的风险[10]。磷酸盐浓度升高会通过一个复杂且高度受控的过程触发血管钙化,该过程的关键步骤是血管平滑肌细胞向成骨表型转分化。不同细胞内信号传导级联反应的复杂相互作用精确地控制了磷酸盐诱导的血管平滑肌细胞成骨性转分化[11]。本研究选择用高磷条件刺激平滑肌细胞来建立体外钙化模型,在钙化的过程中USP22的蛋白表达量呈上升趋势,提示USP22可能参与了HASMCs的钙化过程。
USP22是去泛素化酶中最大的亚家族,属于泛素特异性加工蛋白酶。USP22高度保守,在人体组织中广泛表达。但关于USP22在血管钙化中的作用知之甚少。已经有实验证实雄激素受体可以作为USP22的非组蛋白底物,本研究探究了USP22与ER之间的关系。由于平滑肌细胞中ERα占优势,因此选择了ERα来代表雌激素受体在平滑肌细胞中的作用。Co-IP试验的结果显示,USP22与ERα存在相互作用。双荧光素酶报告实验结果显示,USP22可以抑制ERα的转录调控活性。考虑到雌激素/ERα对于血管钙化的密切关系,以及USP22对于ERα的转录调控作用,本研究试图观察USP22表达量的改变对血管平滑肌钙化的影响。通过转染USP22质粒来过表达USP22,或通过转染siRNA来沉默USP22,钙含量比色试验结果发现平滑肌细胞的钙化程度相应加重(过表达USP22)或有所减轻(沉默USP22)。并且,作为钙化标志物的Runx2表达量在USP22过表达时蛋白含量升高,而当USP22被沉默时,Runx2的蛋白含量减少。均说明USP22可以促进高磷诱导的人动脉平滑肌钙化过程。
综上所述,本研究推测USP22可能是雌激素/ERα在血管钙化发展中的重要调节因子,并通过与ERα结合的方式抑制其转录调控活性,进而促进钙化相关进程。以往报道USP22会导致多种癌症的不良结局,USP22靶向抑制剂联合雌激素替代治疗可能会减少单独使用雌激素替代治疗导致肿瘤等不良反应。本研究仅为细胞研究,上述现象及机制尚需进一步在动物模型中验证。
| [1] |
BOSTRÖM KI, RAJAMANNAN NM, TOWLER DA. The regulation of valvular and vascular sclerosis by osteogenic morphogens[J]. Circ Res, 2011, 109(5): 564-577. DOI:10.1161/circresaha.110.234278 |
| [2] |
LAU WL, PAI A, MOE SM, et al. Direct effects of phosphate on vascular cell function[J]. Adv Chronic Kidney Dis, 2011, 18(2): 105-112. DOI:10.1053/j.ackd.2010.12.002 |
| [3] |
MANSON JE, ALLISON MA, ROSSOUW JE, et al. Estrogen therapy and coronary-artery calcification[J]. N Engl J Med, 2007, 356: 2591-2602. DOI:10.1056/NEJMoa071513 |
| [4] |
OSAKO MK, NAKAGAMI H, KOIBUCHI N, et al. Estrogen inhibits vascular calcification via vascular RANKL system: common mechanism of osteoporosis and vascular calcification[J]. Circ Res, 2010, 107(4): 466-475. DOI:10.1161/CIRCRESAHA.110.216846 |
| [5] |
ZHAO Y, LANG G, ITO S, et al. A TFTC/STAGA module mediates histone H2A and H2B deubiquitination, coactivates nuclear receptors, and counteracts heterochromatin silencing[J]. Mol Cell, 2008, 29(1): 92-101. DOI:10.1016/j.molcel.2007.12.011 |
| [6] |
RESLAN OM, KHALIL RA. Vascular effects of estrogenic menopausal hormone therapy[J]. Rev Recent Clin Trials, 2012, 7(1): 47-70. DOI:10.2174/157488712799363253 |
| [7] |
KIEL DP, KAUPPILA LI, CUPPLES LA, et al. Bone loss and the progression of abdominal aortic calcification over a 25 year period: the Framingham heart study[J]. Calcif Tissue Int, 2001, 68(5): 271-276. DOI:10.1007/bf02390833 |
| [8] |
RZEWUSKA-LECH E, JAYACHANDRAN M, FITZPATRICK LA, et al. Differential effects of 17β-estradiol and raloxifene on VSMC phenotype and expression of osteoblast-associated proteins[J]. Am J Physiol Endocrinol Metab, 2005, 289(1): E105-E112. DOI:10.1152/ajpendo.00366.2004 |
| [9] |
CANCELA AL, SANTOS RD, TITAN SM, et al. Phosphorus is associated with coronary artery disease in patients with preserved renal function[J]. PLoS One, 2012, 7(5): e36883. DOI:10.1371/journal.pone.0036883 |
| [10] |
TONELLI M, SACKS F, PFEFFER M, et al. Relation between serum phosphate level and cardiovascular event rate in people with coronary disease[J]. Circulation, 2005, 112(17): 2627-2633. DOI:10.1161/circulationaha.105.553198 |
| [11] |
VOELKL J, LANG F, ECKARDT KU, et al. Signaling pathways involved in vascular smooth muscle cell calcification during hyperphosphatemia[J]. Cell Mol Life Sci, 2019, 307: 2077-2091. DOI:10.1007/s00018-019-03054-z |
 2021, Vol. 50
2021, Vol. 50




