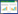文章信息
- 王成祥, 刘玉霞, 常绍鸿, 邢二庆, 谢遂亮
- WANG Chengxiang, LIU Yuxia, CHANG Shaohong, XING Erqing, XIE Suiliang
- 马齿苋多糖对幼年糖尿病大鼠糖脂代谢、肾功能的影响及其作用机制
- Effect and mechanism of action of Portulaca oleracea L. polysaccharides on glycolipid metabolism and renal function in juvenile diabetic rats
- 中国医科大学学报, 2021, 50(1): 46-50, 56
- Journal of China Medical University, 2021, 50(1): 46-50, 56
-
文章历史
- 收稿日期:2020-06-15
- 网络出版时间:2020-12-22 8:59
2. 新乡医学院第四临床学院儿科, 河南 新乡 453000
2. Department of Pediatrics, The Fouth Affiliated Hospital of Xinxiang Medical University, Xinxiang 453000, China
近年来,儿童糖尿病患病人数逐年上升[1]。儿童患者多为1型糖尿病,由于儿童生长发育过程中食物消耗及运动量变化大,1型糖尿病患儿血糖较难控制,且由于发病早、病程长,后期多出现并发症,严重危害患者的生命健康[1]。糖尿病肾病是糖尿病患者死亡主要原因之一,也是终末期肾病的主要病因,如何保护糖尿病患者肾脏功能亦是重要研究课题。已有研究发现,高糖环境能够刺激转化生长因子β1 (trasnforming growth factor β1,TGF-β1)大量分泌,TGF-β1与Smad-3蛋白结合刺激炎症细胞聚集,诱发结缔组织生长因子(connective tissue growth factor,CTGF)增加,促进糖尿病肾病进展[2];而抑制TGF-β1/Smad3信号通路能够保护肾功能[3]。
马齿苋是我国常见草本植物,具有清热解毒、止消渴、去肿消炎等作用,主治腹泻、疖痈、皮炎、丹毒、痢疾等疾病[4]。近年来研究发现,马齿苋具有降血糖、降血脂等效果。研究显示,服用马齿苋能够改善糖尿病患者的血糖水平[5];马齿苋多糖亦能够改善糖尿病大鼠的血糖水平[6]。但马齿苋对幼年糖尿病大鼠影响未见报道。本研究探讨马齿苋多糖对幼年糖尿病大鼠的糖脂代谢、肾功能的影响及其可能的作用机制,旨在为临床儿童糖尿病防治提供新的思路和研究基础。
1 材料与方法 1.1 实验动物及药品4周龄雄性SD大鼠63只,SPF级,体质量90~108 g,购自北京维通利华公司。链脲佐菌素(streptozotocin,STZ)购自美国Sigma公司,HE和PAS染色试剂盒购自北京索莱宝科技有限公司。TGF-β1、Smad3和CTGF多克隆兔抗购自英国Abcam公司;β-actin多克隆鼠抗、羊抗兔、羊抗鼠二抗购自中杉金桥有限公司;蛋白质定量试剂盒(Bradford法,P1510)购自北京普利莱基因技术有限公司;ECL化学发光液购自美国Millipore公司。
马齿苋多糖提取见文献[7],马齿苋全株洗净烘干后粉碎,分别使用石油醚脱脂和95%乙醇回流提取各2次,滤渣干燥后,加入20倍水70 ℃ 250 W超声30 min提取2次,提取液抽滤后置于75%乙醇24 h后过滤,洗涤干燥后得到马齿苋多糖,提取率约为6.5%。
1.2 动物分组及模型建立63只SD雄性大鼠,喂养7 d适应环境后,测量空腹血糖均为正常值。随机分为对照组(Con组,n = 20,正常饮食),另外43只大鼠高脂饮食4周后,后腹腔一次性注射STZ (60 mg/kg),72 h后测量大鼠尾静脉血糖,血糖 > 16. 7 mmol/L则表示2型糖尿病大鼠造模成功。3只血糖不达标大鼠淘汰。40只造模成功大鼠随机分为糖尿病模型组(Mod组)和马齿苋多糖组(PP组),每组20只。PP组采用马齿苋多糖[200 mg/ (kg· d)]灌胃,Mod组和Con组给予等体积生理盐水灌胃,连续干预6周。
1.3 糖脂代谢、肾功能指标测定3组大鼠分别在干预6周后剪尾取血,离心留取血清,采用全自动生化仪测甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)、尿素氮、肌酐、24 h尿蛋白。计算肾指数(kidney weight index,KWI),KWI (mg/g)=肾质量/体质量。血糖仪测定大鼠空腹血糖(fasting blood glucose,FBG)。
1.4 肾组织HE染色和PAS染色干预6周后处死3组大鼠,取肾,低温冰冻切片,晾干后先用二甲苯脱脂、苏木素液染色、盐酸乙醇分色、伊红染液染色,再放入梯度浓度乙醇溶液中脱水(100%、95%、85%、70%、50%乙醇各放置3 min),然后在蒸馏水中浸泡2 min透明,中性树胶封片,显微镜下观察HE染色结果。冰冻切片入蒸馏水浸洗,乙醇固定10 min,置入过碘酸溶液5 min,蒸馏水冲洗,干燥后放入雪夫染液30 min,蒸馏水冲洗后苏木精复染,清洗、透明、封片观察。
1.5 肾组织免疫组化干预6周后取肾组织,4%甲醛固定,梯度乙醇脱水,二甲苯脱脂,包埋切片,3%过氧水室温20 min孵育,蒸馏水冲洗3次,TGF-β1、Smad3和CTGF一抗室温孵育60 min,PBS漂洗3次后二抗室温孵育30 min,PBS漂洗3次,DAB染色(15 ℃,10 min),PBS漂洗3次,最后再经苏木素复染,树胶封片后观察。随机选取每只大鼠组织切片3张,每张随机抽取5个视野,用平均光密度值作为统计数值,采用Image J软件统计分析。
1.6 Western blotting检测大鼠干预6周后灌注固定取肾组织,放置于冰上研磨肾组织,加入蛋白裂解液,4 ℃离心30 min,根据试剂盒说明进行操作,采用Bradford法定量计算。取相同量的样品进行12%凝胶电泳(SDS-PAGE),转移到PVDF膜上,然后用5%脱脂奶粉过夜,封闭阻断抗体,TGF-β1、Smad3和CTGF多克隆兔抗和β-actin多克隆鼠抗采用0.5%BSA溶液稀释,室温下孵育2 h后TBST洗膜10 min,重复3次;羊抗兔、羊抗鼠二抗采用0.5%BSA溶液稀释,室温下孵育2 h后TBST洗膜15 min,重复3次,加入ECL试剂,凝胶成像仪观测。
1.7 统计学分析采用SPSS 18.0软件进行统计分析,计量数据以x±s表示,多组比较采用单因素方差分析,组间两两比较采用t检验,P (双侧) < 0.05为差异有统计学意义。
2 结果 2.1 3组大鼠血脂水平比较结果显示,与Con组比较,Mod组TG、TC和LDLC水平显著升高,差异有统计学意义(P < 0.01);与Mod组比较,PP组TG、TC和LDLC水平显著降低,差异有统计学意义(P < 0.01)。见表 1。
| Group | n | TG | TC | LDLC |
| Con | 20 | 0.50±0.04 | 1.76±0.09 | 0.97±0.12 |
| Mod | 20 | 1.48±0.241) | 2.95±0.181) | 2.17±0.321) |
| PP | 20 | 0.69±0.162) | 1.96±0.342) | 1.28±0.202) |
| 1) P < 0.01 vs Con group;2) P < 0.01 vs Mod group. TG,triglyceride;TC,total cholesterol;LDLC,low density lipoprotein cholesterol. | ||||
2.2 3组大鼠血糖和肾功能比较
结果显示,与Con组比较,Mod组FBG、KWI、尿素氮、肌酐和尿蛋白显著升高,差异有统计学意义(P < 0.01);与Mod组比较,PP组FBG、KWI、尿素氮、肌酐、尿蛋白显著降低,差异有统计学意义(P < 0.01)。见表 2。
| Group | FBG (mmol/L) | KWI (mg/g) | 24 h urine protein (mg/24 h) | Creatinine (μmol/L) | Blood urea nitrogen (mmol/L) |
| Con | 5.15±0.75 | 4.47±0.47 | 5.01±0.75 | 19.56±3.26 | 4.57±0.60 |
| Mod | 22.26±1.191) | 6.80±0.981) | 102.03±36.61) | 72.17±9.321) | 19.53±7.971) |
| PP | 10.30±2.252) | 6.03±0.772) | 35.53±8.242) | 25.93±2.062) | 11.33±0.712) |
| 1) P < 0.01 vs Con group;2) P < 0.01 vs Mod group. FBG,fasting blood glucose;KWI,kidney weight index. | |||||
2.3 3组大鼠HE染色及PAS染色结果
HE染色结果显示,Con组肾组织形态正常;Mod组系膜细胞增生,基底膜增厚,肾小管肿胀,管腔狭窄,间质可见大量渗出红细胞;PP组HE染色表现与Mod组相同,但肾组织受损程度明显减轻。见图 1。PAS染色主要为糖类着色,Con组PAS染色较淡,未见明显糖原沉积,而Mod组大量糖原在肾单位沉积,PP组PAS染色表现与Mod组相同,但肾组织受损程度明显减轻。见图 2。

|
| A, Con group; B, Mod group; C, PP group. 图 1 3组大鼠肾组织HE染色结果×400 Fig.1 HE staining results of renal tissue among three groups×400 |
|
| A, Con group; B, Mod group; C, PP group. 图 2 3组大鼠肾组织PAS染色结果×400 Fig.2 PAS staining results of renal tissue among three groups×400 |
2.4 3组大鼠免疫组化结果
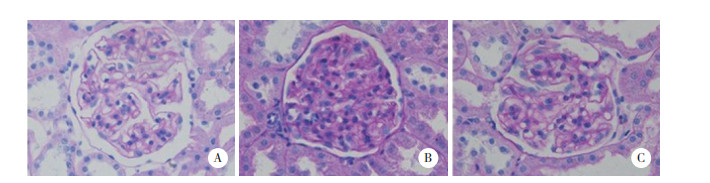
TGF-β1、Smad3和CTGF是TGF-β1/Smad通路的关键蛋白,主要在胞质表达,免疫组化显示为棕黄色。免疫组化结果显示,与Con组比较,Mod组肾组织TGF-β1、Smad3和CTGF阳性表达明显增高,差异具有统计学意义(P < 0.05)。与Mod组比较,PP组肾组织TGF-β1、Smad3和CTGF阳性表达明显下降,差异有统计学意义(P < 0.05)。见图 3、表 3。
|
| 图 3 各组大鼠肾组织TGF-β1、Smad3和CTGF阳性表达比较×400 Fig.3 The positive expressions of TGF-β1, Smad3 and CTGF in renal tissues of rats in each group ×400 |
| Group | Positive expression | Protein expression | ||||
| TGF-β1 | Smad3 | CTGF | TGF-β1 | Smad3 | CTGF | |
| Con | 1.00±0.03 | 1.00±0.05 | 1.00±0.07 | 1.00±0.04 | 1.00±0.06 | 1.00±0.05 |
| Mod | 2.51±0.36 | 3.94±0.47 | 2.84±0.32 | 2.36±0.231) | 2.03±0.311) | 1.97±0.281) |
| PP | 1.87±0.15 | 2.18±0.16 | 1.98±0.24 | 1.63±0.122) | 1.72±0.142) | 1.48±0.222) |
| 1) P < 0.05 vs Con group;2) P < 0.05 vs Mod group. | ||||||
2.5 3组大鼠肾脏组织TGF-β1、Smad3和CTGF蛋白表达比较
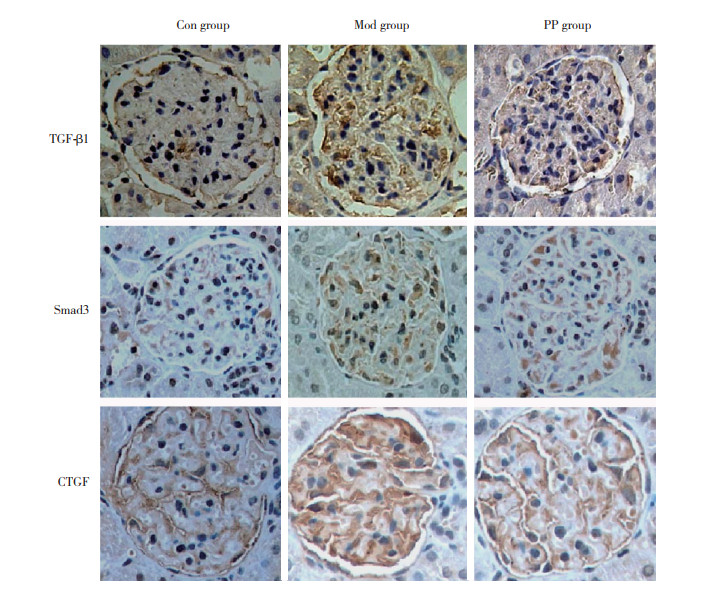
Western blotting结果显示,与Con组比较,Mod组、PP组TGF-β1、Smad3和CTGF表达明显增加,差异有统计学意义(P < 0.05)。与Mod组比较,PP组TGF-β1、Smad3和CTGF的表达明显降低,差异有统计学意义(P < 0.05)。见表 3、图 4。
|
| 1, Con group; 2, Mod group; 3, PP group. 图 4 3组大鼠肾组织TGF-β1、Smad3和CTGF蛋白表达 Fig.4 The protein expression of TGF-β1, Smad3 and CTGF in renal tissues of rats in three groups |
3 讨论
马齿苋多糖是马齿苋的主要有效成分,研究发现,马齿苋能够改善糖尿病血糖水平[8-9];能够通过NF-κB信号通路改善糖尿病肝功能损害[9]。马齿苋种子能够降低糖尿病患者血糖水平和血脂水平[10],改善动脉粥样硬化[5];亦能够降低血压[11]。马齿苋提取物能够改善肥胖[12]和高糖诱导的认知功能受损[13]。马齿苋提取物能够降低糖尿病患者血压和糖化血红蛋白水平[14]。本研究结果显示,马齿苋多糖能够降低幼年糖尿病大鼠血糖和血脂水平,与以往研究结果一致。幼年糖尿病大鼠PAS染色可见大量糖原沉积,胞外基质增多,KWI增高,提示肾脏肥大,而马齿笕多糖能够改善幼年糖尿病大鼠肾单位糖类沉积,改善系膜增生及肾脏肥大,降低肌酐、尿素氮、KWI、24 h尿蛋白水平,提示马齿苋多糖能够减轻幼年糖尿病导致肾功能损害,对肾功能有保护作用。
TGF-β1/Smad3信号通路在肾纤维化进程中起关键作用。TGF-β1是肾纤维化起始因子,在高糖环境下大量分泌激活后与Smad-3蛋白结合,刺激炎症细胞聚集,引起级联反应,促进下游CTGF大量分泌,导致肾小管上皮增生,肾脏纤维化进展,最终导致肾功能衰竭[15]。研究显示,早期糖尿病肾病发生发展与TGF-β1/Smad3信号通路上调密切相关[16],高糖环境能够诱导肾小球上皮细胞TGF-β1高表达[17],抑制该通路能够保护肾功能,延缓糖尿病肾病进展[3]。本研究结果显示,与Con组比较,Mod组TGF-β1、Smad3和CTGF蛋白表达明显增加(P < 0.05);而与Mod组比较,PP组能够显著降低TGF-β1、Smad3和CTGF蛋白表达(P < 0.05),提示马齿苋多糖可能通过TGF-β1/Smad3信号通路保护肾功能。
综上所述,马齿苋多糖能够改善幼年糖尿病大鼠的糖脂代谢,降低尿蛋白水平,并且对幼年糖尿病大鼠肾功能起保护作用,其机制可能与TGF-β1/Smad3信号通路有关。
| [1] |
YANG CC, LIN CH, WANG NK, et al. Risk factors associated with the development of nephropathy 10 years after diagnosis in Taiwanese children with juvenile-onset type 1 diabetes-a cohort study from the CGJDES[J]. Front Endocrinol (Lausanne), 2018, 9: 429. DOI:10.3389/fendo.2018.00429 |
| [2] |
KHAN S, JENA G. Sodium butyrate, a HDAC inhibitor ameliorates eNOS, iNOS and TGF-β1-induced fibrogenesis, apoptosis and DNA damage in the kidney of juvenile diabetic rats[J]. Food Chem Toxicol, 2014, 73: 127-139. DOI:10.1016/j.fct.2014.08.010 |
| [3] |
HSU YH, LI HH, SUNG JM, et al. Interleukin-20 targets podocytes and is upregulated in experimental murine diabetic nephropathy[J]. Exp Mol Med, 2017, 49(3): e310. DOI:10.1038/emm.2016.169 |
| [4] |
ZHENG GY, MO FF, LING C, et al. Portulaca oleracea L. alleviates liver injury in streptozotocin-induced diabetic mice[J]. Drug Des Dev Ther, 2017, 12: 47-55. DOI:10.2147/dddt.s121084 |
| [5] |
DEHGHAN F, SOORI R, GHOLAMI K, et al. Purslane (Portulaca oleracea) seed consumption and aerobic training improves biomarkers associated with atherosclerosis in women with type 2 diabetes (T2D)[J]. Sci Rep, 2016, 6: 37819. DOI:10.1038/srep37819 |
| [6] |
GONG FY, LI FL, ZHANG LL, et al. Hypoglycemic effects of crude polysaccharide from purslane[J]. Int J Mol Sci, 2009, 10(3): 880-888. DOI:10.3390/ijms10030880 |
| [7] |
高畅, 付玲玲, 张志. 马齿苋多糖的提取工艺优化[J]. 吉林农业, 2018(16): 52-53. DOI:10.14025/j.cnki.jlny.2018.16.024 |
| [8] |
BAI Y, ZANG XL, MA JS, et al. Anti-diabetic effect of Portulaca oleracea L. polysaccharideandits mechanism in diabetic rats[J]. Int J Mol Sci, 2016, 17(8): 1201. DOI:10.3390/ijms17081201 |
| [9] |
HEIDARZADEH S, FARZANEGI P, AZARBAYJANI MA, et al. Purslane Effect on GLP-1 and GLP-1 receptor in type 2 diabetes[J]. Electron Physician, 2013, 5(1): 582-587. DOI:10.14661/2013.582-587 |
| [10] |
EL-SAYED MIK. Effects of Portulaca oleracea L. seeds in treatment of type-2 diabetes mellitus patients as adjunctive and alternative therapy[J]. J Ethnopharmacol, 2011, 137(1): 643-651. DOI:10.1016/j.jep.2011.06.020 |
| [11] |
ESMAILLZADEH A, ZAKIZADEH E, FAGHIHIMANI E, et al. The effect of purslane seeds on glycemic status and lipid profiles of persons with type 2 diabetes:a randomized controlled cross-over clinical trial[J]. J Res Med Sci, 2015, 20(1): 47-53. |
| [12] |
ABDALLA HM. Purslane extract effects on obesity-induced diabetic rats fed a high-fat diet[J]. Malays J Nutr, 2010, 16(3): 419-429. |
| [13] |
FATEMI TABATABAEI SR, RASHNO M, GHADERI S, et al. The aqueous extract of Portulaca oleracea ameliorates neurobehavioral dysfunction and hyperglycemia related to streptozotocin-diabetes induced in ovariectomized rats[J]. Iran J Pharm Res, 2016, 15(2): 561-571. |
| [14] |
WAINSTEIN J, LANDAU Z, BAR DAYAN Y, et al. Purslane extract and glucose homeostasis in adults with type 2 diabetes:a double-blind, placebo-controlled clinical trial of efficacy and safety[J]. J Med Food, 2016, 19(2): 133-140. DOI:10.1089/jmf.2015.0090 |
| [15] |
ZHANG G, CUI G, TONG S, et al. Salvianolic acid A alleviates the renal damage in rats with chronic renal failure[J]. Acta Cir Bras, 2019, 34(2): e201900204. DOI:10.1590/s0102-8650201900204 |
| [16] |
PEZZOLESI MG, SATAKE E, MCDONNELL KP, et al. Circulating TGF-β1-regulated miRNAs and the risk of rapid progression to ESRD in type 1 diabetes[J]. Diabetes, 2015, 64(9): 3285-3293. DOI:10.2337/db15-0116 |
| [17] |
PARK SJ, JEONG JM, JEONG HS, et al. Effects of epigallocatechin-3-gallate on the expression of TGF-β1, PKC α/βⅡ, and NF-κB in high-glucose-stimulated glomerular epithelial cells[J]. Chonnam Med J, 2011, 47(2): 116. DOI:10.4068/cmj.2011.47.2.116 |
 2021, Vol. 50
2021, Vol. 50