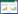文章信息
- 刘敏娟, 邓月秀, 马颖
- LIU Minjuan, DENG Yuexiu, Ma Ying
- miR-34a-5p靶向AKT1基因对子宫内膜异位症子宫内膜基质细胞侵袭及自噬的调控
- microRNA-34a-5p regulates invasion and autophagy of endometrial stromal cells in endometriosis by inhibiting AKT1
- 中国医科大学学报, 2020, 49(9): 776-782
- Journal of China Medical University, 2020, 49(9): 776-782
-
文章历史
- 收稿日期:2019-09-19
- 网络出版时间:2020-09-11 13:47
2. 东莞市人民医院妇产科, 广东 东莞 523000;
3. 桂林市妇幼保健院妇产科, 广西 桂林 541001
2. Department of Gynaecology and Obstetrics, Dongguan People's Hospital, Dongguan 523000, China;
3. Department of Gynaecology and Obstetrics, Maternal and Child Health Center in Guilin City, Guilin 541001, China
子宫内膜异位症(endometriosis, EM)是指子宫内膜出现在子宫腔外的组织并引起相应的症状, 最常见部位为卵巢表面及盆腔腹膜。EM组织学上虽是良性疾病, 却具有增生、浸润、转移及复发等恶性行为。EM好发于育龄期女性[1], 临床复发率高[2], 发病机制至今尚不明确[3]。
在恶性疾病的发生发展中, 细胞侵袭能力增强及自噬能力降低占据着重要的地位[4]。子宫内膜细胞类似肿瘤细胞的行为是EM病灶形成的关键[5]。微小RNA (microRNA, miRNA)是由约22个核糖核酸组成的非编码RNA, 能够与相应基因的mRNA结合, 从而阻断蛋白编码基因的表达[6], 对细胞具有重要的调控作用[7]。研究[8]发现, miRNA与EM的发病有关, 在EM和非EM患者子宫内膜组织中存在表达差异[9]。前期芯片测序发现, 在EM患者子宫内膜组织中miR-34a-5p低表达, 而miR-34a-5p与EM的关系鲜有报道, 因此, 本研究拟探讨miR-34a-5p在EM发病过程中是否存在调控作用。
1 材料与方法 1.1 材料子宫内膜来源于南方医科大学珠江医院妇产科因子宫肌瘤等良性疾病及因EM行子宫切除的女性患者。所有患者术前3个月内未使用过外源性激素。本研究经南方医科大学珠江医院伦理委员会批准。详细记录患者的信息并签署知情同意书。
1.2 方法 1.2.1 原代提取、分离及培养子宫内膜基质细胞(endometrial stromal cells, ESCs)和腺上皮细胞(endometrial epithelial cells, EECs)无菌操作剖开离体子宫, 刮取内膜组织, 行原代细胞提取及分离。用PBS漂洗内膜组织3次, 剪碎并加入3 mLⅠ型胶原酶(1 mg/mL, 美国Gibco公司) 37 ℃消化60 min, 每15 min搅拌1次。加入等量DMEM/F-12培养基(美国Gibco公司)终止消化, 混合细胞悬液经200目及400目不锈钢细胞滤网过滤, 获得子宫ESCs悬液, 将筛网反置另一皿上, DMEM/F-12培养基反洗筛网回收EECs。离心及PBS漂洗后, 分别接种于含10%胎牛血清和1%双抗的培养基, 37℃、5%CO2培养箱中培养。
1.2.2 细胞组织来源鉴定将ESCs和EECs接种于直径3 cm培养皿, 37 ℃、5%CO2培养至细胞满度达60%左右。加入0.3% Triton-100于37 ℃处理30 min, 以增加细胞膜通透性, 4%多聚甲醛固定30 min, 5%牛血清白蛋白室温封闭20 min。加入人波形蛋白和人角蛋白抗体, 4 ℃孵育过夜。0.3% Triton-100级PBS各洗涤2次, 加入对应二抗, 37 ℃孵育60 min。加入100 μL DAPI, 孵育15 min后冲洗, 甘油封片后置于共聚焦倒置荧光显微镜下观察。
1.2.3 细胞模型构建及分组用含有10%胎牛血清和1%双抗的DMEM/F-12培养基培养ESCs, 将生长状况良好且处于对数生长期的ESCs接种于6孔板(3×105/孔)。用脂质体-3000 (美国ThermoFisher公司)分别转染阴性对照(negative control, NC)及miR-34a-5p mimic至细胞, 培养24 h后进行后续实验。NC及miR-34a-5p mimic均由广州市锐博生物科技有限公司合成。
1.2.4 qRT-PCR检测miR-34a-5p和AKT1的表达收集各组ESCs细胞, 按照试剂盒(日本TaKaRa公司)说明书提取RNA, 逆转录为cDNA, 行PCR。内参为U6及β-actin。miR-34a-5p及AKT1引物序列由生工生物工程(上海)有限公司设计并合成。
1.2.5 Western blotting检测AKT1蛋白的表达加入含有PMSF的细胞裂解液(美国Bio-Rad公司), 于冰上裂解ESCs 30 min, 4 ℃、12 000 g离心5 min, 收集上清, 蛋白定量上样, 行10% SDS-PAGE电泳, 转移至PVDF膜, 5%脱脂奶粉封闭, 加入AKT1特异性抗体(1︰500稀释, 美国Proteintech公司), 4 ℃孵育过夜。加入二抗孵育1 h, TBST清洗, 显影。采用智能Chemi-TM分析系统(美国Thermo Scientific公司)完成反应。采用Quantity One软件进行定量分析, GAPDH为内参照。
1.2.6 双荧光素酶报告基因实验从Genbank下载AKT1基因3’UTR序列。突变型AKT1基因3’UTR序列由上海吉凯基因有限公司合成。用脂质体3000分别共转染NC及miR-34a-5p mimic、野生型AKT1-Fluc及突变型AKT1-Fluc。使用双荧光素酶检测试剂盒(美国Promega公司)检测细胞中荧光素酶反应强度(Promega GloMax发光检测仪), AKT1基因表达水平用相对荧光素酶活性(%)表示。本研究中所用的质粒由上海吉凯基因有限公司构建。
1.2.7 CCK-8细胞增殖实验将100 μL NC组及miR-34a-5p mimic组ESCs悬液(每孔3 000~5 000个细胞)接种于96孔板, 分别于接种后12、24、36及72 h加入CCK-8溶液, 并于酶标仪上检测细胞殖情况。
1.2.8 细胞迁移实验将NC组及miR-34a-5p mimic组ESCs细胞接种于6孔板(5×105/孔), 培养24 h, 细胞满度达90%以上时, 用微量加样器枪头垂直划痕, PBS洗涤3次, 加入基础培养基, 37 ℃、5%CO2培养箱中培养, 定时观察及记录细胞迁移情况。用Image J软件随机选取6~8条水平线, 计算细胞间距离的均值。
1.2.9 细胞侵袭实验在预先铺有基质胶的Transwell小室上室中, 加入200 μL NC组及miR-34a-5p mimic组ESCs细胞悬液, 下室加入600 μL含10%胎牛血清培养基, 培养24 h后, 中性甲醛固定, 1%结晶紫染色, 显微镜下观察计算2组穿过基质胶的细胞数。
1.2.10 细胞凋亡及细胞自噬按照凋亡试剂盒(北京康为世纪生物科技有限公司)说明书操作, 向NC组及miR-34a-5p mimic组ESCs细胞沉淀中加入Binding Buffer后, 将细胞悬液转移至5 mL流式管中, 避光加入5 μL Annexin Ⅴ/FITC和10 μL碘化丙啶, 室温孵育0.5 h后, 用流式细胞仪进行分析。用RT-PCR检测NC组及mimic组ESCs中LC3自噬基因表达水平, 方法同1.2.4, 引物序列由生工生物工程(上海)有限公司设计并合成。
1.3 统计学分析采用SPSS 19.0软件进行统计学分析, 计量资料采用x±s表示, 组间比较采用t检验;计数资料采用百分比(%)表示, 组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 ESCs分离、培养及鉴定ESCs培养24 h后呈梭形或多角形, 2 d后生长活跃, 6~7 d细胞生长达满视野, 传代后3~5 d细胞生长达满视野, 10代内形态基本不变。EECs呈蝌蚪形, 培养48 h呈漩涡状生长, 3 d生长迅速, 呈大细胞集落状生长, 5~6 d融合成片状, 7 d出现脂质空泡, 细胞开始崩解。采用免疫荧光鉴定2种细胞特性, 基质细胞免疫细胞化学染色为波形蛋白阳性, 而上皮细胞为角蛋白阳性, 见图 1。
|
| A, merge; B, DAPI; C, EECs express cytokeratin positive; D, ESCs express vimentin positive. 图 1 ESCs和EECs免疫荧光双染色×200 Fig.1 Representative flurescsent images of cytokeratin and vimentin expression in EECs and ESCs ×200 |
2.2 EM患者ESCs中miR-34a-5p表达水平降低, AKT1表达水平升高
原代分离及培养非EM及EM患者(各15例)在位ESCs, qRT-PCR检测miR-34a-5p及AKT1基因表达水平。结果显示, EM患者ESCs中miR-34a-5p表达水平(1.75±0.92)显著低于非EM患者(3.28±1.42), 差异有统计学意义(P < 0.01), 而AKT1基因表达水平(3.41±1.98)高于非EM患者(1.43±0.84), 差异有统计学意义(P < 0.01)。
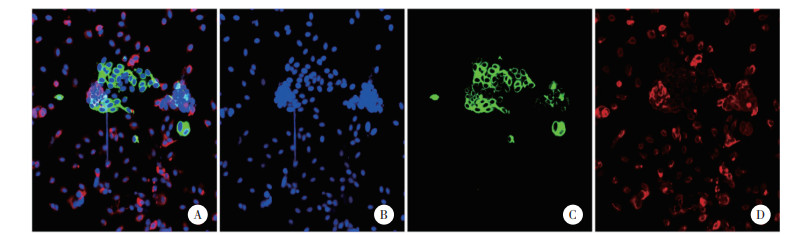
2.3 miR-34a-5p过表达ESCs中AKT1基因及蛋白表达水平降低ESCs分别转染NC及miR-34a-5p mimic 48 h后, RT-PCR检测2组细胞中miR-34a-5p及AKT1 mRNA表达水平, miR-34a-5p mimic组miR-34a-5p表达水平(3.41±1.03)显著升高(P < 0.01), 而AKT1基因(1.65±0.64)和蛋白表达水平降低(P < 0.05), 见图 1。
|
| 图 1 转染NC和miR-34a-5p mimic组ESCs中AKT1蛋白的表达水平 Fig.1 Expression of AKT1 in ESCs of NC group and miR-34a-5p mimic group |
2.4 miR-34a-5p与AKT1基因存在结合部位
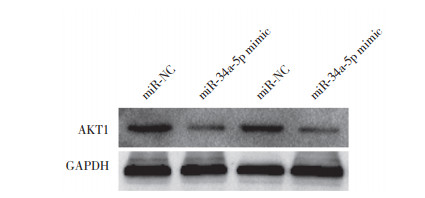
将野生型及突变型AKT1基因3’UTR荧光素酶报告基因质粒与NC及miR-34a-5p mimic分别共转染ESCs, 统计4组相对荧光素酶活性的差异。结果显示, 转染野生型AKT1基因3’UTR荧光素酶报告基因质粒的ESCs中, 转染miR-34a-5p mimic组较NC组相对荧光素酶活性显著降低(P < 0.01), 而转染突变型AKT1基因3’UTR荧光素酶报告基因质粒ESCs中, NC组及miR-34a-5p mimic组相对荧光素酶活性无统计学差异(P > 0.05)。说明ESCs中miR-34a-5p与AKT1基因存在一定的结合区域, miR-34a-5p对AKT1基因的表达具有调控作用。见图 2。
|
| * P < 0.01 vs miR-NC 图 2 miR-34a-5p与AKT1存在结合部位及调控作用 Fig.2 Verification of targeting relationship of miR-34a-5p and AKT1 |
2.5 miR-34a-5p过表达抑制ESCs增殖
ESCs分别转染NC及miR-34a-5p mimic后0、12、24、48 h, 检测OD值并绘制生长曲线。结果显示, NC组细胞增殖率较miR-34a-5p mimic组显著增强, 差异有统计学意义(P < 0.05), 见表 1。
| Group | 0 h | 12 h | 24 h | 48 h |
| miR-NC | 100±0.00 | 93.30±5.39 | 78.70±4.24 | 82.50±5.13 |
| miR-34a-5p mimic | 100±0.00 | 47.70±6.21 | 31.10±3.41 | 23.94±8.52 |
| P | - | < 0.05 | < 0.05 | < 0.05 |
2.6 miR-34a-5p过表达抑制ESCs迁移
细胞划痕实验结果显示, NC组ESCs的迁移能力(61.23%±1.5%)较miR-34a-5p mimic组(25.73%±1.1%)显著增强, 差异有统计学意义(P < 0.05), 见图 3。

|
| Images were acquired at 0 h (white line) and 48 h (black line). 图 3 miR-34a-5p过表达抑制ESCs迁移能力×200 Fig.3 Wound healing assay in miR-34a-5p mimic ESCs and NC ESCs ×200 |
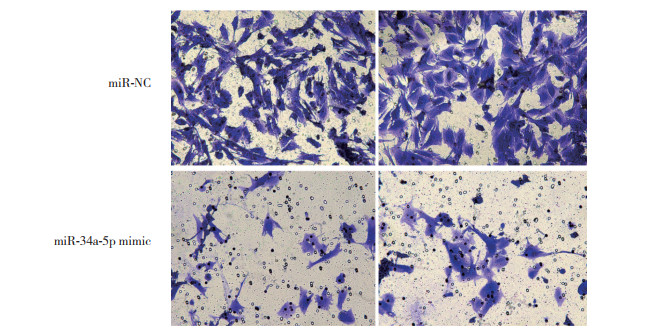
2.7 miR-34a-5p过表达抑制ESCs侵袭
Transwell实验结果显示, NC组ESCs的侵袭能力(86.34±5.1)较miR-34a-5p mimic组(34.91±3.6)显著增强, 差异有统计学意义(P < 0.05), 见图 4。
|
| 图 4 Transwell实验结果×400 Fig.4 Results of Transwell invation assay ×400 |
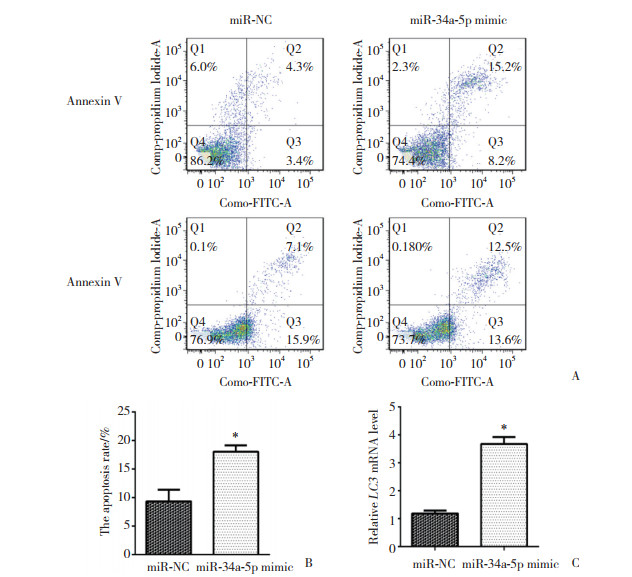
2.8 miR-34a-5p过表达促进ESCs凋亡及自噬
流式细胞仪检测结果显示, NC组ESCs凋亡率(8.82%±3.5%)较miR-34a-5p mimic组(17.42%±2.8%)显著降低, 差异有统计学意义(P < 0.05)。qRT-PCR结果显示, NC组LC3基因表达水平明显低于miR-34a-5p mimic组, 差异有统计学意义(P < 0.05)。见图 5。
|
| A, results of flow cytometery; B, apoptosis rate of ESCs; C, results of qRT-PCR. *P < 0.05 vs miR-NC group. 图 5 miR-34a-5p过表达促进ESCs凋亡及自噬 Fig.5 The overexpression of mir-34a-5p promoted the apoptosis and autophagy of ESCs |
3 讨论
既往研究[10-12]报道, EECs无法传代或传代生长缓慢、甚至死亡。本研究中, 原代分离及培养EECs后发现原代EECs传代后细胞贴壁数量少, 培养第7天细胞质内出现脂质空泡, 甚至细胞崩解。因此, 本研究选用ESCs作为主要研究对象。
研究[8, 13-16]发现, miR-34a-5p在多种疾病的发病中都具有重要的作用。GAO等[15]发现miR-34a-5p在结肠癌患者中低表达, 可靶向作用于P53促进肿瘤细胞转移及疾病复发。JIANG等[17]的研究结果显示, 藤黄菌素可通过上调miR-34a-5p靶向作用于MDM4基因, 抑制非小细胞肺癌患者癌细胞的抗凋亡能力, 从而消除或缩小癌灶。此外, miR-34a-5p对很多良性疾病的发病也具有调控作用, COSÍN-TOMÁS等[16]发现阿尔兹海默病患者与正常人血清中miR-34a-5p表达有差异。LI等[18]的研究结果表明miR-34a-5p在糖尿病肾病中也有重要作用, 高表达miR-34a-5p可抑制细胞增殖, 促进肾脏纤维化。本研究组通过分析前期基因芯片结果发现, miR-34a-5p在EM患者的子宫内膜组织中低表达, 经PR-PCR验证与芯片结果相符。EM是一种具有肿瘤特性的良性疾病, 本研究原代分离并培养了ESCs, 上调miR-34a-5p表达水平后, 发现ESCs增殖、侵袭、迁移能力较对照组明显下降, 而凋亡能力及自噬能力则明显升高。
AKT1基因编码丝氨酸/苏氨酸蛋白激酶, 可通过磷脂酰肌醇3激酶依赖的机制被胞外信号激活, 使底物蛋白磷酸化, 从而抑制肿瘤发生[19]。细胞中AKT1基因被异常激活后, 可使细胞侵袭、增殖、迁移、抗凋亡及浸润能力增强, 导致恶性肿瘤发生发展[20]。WANG等[21]研究发现, MAT1通过靶向作用于AKT1基因, 引起骨肉瘤细胞侵袭及抗凋亡能力增加, 促进癌细胞远处转移, 尤其是肺部转移。在多种恶性肿瘤的发病过程中, AKT1基因与miRNA具有密切联系, WEI等[22]发现, 高表达的miR-422a靶向作用于AKT1及MAPK1基因, 可使结肠癌细胞侵袭、抗凋亡能力及远处转移能力下降。本研究采用双荧光肾素酶报告系统验证了miR-34a-5p与AKT1基因存在结合部位, 且二者的表达水平呈负相关。此外, 本研究结果还显示, EM患者ESCs中miR-34a-5p呈低表达, 而AKT1表达水平升高;在EM患者ESCs过表达miR-34a-5p后, AKT1表达水平明显下降。提示二者可能参与EM发病的调控。
综上所述, 本研究证实了AKT1基因是miR-34a-5p的靶基因, 且miR-34a-5p通过抑制AKT1促进EM发病。
| [1] |
郎景和. 关于子宫内膜异位症的再认识及其意义[J]. 中国工程科学, 2009, 11(10): 137-142. DOI:10.3969/j.issn.1009-1742.2009.10.019 |
| [2] |
SINGH SS, SUEN MWH. Surgery for endometriosis:beyond medical therapies[J]. Fertil Steril, 2017, 107(3): 549-554. DOI:10.1016/j.fertnstert.2017.01.001 |
| [3] |
WILBUR MA, SHIH IM, SEGARS JH, et al. Cancer implications for patients with endometriosis[J]. Semin Reproductive Med, 2017, 35(1): 110-116. DOI:10.1055/s-0036-1597120 |
| [4] |
XU H, LIN FJ, WANG ZL, et al. CXCR2 promotes breast cancer metastasis and chemoresistance via suppression of AKT1 and activation of COX2[J]. Cancer Lett, 2018, 412: 69-80. DOI:10.1016/j.canlet.2017.09.030 |
| [5] |
KAO AP, WANG KH, CHANG CC, et al. Comparative study of human eutopic and ectopic endometrial mesenchymal stem cells and the development of an in vivo endometriotic invasion model[J]. Fertil Steril, 2011, 95(4): 1308-1315.e1. DOI:10.1016/j.fertnstert.2010.09.064 |
| [6] |
WANG Y, ZHANG HY, GE SH, et al. Effects of miR-138-5p and miR-204-5p on the migration and proliferation of gastric cancer cells by targeting EGFR[J]. Oncol Rep, 2018, 39(6): 2624-2634. DOI:10.3892/or.2018.6389 |
| [7] |
梁立春, 杨静, 冷淑杰, 等. 血管内皮生长因子与子宫内膜异位症发病关系的研究进展[J]. 黑龙江医药科学, 2014, 37(4): 32-33. DOI:10.3969/j.issn.1008-0104.2014.04.016 |
| [8] |
MA SJ, FU T, ZHAO SY, et al. MicroRNA-34a-5p suppresses tumorigenesis and progression of glioma and potentiates Temozolomide-induced cytotoxicity for glioma cells by targeting HMGA2[J]. Eur J Pharmacol, 2019, 852: 42-50. DOI:10.1016/j.ejphar.2019.03.005 |
| [9] |
BRILHANTE AVM, AUGUSTO KL, PORTELA MC, et al. Endometriosis and ovarian cancer:an integrative review (endometriosis and ovarian cancer)[J]. Asian Pac J Cancer Prev, 2017, 18(1): 11-16. DOI:10.22034/APJCP.2017.18.1.11 |
| [10] |
李圆月. 子宫内膜异位病灶形成中腺上皮细胞和间质细胞相互作用的研究进展[J]. 现代妇产科进展, 2014, 23(4): 319-320, 322. DOI:10.13283/j.cnki.xdfckjz.2014.04.021 |
| [11] |
王月玲, 李沛霖, 李洁, 等. 人子宫内膜腺上皮细胞的体外分离培养及纯化[J]. 天津中医药大学学报, 2017, 36(4): 291-294. DOI:10.11656/j.issn.1673-9043.2017.04.14 |
| [12] |
余莎, 谢梅青. 子宫内膜异位症在位子宫内膜间质及腺上皮细胞高纯度分离培养技术的改进[J]. 中国医学工程, 2016, 24(6): 30-33. DOI:10.19338/j.issn.1672-2019.2016.06.012 |
| [13] |
JING ZF, BI JB, LI Z, et al. Inhibition of miR-34a-5p can rESCsue disruption of the p53-DAPK Axis to suppress progression of clear cell renal cell carcinoma[J]. Mol Oncol, 2019, 13(10): 2079-2097. DOI:10.1002/1878-0261.12545 |
| [14] |
CHEN Q, LI L, TU Y, et al. MiR-34a regulates apoptosis in liver cells by targeting the KLF4 gene[J]. Cell Mol Biol Lett, 2014, 19(1): 52-64. DOI:10.2478/s11658-013-0115-y |
| [15] |
GAO J, LI N, DONG Y, et al. miR-34a-5p suppresses colorectal cancer metastasis and predicts recurrence in patients with stageⅡ/Ⅲ colorectal cancer[J]. Oncogene, 2015, 34(31): 4142-4152. DOI:10.1038/onc.2014.348 |
| [16] |
COSIN-TOMAS M, ANTONELL A, LLADO A, et al. Plasma miR-34a-5p and miR-545-3p as early biomarkers of alzheimer's disease:potential and limitations[J]. Mol Neurobiol, 2017, 54(7): 5550-5562. DOI:10.1007/s12035-016-0088-8 |
| [17] |
JIANG ZQ, LI MH, QIN YM, et al. Luteolin inhibits tumorigenesis and induces apoptosis of non-small cell lung cancer cells via regulation of microRNA-34a-5p[J]. Int J Mol Sci, 2018, 19(2): 447. DOI:10.3390/ijms19020447 |
| [18] |
LI AL, PENG R, SUN Y, et al. LincRNA 1700020I14Rik alleviates cell proliferation and fibrosis in diabetic nephropathy via miR-34a-5p/Sirt1/HIF-1α signaling[J]. Cell Death Dis, 2018, 9(5): 461. DOI:10.1038/s41419-018-0527-8 |
| [19] |
GAO F, ALWHAIBI A, SABBINENI H, et al. Suppression of Akt1-β-catenin pathway in advanced prostate cancer promotes TGFβ1-mediated epithelial to mesenchymal transition and metastasis[J]. Cancer Lett, 2017, 402: 177-189. DOI:10.1016/j.canlet.2017.05.028 |
| [20] |
TIWARI V, KAMRAN MZ, RANJAN A, et al. Akt1/NFΚB signaling pathway activation by a small molecule DMA confers radioprotection to intestinal epithelium in xenograft model[J]. Free Radic Biol Med, 2017, 108: 564-574. DOI:10.1016/j.freeradbiomed.2017.04.029 |
| [21] |
WANG JJ, NI JD, SONG DY, et al. MAT1 facilitates the lung metastasis of osteosarcoma through upregulation of AKT1 expression[J]. Life Sci, 2019, 234: 116771. DOI:10.1016/j.lfs.2019.116771 |
| [22] |
WEI WT, NIAN XX, WANG SY, et al. miR-422a inhibits cell proliferation in colorectal cancer by targeting AKT1 and MAPK1[J]. Cancer Cell Int, 2017, 17(1): 91. DOI:10.1186/s12935-017-0461-3 |
 2020, Vol. 49
2020, Vol. 49